2. 广西壮族自治区妇幼保健院病理科
放射性肺损伤(radiation-induced lung injury,RILI)为胸部肿瘤患者放射治疗的常见并发症,不仅制约放射剂量的提高,还可导致治疗中断甚至肿瘤局部控制率降低,影响患者的生活质量[1]。因此,明确RILI的发生机制显得尤为重要。
肺纤维化的特征之一为纤维母细胞增殖,纤维母细胞活化后可合成胶原,其活化的标志为α-平滑肌肌动蛋白(α-SMA)表达增加[2]。在促使纤维母细胞活化的因素中,转化生长因子β1(TGF-β1)最为重要[3],并且,TGF-β1还可以促进上皮细胞向间质细胞转化(epithelial-mesenchymal transition,EMT)[4]。肺表面活性物质相关蛋白A(SP-A)为肺泡Ⅱ型上皮细胞(alveolar epithelial type Ⅱ cell,ACEⅡ)分泌的活性蛋白之一,其表达降低提示ACEⅡ细胞的受损。本研究通过动态观察经15 Gy单次照射后几种蛋白因子的表达变化,探讨其在RILI中的可能作用。
1. 动物分组:健康雄性巴马小型猪由广西医科大学动物实验中心提供(动物合格证号:SCXK桂2009-0002),2~3个月龄,体重10~15 kg,该中心给予标准能量喂养,室温(25±1)℃,湿度(55±5)%,在此条件下饲养1周后无异常者入组实验。将入组的巴马小型猪采用随机数字表法分为健康对照组和照射组(每组20只)。
2. 照射方式及标本采集:采用60Co γ射线放射治疗仪(GWXJ80型,中国核动力研究设计院设备制造厂)作为照射源,射线从猪的背面单野垂直照射右肺,射野为9 cm×10 cm,吸收剂量15 Gy,源皮距80 cm,吸收剂量率3 Gy/min,健康对照组不予照射。分别于照射后4、8、12、24周,各组随机取5只小型猪,以3%戊巴比妥钠(30 mg/kg)腹腔麻醉后开胸,取右侧肺组织,部分于4%多聚甲醛中固定;部分于-80℃冰箱冻存。
3. 小型猪肺组织光镜观察:石蜡包埋的肺组织以4 μm的厚度连续切片,行HE染色以观察肺组织的病理改变。
4. 小型猪肺组织α-SMA免疫组织化学染色:石蜡切片常规脱蜡、水化,阻断内源性过氧化物酶10 min,经高压修复2 min、非免疫血清封闭后,加入α-SMA抗体(1∶400,美国Abcam公司)4℃过夜,经PBS洗后加入相应的二抗(北京中杉金桥生物技术有限公司)室温孵育10 min,滴入DAB 溶液(北京中杉金桥生物技术有限公司)显色,苏木素复染。细胞质呈棕黄色或黄色的为阳性。在×40倍镜下,从每张切片中选取5个阳性细胞相对集中的视野,采用Image Pro Plus专业图像分析软件进行分析,5个视野所得吸光度(A)的均值即为α-SMA的蛋白表达。
5. 小型猪肺组织SP-A和α-SMA免疫荧光双染:石蜡切片常规脱蜡、水化,枸橼酸液高压修复2 min,驴血清(美国Molecular Probes公司) 37℃封闭20 min后,加入含有SP-A抗体(1∶100,美国Abbiotec公司)和α-SMA抗体(1∶100,美国Abcam公司)的混合物4℃过夜,经PBS洗后加入AlexaFluor 594 驴抗小鼠和AlexaFluor 488 驴抗兔二抗(1∶100,美国Molecular Probes公司)于室温避光孵育1 h,经PBS洗后细胞核由4′,6-二脒基-2-苯基吲哚(北京碧云天生物技术研究所)室温避光孵育8 min。切片用激光扫描共聚焦显微镜(NikonA1)观察。
6. Western blot检测小型猪肺组织中TGF-β1、E\|钙黏蛋白(E-cadherin)和Vimentin:每40~80 mg肺组织在液氮中磨碎后加入700 ml含PMSF的裂解液(北京碧云天生物技术研究所),制成匀浆后于4℃,12 000×g,离心10 min。收集上清,-80℃贮存备用,并用BCA法(北京碧云天生物技术研究所)测定蛋白浓度。蛋白样品(每孔40 μg)经SDS-PAGE电泳后恒流(200 mA,80 min)转膜,然后将PVDF膜(美国Miliipore公司)移至封闭液中并于摇床上室温封闭1 h,分别加入相应的抗体(GAPDH 1∶5 000,美国Miliipore公司; TGF-β1 1∶50,美国Biovision公司; E-cadherin 1∶500及Vimentin 1∶1 000,美国Abcam公司),于4℃孵育过夜。1×TBST洗膜后,分别加入相应的HRP酶标记的二抗(山羊抗兔或马抗鼠二抗,1∶2 000;广州聚研生物科技公司)室温孵育1 h,然后用ECL+化学发光试剂盒(美国Pierce公司)检测,最后将PVDF膜经ImageQuant LAS500扫膜,并用凝胶图像处理系统半定量分析。
7. 统计学处理:结果用 ±s表示。采用SPSS 13.0软件进行数据处理,数据经方差齐性检验后,各组间比较采用单因素方差分析,两两比较方差齐者采用LSD-t检验,方差不齐者采用Games-Howell检验。P<0.05为差异有统计学意义。
±s表示。采用SPSS 13.0软件进行数据处理,数据经方差齐性检验后,各组间比较采用单因素方差分析,两两比较方差齐者采用LSD-t检验,方差不齐者采用Games-Howell检验。P<0.05为差异有统计学意义。
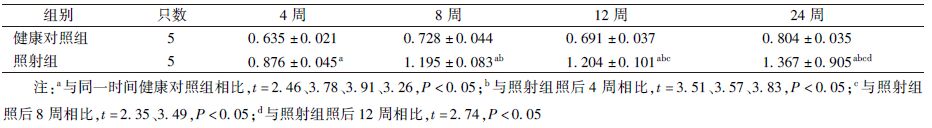
1. 肺组织病理形态学改变:健康对照组肺组织结构清晰,肺泡腔结构正常,无炎症细胞浸润。在照射组,照射后第4周,肺组织以渗出性病变为主,表现为肺间质及肺毛细血管充血,较多炎症细胞浸润,间质水肿致肺泡壁轻微增厚。照射后第8、12周,肺组织渗出减轻,以纤维性病变为主,肺泡壁增厚明显,肺泡腔明显缩小,可见较多的成纤维细胞,纤维组织增生。照射后第24周,肺实质见大量纤维组织,较多肺泡腔塌陷消失(图1)。
|
图1 照射后不同时间肺组织病理学改变 ×10 A.健康对照组;B.照后4周;C.照后8周;D.照后12周;E.照后24周 |
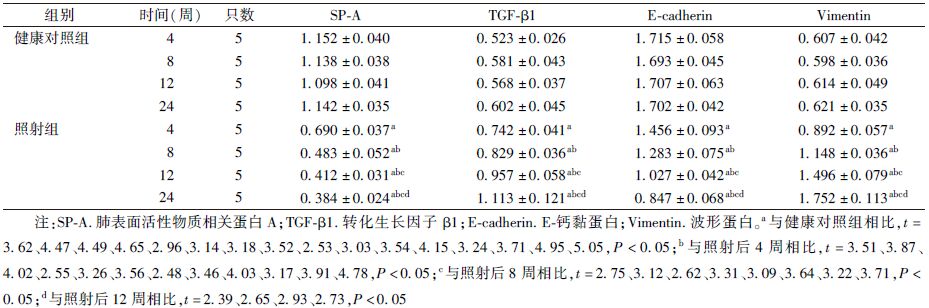
2. α-SMA的蛋白表达:照射组从照射后2周起肺组织内α-SMA表达开始增加,随着照射后时间的延长,肺间质内开始出现大量增生的阳性细胞,多聚集呈团层状或旋涡状存在于纤维化病灶内。与健康对照组相比,随着时间的延长,4、8、12、24周照射组α-SMA的蛋白表达呈现逐步升高的趋势,差异具有统计学意义(t=2.46、3.78、3.91、3.26,P<0.05),见图2和表1。
|
图2 照射后不同时间肺组织α-SMA蛋白表达 免疫组织化学染色 ×40 A.健康对照组;B.照后4周;C.照后8周; D.照后12周;E.照后24周 |
表1 照射后不同时间两组α-SMA蛋白的相对表达变化( ±s) ±s)
|
3.肺组织中TGF-β1、SP-A、Vimentin和E-cadherin的蛋白表达:见表2,图3。健康对照组照后各时间点TGF-β1、SP-A、Vimentin和E-cadherin蛋白表达变化不大,而照射组中TGF-β1、Vimentin的表达均高于健康对照组,并随时间增加而增加,而E-cadherin及SP-A的蛋白表达呈下降趋势。在不同的时间点,与健康对照组相比,差异均具有统计学意义(SP-A:t=3.62~4.65,P<0.05;TGF-β1:t=2.96~3.52,P<0.05;Vimentin:t=3.24~5.05,P<0.05;E-cadherin:t=2.53~4.15,P<0.05)。
表2 照射后不同时间SP-A、TGF-β1、E-cadherin 和Vimentin 蛋白的相对表达变化( ±s) ±s)
|

|
图3 照射后不同时间点Vimentin、TGF-β1、E-cadherin(A)和SP-A(B)蛋白的电泳图 |
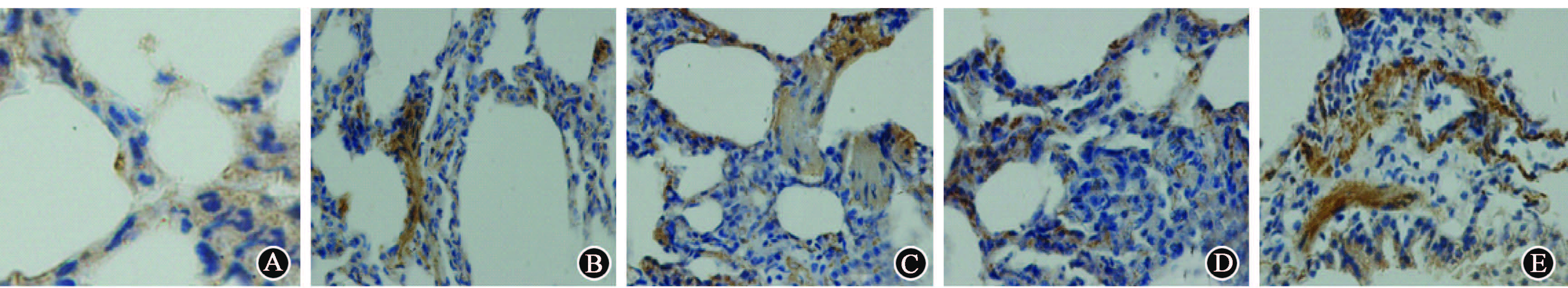
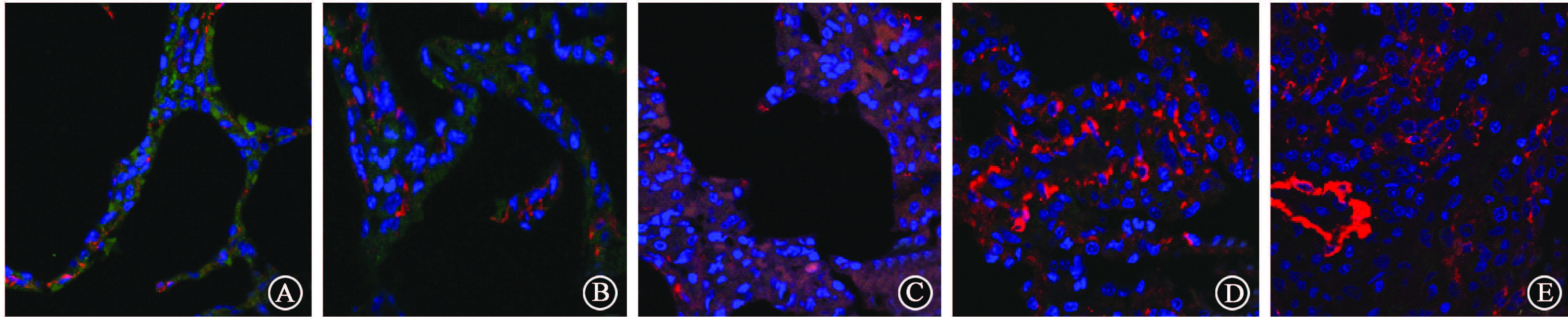
4. α-SMA和SP-A蛋白在肺泡上皮细胞的共表达:肺组织切片用α-SMA和SP-A蛋白共染,发现在照射组ACEⅡ细胞出现α-SMA和SP-A蛋白的共染,且于照射后第8周最明显,而健康对照组未发现共染现象(图4)。
|
图4 照射后不同时间α-SMA与SP-A蛋白在肺泡上皮细胞的共表达 α-SMA和SP-A蛋白共染 ×20 A. 健康对照组;B. 照后4 周;C. 照后8 周;D. 照后12 周;E. 照后24 周 注:红色为α?SMA 蛋白,绿色为SP?A 蛋白,蓝色为细胞核,橙色为红色和绿色重叠 |
RILI已经成为接受胸部放射治疗患者的常见并发症,目前,关于RILI的研究多采用啮齿类动物作为模型[5, 6],而啮齿类动物的肺不仅在解剖结构上与人肺差别较大,且不同小鼠品系的肺组织对放疗的反应也不相同[7]。巴马小型猪的肺组织不仅在结构上与人较为接近,且单次照射的剂量-效应关系也与人相似[8]。放射性肺炎一般发生在放疗后的1~3个月内,表现为肺间质水肿,毛细血管充血、淤血及较多的炎症细胞浸润。肺纤维化多发生在照射后6个月到1年,表现为纤维母细胞过度增殖,胶 原和基质蛋白沉积。在本研究中,小型猪经15 Gy的右胸单次照射后,于第4周出现放射性肺炎的变化,到第12周,纤维化病变开始出现并逐步加重。这些变化提示已建立了RILI的模型,且放射性肺炎和纤维化在照射后第8周并没有完全分开,而是有部分重叠。
肺泡上皮细胞由Ⅰ型细胞和Ⅱ细胞组成,其中Ⅱ型细胞因能增殖分化为Ⅰ型细胞,被认为是肺泡上皮的干细胞;且肺组织受损后,其异常修复也是肺纤维化的重要病理特征之一[9]。SP-A为ACEⅡ细胞分泌的表面活性蛋白,文献表明其可通过CD11通路来抑制某些炎症因子的产生和释放,从而避免级联反应的发生,减轻肺的损伤[10]。因此,SP-A可以看作是一种抗炎介质,当肺受到照射致使炎症介质增多时,即打破了炎症介质/抗炎介质的平衡。且有研究发现,SP-A在肺放射性损伤的早期预测中起着重要作用[11]。本实验中,在激光共聚焦扫描显微镜下可见,健康对照组中SP-A阳性表达的细胞(即ACEⅡ细胞)位于小型猪肺组织的肺泡壁,而在照射组小型猪肺组织中,SP-A阳性表达的细胞随照射后时间延长逐渐减少,且照射后SP-A的蛋白表达逐渐下降,这些提示照射可引起Ⅱ型细胞发生改变,且SP-A蛋白的下调可能促进细胞因子如TGF-β1的表达,从而加速放射性肺损伤的发生发展。而SP-A在照射后第4周下降幅度最大,提示SP-A可作为放射性肺损伤的预测指标之一。
TGF-β1不仅是重要的促纤维化因子之一,还可促进EMT的发生[4, 5]。[JP3]在此过程中,上皮细胞的极性和细胞间连接消失,上皮细胞的标志下调(E-cadherin),间质细胞的标志上调(α-SMA、Vimentin),[JP]细胞的侵袭性和迁移性增加[12]。本研究中,TGF-β1的蛋白表达水平在照射后呈时间依赖性升高,进一步表明了TGF-β1在RILI的发病机制中的重要作用。α-SMA为肌成纤维细胞活化的标志蛋白,活化的肌成纤维细胞可分泌TGF-β1等多种炎症因子,而TGF-β1又可刺激肌成纤维细胞活化,进而形成一个炎症反应自我激发的正反馈效应,最终加重并延续纤维化病程。在本研究中,免疫组织化学结果显示,照射组中α-SMA的蛋白表达随照射后的时间延长逐步增多,且激光共聚焦扫描显微镜观察到α-SMA阳性表达细胞的分布区域和程度与免疫组织化学的结果相似。提示肌成纤维细胞在放射性肺纤维化的发生进展中可能发挥着重要作用。
E-cadherin是上皮细胞中维持细胞连接的主要蛋白,Vimentin则是组成间质细胞中最主要的中间纤维。已有的文献显示,在多种因素引起的肺纤维化病变过程中,观察到了上皮细胞经EMT可以转化成肌成纤维细胞[13, 14],同时发生E-cadherin的表达下调和Vimentin的表达上调。同样,大鼠的RLE-6TN细胞进行照射后,发现该细胞获得了间质细胞的表型[15],动物实验也发现,照射后小鼠的ACEⅡ细胞也检测到了α-SMA和pro-SP-C共染的现象[16]。本实验中,激光共聚焦扫描显微镜下可见,照射组中SP-A阳性表达的细胞随照射逐渐减少,而α-SMA阳性表达的细胞不断增多,当采用重合叠加技术,可观察到肺间质的一些细胞质内既有SP-A表达阳性的细胞,又有α-SMA表达阳性的细胞,即SP-A和α-SMA共定位于肺组织的同一细胞内。这些结果提示,ACEⅡ细胞获得了间质细胞的表型,即放射性肺损伤发展的过程中发生了ACEⅡ细胞向肌成纤维细胞转化。Western blot结果也显示,与健康对照组相比,E-cadherin和SP-A表达下调,而标记间质细胞的Vimentin表达上调,且免疫组织化学结果也显示,α-SMA表达上调。这些结果均提示,在放射性肺损伤发生时,存在着上皮-间质细胞转化的过程,而EMT是引起细胞外基质异常沉积的重要因素之一,也是促进放射性肺纤维化发生、发展的重要环节。
本研究表明,TGF-β1和SP-A联合检测,不仅可以较早地预测RILI的发生,且可弥补单独某因子作为预测指标的不足。同时,也证明了在小型猪放射性肺损伤模型中,发生了上皮细胞向间质细胞的转化,且肺间质中的肌成纤维细胞部分来源于ACEⅡ细胞的转化,从而为RILI的防治提供新的思路。
| [1] | Stone HB, Coleman CN, Anscher MS, et al. Effects of radiation on normal tissue: consequences and mechanisms[J]. Lancet Oncol, 2003, 4(9): 529-536. |
| [2] | Wynn TA. Cellular and molecular mechanisms of fibrosis[J]. J Pathol, 2008, 214(2): 199-210. |
| [3] | Verrecchia F, Mauviel A. Transforming growth factor-beta and fibrosis[J]. World J Gastroenterol, 2007, 13(22): 3056-3062. |
| [4] | Graves PR, Siddiqui F, Anscher MS, et al. Radiation pulmonary toxicity: from mechanisms to management[J]. Semin Radiat Oncol, 2010, 20 (3): 201-207. |
| [5] | Li M, Abdollahi A, Gröne HJ, et al. Late treatment with imatinib mesylate ameliorates radiationinduced lung fibrosis in a mouse model[J]. Radiat Oncol, 2009, 4:66. |
| [6] | Molthen RC, Wu Q, Fish BL, et al. Mitigation of radiation induce pulmonary vascular injury by delayed treatment with captopril[J]. Respirology, 2012, 17(8): 1261-1268. |
| [7] | Williams JP, Brown SL, Georges GE, et al. Animal models for medical countermeasures to radiation exposure[J]. Radiat Res, 2010, 173 (4): 557-578. |
| [8] | Hopewell JW, Rezvani M, Moustafa HF. The pig as a model for the study of radiation effects on the lung[J]. Int J Radiat Biol, 2000, 76 (4): 447-452. |
| [9] | Adamson IY, Young L, Bowden DH. Relationship of alveolar epithelial injury and repair to the induction of pulmonary fibrosis[J]. Am J Pathol, 1988, 130 (2): 377-383. |
| [10] | Alcorn JF, Wright JR. Surfactant protein A inhibits alveolar macrophage cytokine production by CD14-independent pathway[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286 (1): L129-L136. |
| [11] | Sasaki R, Soejima T, Matsumoto A, et al. Clinical significance of serum pulmonary surfactant proteins a and d for the early detection of radiation pneumonitis[J]. Int J Radiat Oncol Biol Phys, 2001, 50 (2): 301-307. |
| [12] | Kalluri R, Weinberg RA. The basics of epithelial-mesenchymal transition[J]. J Clin Invest, 2009, 119 (6): 1420-1428. |
| [13] | Andersson-Sjoland A, Nihlberg K, Eriksson L, et al. Fibrocytes and the tissue niche in lung repair[J]. Respir Res, 2011, 12: 76. |
| [14] | Wynn TA. Integrating mechanisms of pulmonary fibrosis[J]. J Exp Med, 2011, 208 (7): 1339-1350. |
| [15] | Nagarajan D, Melo T, Deng Z, et al. ERK/GSK3beta/Snail signaling mediates radiation-induced alveolar epithelial-to-mesenchymal transition[J]. Free Radic Biol Med, 2012, 52 (6): 983-992. |
| [16] | Almeida C, Nagarajan D, Tian J, et al. The Role of alveolar epithelium in radiation-induced lung injury[J]. PLoS One, 2013, 8 (1): e53628. |
 2015, Vol. 35
2015, Vol. 35