调强放疗(IMRT)是当前临床肿瘤精确放疗的主要技术方式,多叶光栅(MLC)的使用及其较大的剂量变化梯度,可能导致放疗剂量计算出现较大的误差,IMRT前进行剂量学验证非常必要[1, 2]。而二维验证的方法存在无法得知临床治疗时患者各解剖结构剂量误差大小[3]。因此,本研究使用三维质控系统(COMPASS,IBA Dosimetry)对本院8例宫颈癌患者的IMRT计划进行基于解剖信息的三维剂量学验证,并试图寻找第三方计算剂量验证的方法。 一、资料与方法
1. 临床资料:选取在山西省肿瘤医院行IMRT治疗的8例宫颈癌患者,年龄36~75岁,中位年龄55岁。照射野采用7野均分的照射方式,危及器官包括:小肠、直肠、膀胱、脊髓、肾脏和股骨头。处方剂量:要求95%的计划靶区体积(PTV)体积接受50~52 Gy剂量。该研究经山西省肿瘤医院伦理委员会讨论批准,患者均签订知情同意书。
2. 仪器与设备:比利时IBA公司MatriXX电离室探测器阵列,三维剂量验证采用比利时IBA 公司的CompassR系统,该系统可由剂量分布重建计算(collapsed cone convolution,CCC)模型进行独立计算得到第3方计算剂量分布(computed dose distribution,CDD)对治疗计划系统(treatment planning system,TPS)的计划计算结果进行独立的计算验证;也可采用MatriXX探测器阵列实际测量得到的加速器积分通量在患者CT影像的重建剂量三维剂量分布(reconstructed dose distribution,RDD),对治疗计划及治疗实施的准确性进行验证。
3. 加速器和治疗计划系统:使用美国Varian公司生产的Trilogy电子直线加速器和Eclipse 8.6治疗计划系统,算法选用各向异性分析算法(Anisotropic Analytical Algorithm,AAA)算法,计算网格为2 mm × 2 mm。
4. 三维剂量验证:分别分析患者照射区域整体以及各器官剂量分布的3%/3 mm的γ通过率。通过对CDD-TPS、RDD-TPS进行比较,选用D95%(表示PTV接受的处方剂量)、 D2%(近似最大值)、Dmean(平均剂量)3个参数的偏差及V5%(剂量差别超过5%的体积)的偏差反映PTV的剂量验证情况。ΔCDD=(CDD-TPS)/ TPS×100%,ΔRDD=(RDD-TPS)/ TPS×100%。
5. 统计学处理:数据以x±s表示。采用SPSS 17.0软件进行分析。两组计划间指标的比较采用配对t检验。P<0.05为差异有统计学意义。 二、结果
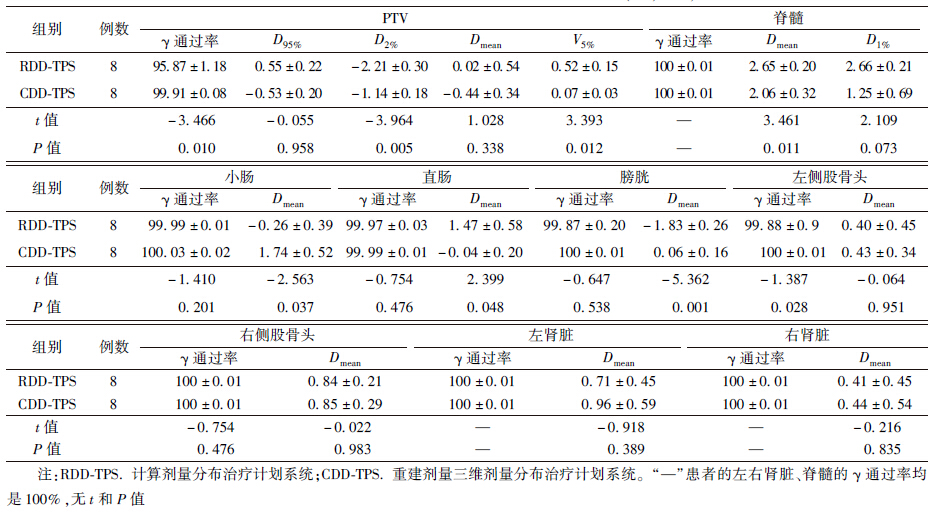
1. γ通过率:RDD-TPS和CDD-TPS的γ通过率列于表 1。由表 1可知,RDD-TPS的PTV、脊髓、小肠、直肠、膀胱、左右侧股骨头及左右侧肾脏的γ通过率在95%~100%,CDD-TPS相应的γ通过率在99%~100%。RDD-TPS和CDD-TPS比较,仅PTV和左侧股骨头γ通过率差异有统计学意义(t=-3.466、-1.387,P<0.05);而脊髓、小肠、直肠、膀胱、右侧股骨头及左右侧肾脏的γ通过率差异无统计学意义(P>0.05)。
| 表 1 宫颈癌IMRT治疗计划三维剂量验证参数评价(%,x±s) |
2. 剂量体积偏差:RDD-TPS和CDD-TPS比较,PTV的D2%、 V5%、 脊髓、小肠、直肠、膀胱的Dmean,差异有统计学意义(t=-3.964、3.393、3.461、-2.563、2.399、-5.362,P<0.05);PTV的D95%与左右侧股骨头和左右侧肾脏的Dmean差异无统计学意义(P>0.05)。详细各感兴趣区域三维剂量验证的不同参数评价结果列于表 1。 三、讨论
IMRT精确放疗治疗计划的验证要求比较严格,传统的二维剂量验证大多是采用体模移植计划,依此比较TPS的计划和测量值的绝对量和平面剂量的误差[4, 5]。二维剂量验证一般采取照射野角度归零,这和实际治疗过程有一定的差别[6],且二维剂量验证无法判断靶区和解剖结构实际照射和计划剂量分布是否一致。因此,二维剂量验证无法完全体现实际治疗过程的剂量误差。CompassR可弥补传统剂量验证方法缺少解剖信息、与临床治疗不完全相同的照射方式等缺点。林海磊等[7]对CompassR系统做了评价,测试系统剂量重建精度可满足IMRT验证要求,并能给出与患者解剖结构相关的体积剂量误差与误差位置等信息,有利于评估其对临床的影响[8, 9]。
结果显示,两组比较的γ通过率都在95%以上,D95%、 D2%和Dmean的偏差均<3%,显示PTV的CDD、RDD与TPS的剂量计算结果有很好的符合,CDD-TPS的误差比RDD-TPS小,这表明计划剂量和独立计算剂量分布有很好的吻合性,而和重建剂量分布吻合相对较差,但均>95%。同时宫颈癌的IMRT治疗密切关注正常组织的剂量照射情况,对正常器官均选用Dmean和γ通过率作为评价项目,基本上可以得知正常组织的剂量照射误差情况,只有脊髓增加一个V1%,以近似体现脊髓最大剂量的误差,结果显示,各正常器官的剂量分布γ通过率都在95%以上,平均剂量误差也都在3%以内。值得注意的是脊髓的最大剂量和平均剂量误差虽然也在3%以内,但是误差相对于其他指标较大,这可能是由于脊髓体积比较小导致。本研究同时比较了CDD-TPS、RDD-TPS之间的差异,PTV、小肠、左侧股骨头的γ通过率、PTV的D2%、 V5%、 小肠、直肠、膀胱、脊髓的Dmean差异都有统计学意义,但通过率均在90%以上。这种差异的存在主要是由于高剂量区的差别较大,正常组织的低剂量区域和高剂量区域的体积比值较大,这表明虽然RDD-TPS、CDD-TPS之间没有绝对的一致性,但这也为临床是否需要做RDD剂量验证提供一定的参考,可以在做RDD之前先通过CDD进行第三方剂量验证,如果CDD-TPS通过率较差,可以再及时进行RDD剂量验证,这不仅减轻验证人员工作量,而且为患者剂量准确的实施提供了双重保障。
三维剂量验证能提供治疗计划执行时与患者解剖结构相关的三维体积剂量误差信息,了解感兴趣区域的剂量分布情况,并且可以提供1个第三方计算剂量验证,所以,三维剂量验证系统对临床剂量验证有很大的应用价值。
| [1] | Hendee WR, Herman MG. Improving patient safety in radiation oncology[J]. Med Phys, 2011, 38(1): 78-82. |
| [2] | Bortfeld T, Boyer AL, Schlegel W, et al. Realization and verification of three -dimensional conformal radiotherapy with modulated fields[J]. Int J Radiat Oncol Biol Phys, 1994, 30(4): 899-908. |
| [3] | Nelms BE, Zhen HM, Tomé WA. Per-beam planar IMRT QA passing rates do not predict clinically relevant patient dose errors[J]. Med Phys, 2011, 38(2): 1037-1043. |
| [4] | Low DA, Moran JM, Dempsey JF, et al. Dosimetry tools and techniques for IMRT[J]. Med Phys, 2011, 38(3): 1313-1338. |
| [5] | Kruse JJ. On the insensitivity of single field planar dosimetry to IMRT inaccuracies[J]. Med Phys, 2010, 37(6): 2516-2524. |
| [6] | Li QL, Deng XW, Chen LX, et al. The angular dependence of a 2-dimensional diode array and the feasibility of its application in verifying the composite dose distribution of intensity modulated radiation therapy[J]. Chin J Cancer, 2010, 29(6): 617-620. |
| [7] | 林海磊,黄劭敏,邓小武,等. 基于解剖在线测量的调强放疗三维剂量验证系统测试与应用[J].中华放射肿瘤学杂志,2012, 21(3): 271-274. |
| [8] | Godart J, Korevaar EW, Visser R, et al. Reconstruction of high-resolution 3D dose frommatrix measurements: error detection capability of the COMPASS correction kernel method[J]. Phys Med Biol, 2011, 56 (15): 5029-5043. |
| [9] | Boggula R, Jahnke L, Wertz H, et al. Patient-specific 3D pretreatment and potential 3D online dose verification of Monte Carlo-calculated IMRT prostate treatment plans[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 1168-1175. |
 2015, Vol. 35
2015, Vol. 35