尽管宫颈癌的筛查、诊断及治疗取得了很大进步,但仍占妇科肿瘤死因的14%[1]。宫颈癌主要播散方式为淋巴转移,且淋巴结转移顺序模式基本不变,即从盆壁淋巴结到髂总淋巴结,再到腹主动脉淋巴结组[2]。腹主动脉旁淋巴结(para-aortic lymph node,PALN)转移是影响预后的重要因素,是宫颈癌最常见的转移区域之一。宫颈癌经初始治疗(手术或盆腔放疗)后出现PALN转移进行放化疗可获得长期生存[3],对单独PALN转移而无其他部位复发或者转移的患者甚至可达到根治[4]。调强放疗(intensity modulated radiation therapy,IMRT)能够提高肿瘤的局部剂量,减少正常组织受量[5, 6],而同步化疗可提高放疗敏感性,增强放疗疗效[7]。本研究采用IMRT技术治疗宫颈癌疗后PALN转移患者,比较IMRT同步TP化疗与单纯放疗的近期效果和远期生存率。
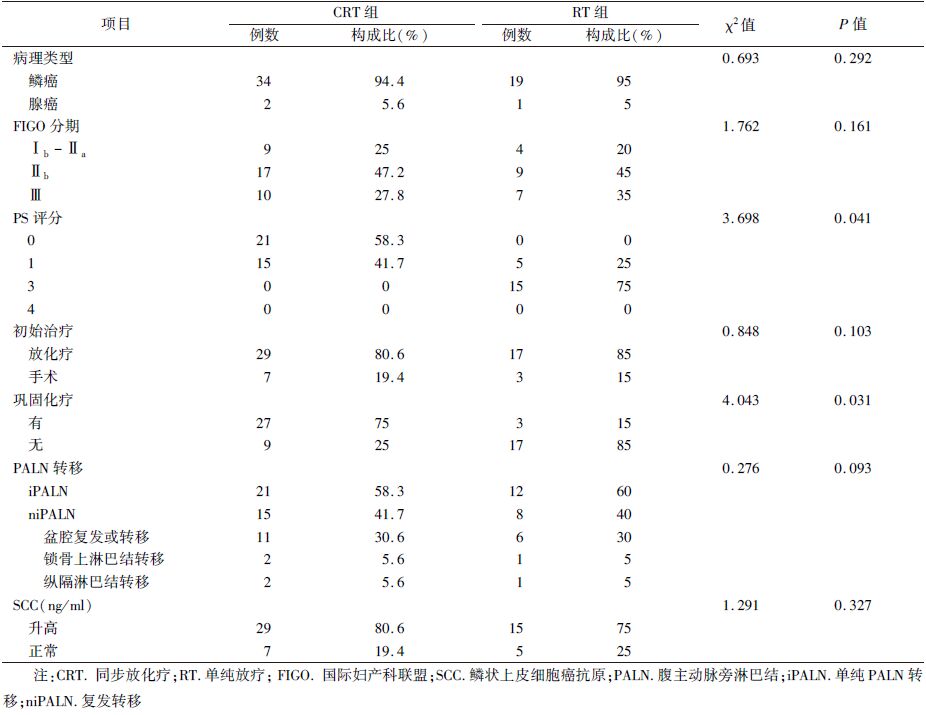
1.临床资料:选取2008年10月至2013年8月北京大学肿瘤医院收治的宫颈癌初始治疗后PALN转移患者56例,所有患者既往均未接受过腹腔放疗。由表 1所示,患者中位年龄51岁(31~67岁),鳞癌53例,腺癌3例;无症状21例,有症状35例,其中腰骶部疼痛27例(单纯疼痛20例,合并阴道出血6例,合并下肢水肿1例),阴道出血10例,单侧下肢水肿/疼痛/麻木4例,排尿困难1例。单纯PALN转移(isolated PALN,iPALN)患者33例,合并其他部位复发转移(nonisolated PALN,niPALN)23例。接受同步放化疗(CRT组)者36例,单纯放疗(RT组)者20例。该研究经过医院伦理委员会论证,所有患者均签署知情同意书。
| 表 1 患者的临床病理学特点 |
初治为宫颈癌根治术的患者10例,2例行术后放疗,全盆腔放疗 45~50 Gy;初治为盆腔放疗患者46例,外照射采用IMRT或快速弧形调强放疗(RapidArc)技术,全盆腔放疗45 Gy/25次,根据分期确定是否盆壁加量,外照射3周开始行192Ir后装治疗4~6次,A点总剂量75~85 Gy,放疗同步均进行含顺铂方案化疗。
2.诊断标准:如果腹部CT示腹主动脉旁肿块短径超过1 cm,结合临床症状或肿瘤标记物 SCC等升高,诊断为PALN转移,并行盆腔CT或MRI、颈部超声、胸片或胸部CT,或者行PET-CT检查,排除其余部位转移和盆腔复发。合并阴道残端或宫颈局部复发者尽量获取病理活检。
3.治疗方法:患者平卧,双手交叉抱肘置额前,热塑体模固定,CT模拟机扫描定位。放疗技术:均采用固定野动态IMRT,常规分割,1.8~2 Gy/次,5次/周。大体肿瘤体积(gross target volume,GTV)为转移淋巴结区,临床靶区体积(clinical target volume,CTV)包括PALN淋巴引流区。PALN转移区放疗剂量:GTV 55~60 Gy,25~30次;CTV 45~50 Gy,25~30次,共5~6周。
放化疗组患者在放疗过程中采用TP方案同步化疗,第1天紫杉醇135 mg/ m2,顺铂60 mg/m2 2 d,21 d重复。放化疗结束后,继续接受巩固化疗,共计化疗4~6个周期。
单纯放疗组患者的身体状况无法耐受化疗,放疗结束后未再接受巩固化疗。
4.评价指标:观察症状、体征变化和不良反应。根据腰骶部疼痛、阴道出血、下肢水肿疼痛等症状的缓解来评价症状缓解率;根据CTC3.0[8],评价不良反应。
5.随访:治疗结束后1~2个月复查MRI、CT、B超及肿瘤标志物SCC,按RECIST1.1标准[9]进行评价。以后每3个月复查1次,2年后每6个月复查1次。
自PALN转移区放疗结束时开始计算随访时间,总生存(overall survival,OS)时间从PALN开始放疗到死亡或末次随访时,无进展生存(progression-free survival,PFS)时间从PALN开始放疗到出现疾病进展或死亡或末次随访时。
6.统计学处理:首要观察终点为客观缓解率、总生存率和无进展生存率,次要观察终点为治疗不良反应。应用SPSS 18.0软件进行分析,其中生存分析采用Kaplan-Meier法,行Logrank检验,计数资料采用χ2检验,连续变量采用t检验。P<0.05为差异有统计学意义。
1. 治疗完成情况:自初治结束至发现PALN转移,中位时间为8.9个月(3.1~78.4个月)。末次随访时间为2015年2月7日,中位随访时间22.7个月(2.7~74.4个月)。放疗患者中,1例(1.8%,RT组)未完成PALN转移区放疗,该患者是由于合并宫颈癌复发,行腔内放疗,给予阴道盒放疗15 Gy/3次后,患者突发宫颈大出血,紧急介入栓塞止血,宫颈肿瘤形成空洞,该患者后因肿瘤进展死亡。同步化疗患者中,CRT组的36例中,完成1、2、3个周期TP方案化疗的患者分别为22例(61.1%)、11例(30.6%)和3例(8.3%)。
2. 症状缓解:经过上述治疗后,总体症状缓解率为80%(28/35),治疗前有腰骶部疼痛的症状缓解率为77.8%(21/27),阴道出血(10例)8例未再出血,4例下肢水肿伴疼痛或麻木的患者治疗后有3例水肿减轻,其中1例基本恢复正常。1例排尿困难的患者,行肾盂造瘘术,放疗后可顺利排尿,取出造瘘管。
3.近期疗效:患者治疗结束后1~3个月内行腹部增强CT评价PALN转移灶局部疗效,有效率(CR+PR)为89.3%(50/56),CRT和RT组的有效率分别为91.7%(33/36)和85%(17/20)(χ2 =0.516,P>0.05),CR 27例,PR 23例,SD 6例。6例SD者后续随访中发现5例照射野内转移淋巴结缩退达到CR或PR,平均时间为8个月(5~12个月),1例3个月后PD。
4.生存分析:CRT和RT组患者的中位PFS为68.3和16个月,3年PFS率分别为50.4%和29.2%(χ2 = 4.184,P<0.05,图 1)。两组患者的中位OS时间为38个月和23个月,3年OS率分别为57.5%和32.7%(χ2 = 4.059,P<0.05,图 2)。iPALN与niPALN两组患者的中位OS分别为71.2和21.4个月,3年OS率分别为53%和39.5%(χ2 = 4.265,P<0.05,图 3)。
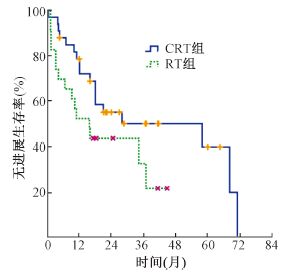 | 图 1 CRT组和RT组患者的无进展生存曲线 |
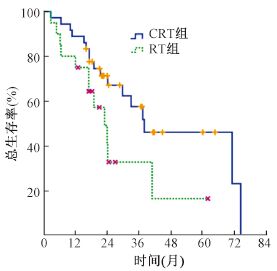 | 图 2 CRT组和RT组患者的总生存曲线 |
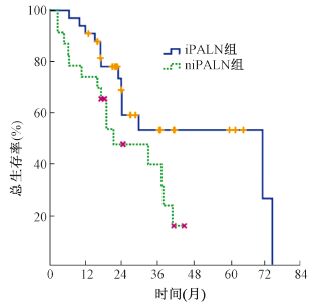 | 图 3 iPALN组和niPALN组患者的总生存曲线 |
5.SCC变化:56例患者中,治疗前44例高于1.5 ng/ml(2.7~89.4 ng/ml),治疗后,31例患者降到正常(70.5%,31/44),CRT和RT组SCC降至正常的比例分别为79.3%(23/29)和53.3%(8/15)。12例SCC下降但未至正常,RT组1例SCC较前升高。
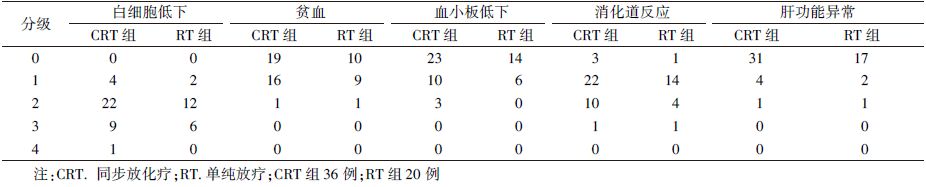
6.不良反应:主要不良反应为骨髓抑制、消化道反应、肝功能异常等(表 2)。其中,CRT和RT组出现3~4级白细胞低下的患者分别为10例(27.8%)和6例(30%),3级消化道反应各有1例,差异均无统计学意义(P>0.05)。
| 表 2 患者放化疗的急性不良反应(例) |
宫颈癌分期越晚,PALN转移率越高[10]。术后病理分期的一项研究中,Ⅱb期和Ⅲ期宫颈癌PALN转移率分别为21%和31%[11]。宫颈癌PALN转移区放疗疗效较好,单独PALN转移的患者甚至可获得根治[3, 4, 12]。所以,有学者认为PALN 转移是局部病变而不是全身病变,放疗可起到挽救作用[10, 13, 14]。
虽然常规放化疗治疗PALN转移有一定效果,但由于PALN周围有重要器官(如脊髓、小肠、肾脏等),常规放疗使这些危及器官不可避免地受到较高剂量的照射,不良反应增加,导致治疗中断、疗效变差。放疗同时再加上化疗,虽然能提高疗效,但也增加了不良反应,甚至因不能耐受而中断治疗[4]。与常规放疗相比,IMRT技术可提高肿瘤的放疗剂量,降低正常组织受量及高剂量受照体积[5, 6, 15, 16],有可能减少不良反应,耐受放疗加同步化疗的不良反应。
合并盆腔复发的患者由于初治时手术和放疗使患者血管破坏,血运差,化疗药物不能充分有效地进入,一部分因既往行放化疗后骨髓功能差,或因肿瘤压迫导致输尿管梗阻肾盂积水甚至肾功能减退,限制了化疗药物的使用[17],尽管化疗方案很多,但药物不良反应大,有效率低,维持时间短,化疗总有效率仅为20%~35%,中位生存时间仅为5~12个月[18, 19, 20]。放疗同步进行化疗的原因主要有:可作为放疗增敏剂来增强放疗疗效,主要包括顺铂等铂类为基础的化疗。紫杉醇与铂类作用机制不同,联合使用可能起到协同的抗肿瘤作用[21, 22, 23];此外,PALN转移再次治疗后失败的主要原因是远处转移[16, 23, 24, 25],全身化疗的目的是降低远处转移发生率。
本研究中,36例患者在IMRT的基础上同步给予TP方案化疗,完成2~3个周期化疗的患者接近40%,与单纯放疗相比,并没有明显增加不良反应,可见采用调强放疗同步TP方案化疗的不良反应可以耐受。但本研究的RT组患者多数是由于既往行盆腔同步放化疗或辅助放化疗,导致的骨髓抑制未恢复正常或者身体状况较差,无法耐受PALN转移区放疗的同步化疗,CRT组患者前期治疗的骨髓抑制基本恢复或者身体状况较好,所以两组患者的PS评分及治疗耐受性有差异,所以可能导致两组患者的不良反应相当。
本研究中,两组的近期有效率相似,但CRT组的3年OS率(57.5%)和PFS率(50.4%),均明显高于RT组的32.7%和29.2%。近期有效率相当,说明PALN转移可以通过单纯放疗得到有效控制。OS及PFS两组的差异较大,分析原因认为:1两组患者的PS评分不同。CRT组患者PS评分多为0~1分,RT组多为1~2分,直接影响预后;2治疗强度不同。由于两组PS评分及骨髓情况的差异,导致患者治疗强度的差异,CRT组PS评分及骨髓情况好,能够接受同期放化疗,放化疗后继续接受巩固化疗,RT组无法耐受同期化疗以及后续的化疗,所以,治疗强度的差异可能是主要的原因。由此,也间接地佐证同期化疗可以起到放疗增敏作用,但其主要优势在于控制远处转移,从而提高生存。
综上,认为IMRT同步TP方案化疗的近期和远期疗效较好,主观症状缓解率和近期有效率较好,不良反应可耐受。单独PALN转移的患者可获得长期生存。但本研究是建立在回顾性研究的基础上,该结论仍需要前瞻性的随机对照研究进一步证实。
| [1] | Siegel R, Ma J, Zou Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29. |
| [2] | Sakurai H, Mitsuhashi N, Takahashi M, et al. Analysis of recurrence of squamous cell carcinoma of the uterine cervix after definitive radiation therapy alone: patterns of recurrence, latent periods, and prognosis[J]. Int J Radiat Oncol Biol Phys, 2001,50(5):1136-1144. |
| [3] | Niibe Y, Kenjo M, Kazumoto T, et al. Multi-institutional study of radiation therapy for isolated para-aortic lymph node recurrence in uterine cervical carcinoma: 84 subjects of a population of more than 5,000[J]. Int J Radiat Oncol Biol Phys, 2006,66(5):1366-1369. |
| [4] | Hong JH, Tsai CS, Lai CH, et al. Recurrent squamous cell carcinoma of cervix after definitive radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004,60(1):249-257. |
| [5] | Liu SP, Huang X, Ke GH, et al. 3D radiation therapy or intensity-modulated radiotherapy for recurrent and metastatic cervical cancer: the Shanghai Cancer Hospital experience[J]. PLoS One, 2012,7:e40299. |
| [6] | Ahmed RS, Kim RY, Duan J, et al. IMRT dose escalation for positive para-aortic lymph nodes in patients with locally advanced cervical cancer while reducing dose to bone marrow and other organs at risk[J]. Int J Radiat Oncol Biol Phys, 2004,60(2):505-512. |
| [7] | Singh AK, Grigsby PW, Rader JS, et al. Cervix carcinoma, concurrent chemoradiotherapy, and salvage of isolated paraaortic lymph node recurrence[J]. Int J Radiat Oncol Biol Phys, 2005,61(2):450-455. |
| [8] | Trotti A, Colevas AD,Setser A,et al. (2003) CTCAE v3.0: Development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol,2013,13(3):176-181. |
| [9] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009,45(2):228-247. |
| [10] | Niibe Y, Kazumoto T, Toita T, et al. Frequency and characteristics of isolated para-aortic lymph node recurrence in patients with uterine cervical carcinoma in Japan: a multi-institutional study[J]. Gynecologic Oncol, 2006,103(2):435-438. |
| [11] | Heller PB, Maletano JH, Bundy BN, et al. Clinical-pathologic study of stage IIB, III, and IVA carcinoma of the cervix: extended diagnostic evaluation for paraaortic node metastasis—a Gynecologic Oncology Group study[J]. Gynecologic Oncol, 1990,38(3):425-430. |
| [12] | Huang EY, Wang CJ, Chen HC, et al. Multivariate analysis of para-aortic lymph node recurrence after definitive radiotherapy for stage IB-IVA squamous cell carcinoma of uterine cervix[J]. Int J Radiat Oncol Biol Phys, 2008,72(3):834-842. |
| [13] | Seo Y, Kim MS, Yoo HJ, et al. Salvage stereotactic body radiotherapy for locally recurrent uterine cervix cancer at the pelvic sidewall: Feasibility and complication[J]. Asia-Pac J Clin Oncol, 2014, In press. |
| [14] | 孙萍, 白萍. 子宫颈癌腹主动脉旁淋巴结转移的诊断及治疗[J]. 中国肿瘤临床, 2010, 37(10):597-600 |
| [15] | Lim K, Small WJ,Portelance L, et al. Consensus guidelines for delineation of clinical target volume for intensity-modulated pelvic radiotherapy for the definitive treatment of cervix cancer[J]. Int J Radiat Oncol Biol Phys, 2011,79(2):348-355. |
| [16] | Portelance L, Chao KS, Grigsby PW, et al. Intensity-modulated radiation therapy (IMRT) reduces small bowel, rectum, and bladder doses in patients with cervical cancer receiving pelvic and para-aortic irradiation[J]. Int J Radiat Oncol Biol Phys, 2001, 51(1): 261-266. |
| [17] | Moore DH, Blessing JA, McQuellon RP, et al. Phase III study of cisplatin with or without paclitaxel in stage IVB, recurrent, or persistent squamous cell carcinoma of the cervix: a gynecologic oncology group study[J]. J Clin Oncol, 2004, 22(15): 3113-3119. |
| [18] | Tsuda H, Hashiguchi Y, Nishimura S, et al. Phase I-II study of irinotecan (CPT-11) plus nedaplatin (254-S) with recombinant human granulocyte colony-stimulating factor support in patients with advanced or recurrent cervical cancer[J]. Br J Cancer, 2004,91(6):1032-1037. |
| [19] | Monk BJ, Sill MW, McMeekin DS, et al. Phase III trial of four cisplatin-containing doublet combinations in stage IVB, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study[J]. J Clin Oncol, 2009,27(28):4649-4655. |
| [20] | Phippen NT, Leath CA, Miller CR, et al. Are supportive care-based treatment strategies preferable to standard chemotherapy in recurrent cervical cancer?[J]. Gynecol Oncol, 2013, 130(2): 317-322. |
| [21] | Thigpen T, Vance RB, Khansur T. The platinum compounds and paclitaxel in the management of carcinomas of the endometrium and uterine cervix[J]. Semin Oncol, 1995,22(5):67-75. |
| [22] | Nagai Y, Toita T, Wakayama A, et al. Concurrent chemoradiotherapy with paclitaxel and cisplatin for adenocarcinoma of the cervix[J]. Anticancer Res, 2012,32(4):1475-1479. |
| [23] | 于长华,朱卫国,吉雅玲,等. 局部进展期宫颈癌同步放化疗的临床随机对照研究[J].中华放射医学与防护杂志,2013,33(3):286-289. |
| [24] | Kim JS, Kim JS, Kim SY, et al. Hyperfractionated radiotherapy with concurrent chemotherapy for para-aortic lymph node recurrence in carcinoma of the cervix[J]. Int J Radiat Oncol Biol Phys, 2003, 55(5): 1247-1253. |
| [25] | Grigsby PW, Vest ML, Perez CA. Recurrent carcinoma of the cervix exclusively in the paraaortic nodes following radiation therapy[J]. Int J Radiat Oncol Biol Phys, 1994,28(2):451-455. |
 2015, Vol. 35
2015, Vol. 35