2. 华南肿瘤学国家重点实验室 中山大学肿瘤防治中心放疗科
原发性胃恶性淋巴瘤(primary gastric malignant lymphoma,PGL)起源于胃黏膜固有层淋巴组织,其病理类型主要为B细胞来源。临床上较少见,占恶性肿瘤的2%~5%,PGL大部分为非霍奇金淋巴瘤(non-Hodgkins lymphoma,NHL)[1],原发性胃弥漫大B细胞淋巴瘤(primary gastric diffuse large B-cell lymphoma,PG-DLBCL)是胃非霍奇金淋巴瘤(primary gastrointestinal non-Hodgkins lymphoma,PG-NHL)中最常见的病理类型。近年来PGL的发病率呈升高的趋势,传统治疗以手术为主,最近化疗和放疗已逐步转变为主要治疗手段,但目前尚无公认的治疗标准[2]。通过回顾性分析本院收治PG-DLBCL患者的治疗结果,对不同治疗方式的疗效进行比较。
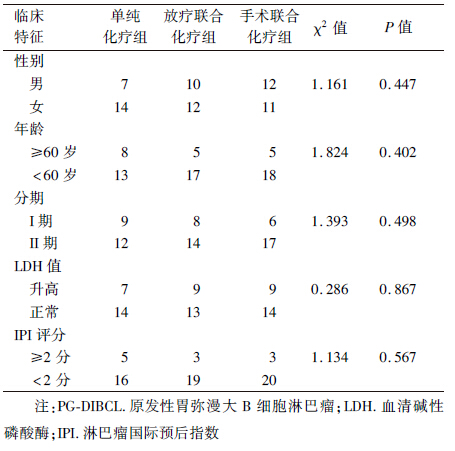
1.病例资料:选取2000年8月至2011年10月中山大学附属肿瘤医院治疗的PG-DLBCL患者,均经病理科按照世界卫生组织(WHO)标准确诊,有完整的临床资料。共收治早期PG-DLBCL患者66例,男女比例为0.89[DK]∶1,年龄15~79岁,中位年龄49岁。其中,手术联合化疗组23例,放疗联合化疗组22例,单纯化疗组21例。3组患者临床特征差异均无统计学意义(表 1)。疾病分期参照WHO关于恶性淋巴瘤新的分类及诊断标准[3]:将I期和Ⅱ期定义为疾病早期。按照淋巴瘤国际预后指数(IPI)评分[4],将患者分为低危险/低中危险组(0~2分)和中高危险/高危险组(3~5分)两组。
| 表 1 66例早期PG-DLBCL患者的临床特征 |
2.治疗方式:分为单纯化疗、放疗联合化疗以及手术联合化疗。手术为根治性切除或姑息性切除;化疗方案包括环磷酰胺+多柔比星+长春新碱+泼尼松(CHOP)及足叶乙甙+CHOP、利妥昔单抗+CHOP等(CHOP样)方案,疗程数为2~8个周期,中位疗程为6周期;放疗方式为三维适形放疗(3D-CRT)或调强放疗(IMRT),照射范围包括全胃+胃周淋巴结,总吸收剂量为24.0~45.0 Gy,单次剂量为1.6~2.0 Gy,中位总吸收剂量为36.0 Gy。
3.疗效评价:按照非霍奇金淋巴瘤国际疗效评价标准进行疗效评价,将治疗反应分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和疾病进展(PD)。
4.随访:全部病例以电话访问和门诊复查方式进行随访。自病理确诊之日起开始计算生存期,随访止于2013年12月31日,总随访时间为8~132个月,中位随访时间为46.5个月。
5.统计学处理:应用SPSS 17.0软件进行统计分析,计量资料比较用t检验;计数资料用χ2检验;用Kaplan-Meier法计算生存率、绘制生存曲线,各组生存率比较用Log-rank分析。P<0.05为差异有统计学意义。
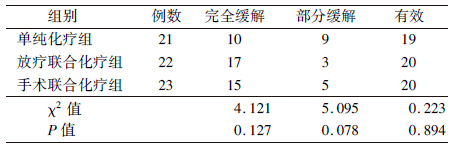
1. 疗效分析:所有入组病例均在治疗结束1个月后经CT、胃镜或者PET-CT评估疗效。放疗联合化疗组CR比例(77.3%)高于单纯化疗组(47.6%)和手术联合化疗组(65.2%),但差异无统计学意义,各组有效例数RR(CR+PR)情况如表 2。
| 表 2 早期PG-DLBCL患者3种治疗方式的疗效评价(例) |
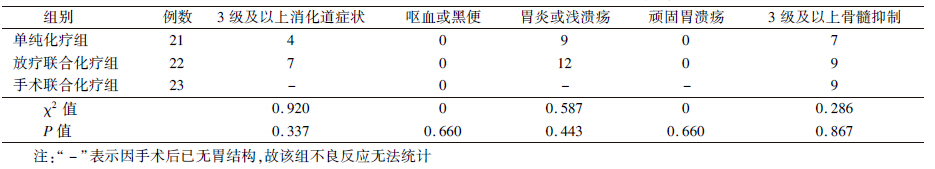
2. 不良反应分析:患者的不良反应主要包括消化道症状(呕血、黑便、胃炎或浅溃疡)以及骨髓抑制(白细胞、血小板减少),全组无治疗相关的死亡病例,见表 3。对于放疗联合化疗组患者,在放疗结束后的初期随访中,有部分胃镜报告为浅表性胃炎或浅胃溃疡,经抑酸、保胃治疗后好转,没有患者在治疗中和治疗后出现胃出血(呕血或便血),无反复胃溃疡的病例,可能会有大便隐血阳性,但未进行统计。部分患者食欲减退的症状会有逐渐恢复的过程,一般半年左右,1年后症状完全消失。有些病例甚至在放疗中随着肿瘤的消退,进食会有显著改善,治疗结束时体重反而比放疗前增加。
| 表 3 早期PG-DLBCL患者3种治疗方式的不良反应(例) |
3. 生存分析:截至2013年12月31日,总随访时间为8~132个月,中位随访时间46.5个月,共有12例患者死亡,其中1例(8.3%)患者于发病后8个月死亡,10例(83.3%)患者于发病后2年内死亡,还有1例于发病后84个月死亡,均死于疾病未控或进展。Kaplan-Meier生存分析显示,单纯化疗组、放疗联合化疗组、手术联合化疗组中位无进展生存期(PFS)分别为61.5个月(95%CI:42.2~80.9)、90.4个月(95%CI:79.0~101.7)、79.1个月(95%CI:54.4~103.8),放疗联合化疗组中位PFS高于其他两组,且差异有统计学意义(χ2=6.726,P < 0.05,图 1);单纯化疗组平均总生存期(OS)为80.6个月(95%CI:65.8~95.4)、放疗联合化疗组平均OS为91.0个月(95%CI:80.5~101.6)、手术联合化疗组平均OS为107.6个月(95%CI:88.8~126.4),随访期内3组患者均未达到中位OS;3年生存率分别为81.6%、90.5%、82.6%;5年生存率为72.5%、90.5%、82.6%,放疗联合化疗组5年生存率高于其他两组,但差异无统计学意义(P>0.05,图 2)。
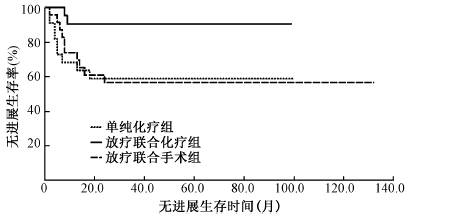 | 图 1 3组患者无进展生存曲线 |
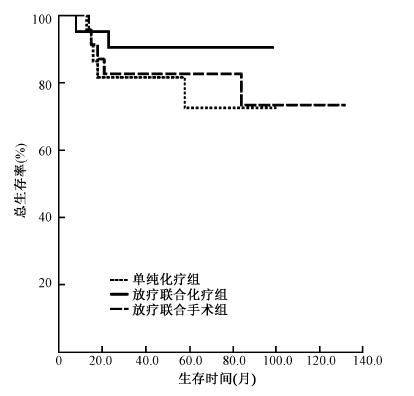 | 图 2 3组患者总生存曲线 |
胃可以发生任何亚型的淋巴瘤,但主要为黏膜相关淋巴组织结外边缘区B细胞淋巴瘤(mucosa-associated lymphoid tissue lymphoma,MALT)和DLBCL两种组织学类型(>90%)[3],霍奇金淋巴瘤则罕见。PG-DLBCL的临床症状主要表现为腹痛、腹部包块以及恶心、呕吐、黑便等[5],容易误诊为胃癌或其他胃部肿瘤。
PG-DLBCL的诊断与分期包括胃镜、消化道钡餐、腹部CT、腹部超声、PET-CT等。其中,消化道钡餐是最基本的检查方法,但准确性较低;腹部CT可以较准确的显示病变部位、大小以及与周围脏器的关系,而且能显示周围淋巴结受侵情况;PET-CT能够全面了解患者全身情况,对胃淋巴瘤分期具有很好的指导作用,但费用较高;胃镜检查是最直观的方法,能够取得病变组织进行病理以及免疫组织化学分析,大多数PG-DLBCL是通过胃镜活检获得诊断和分型的[6]。虽然人们对胃淋巴瘤的认识较过去深入,但是仍有部分患者在接受胃镜或腹部CT检查后被误诊为胃癌而接受了胃切除手术[7]。
对于PG-DLBCL的治疗,CHOP或CHOP样方案为主的联合化疗一直是一线疗法,随着放化疗技术的不断发展,以及手术相关并发症常见且严重,使得保留原有胃结构的非手术治疗越来越受到重视[8],手术在该类疾病中的治疗作用有较大争议,有文献报道,外科手术在PGL的治疗中已不作为首选的治疗方案[9, 10, 11]。对于胃Ⅰ/Ⅱ期 DLBCL患者接受4~6个疗程CHOP化疗联合放疗或手术切除,两组5年OS分别为78.0%和79.0%,提示手术联合化疗效果并不优于化疗联合放疗[12, 13],与本组临床研究结果相似。加拿大一项长期的临床研究发现,Ⅰ\-a和Ⅱ\-a期胃淋巴瘤患者术后放疗受益的剂量为20~25 Gy,10年无复发生存率为86%[14]。Gobbi等[15]的研究结果也提示单纯化疗或化疗后联合放疗与手术联合化疗的治疗方式缓解率相似,因此建议对于Ⅰ\-a和Ⅱ\-a期胃淋巴瘤患者不再需要进行胃切除术。在欧洲,一项包括393例患者的大样本的临床研究中,对于早期胃原发淋巴瘤患者采用化疗和放疗联合或不联合手术治疗,手术组和非手术组的42个月的生存率分别为86%和91%,二者的生存率接近[16]。这些研究结果都说明对于早期胃原发淋巴瘤患者,采用放疗等其他非手术治疗手段的疗效可以达到与手术治疗相当的疗效。
本组临床研究中,单纯化疗组、放疗联合化疗以及手术联合化疗组CR比例为47.6%、77.3%和60.9%,提示采用化疗联合其他治疗方式的综合治疗的患者较单纯化疗组的CR比例提高,因此,为了提高患者的CR比例和有效率,应该采用综合治疗的方式。放疗联合化疗组CR比例稍高于手术联合化疗组(77.3%和60.9%),手术改变患者的胃肠道的正常结构,对患者造成明显的创伤以及生存质量的下降;而放疗能够更好的维持胃肠道的功能,且放疗剂量在24.0~45.0 Gy之间,中位放疗剂量为36 Gy,对患者脊髓、小肠、肾脏等重要器官的影响不大。放疗联合化疗组患者在放疗过程中除了恶心、呕吐、腹泻等一般胃肠道症状和化疗常见的白细胞、血小板减少等血液不良反应外,很少有放疗后的顽固性胃溃疡、出血等严重的放疗反应出现。比较单纯化疗组与放疗联合化疗组的血液不良反应可以看出,接受放疗的患者白细胞、血小板减少并未明显增加。
Kaplan-Meier生存分析显示,3组患者的中位PFS,放疗联合化疗组中位PFS明显长于手术联合化疗组和单纯化疗组,且差异有统计学意义。由此可见,放疗联合化疗较其他的治疗方式能够更彻底地杀灭肿瘤组织,降低患者复发的风险。进一步分析OS,单纯化疗组5年生存率低于放疗联合化疗组和手术联合化疗组,从生存曲线来看,放化疗联合组与其他两组有一定分离,但差异无统计学意义,可能需要增大样本量,来获得更可靠的结论。
总之,结合本临床研究和文献结果认为早期胃原发DLBCL的综合治疗效果较好,放疗联合化疗的治疗方式并未明显增加治疗的不良反应,而且能够提高患者的生存质量,并能够有效提高患者的PFS,在综合治疗中发挥越来越大的作用,可能为早期PG-DLBCL的首选治疗方式。
| [1] | d'Amore F, Brincker H, Grnbaek K, et al. Non-Hodgkin's lymphoma of the gastrointestinal tract: a population-based analysis of incidence, geographic distribution, clinicopathologic presentation features, and prognosis. Danish Lymphoma Study Group[J]. J Clin Oncol,1994, 12(8):1673-1684. |
| [2] | 张剑, 王梦筠, 许立超,等. 原发性胃弥漫大B细胞淋巴瘤的临床分析[J].中华肿瘤杂志, 2010,32(8): 614-618. |
| [3] | Koch P, del Valle F, Berdel WE, et al. Primary gastrointestinal non-Hodgkin's lymphoma: II. Combined surgical and conservative or conservative management only in localized gastric lymphoma—results of the prospective German Multicenter Study GIT NHL 01/92[J]. J Clin Oncol,2001, 19(18): 3874-3883. |
| [4] | Musshoff K, Schmidt-Vollmer H. Proceedings: Prognosis of non-Hodgkin's lymphomas with special emphasis on the staging classification[J]. Z Krebsforsch Klin Onkol Cancer Res Clin Oncol,1975, 83(4): 323-341. |
| [5] | Papageorgiou SG, Sachanas S, Pangalis GA, et al. Gastric involvement in patients with primary mediastinal large B-cell lymphoma[J]. Anticancer Res, 2014,34(11):6717-6723. |
| [6] | Boot H. Diagnosis and staging in gastrointestinal lymphoma[J]. Best Pract Res Clin Gastroenterol,2010, 24(1): 3-12. |
| [7] | 王小沛,邓文,刘卫平,等.原发性胃弥漫大B细胞淋巴瘤69例临床分析[J].肿瘤,2011,31(11):1036-1041. |
| [8] | 刘辉,张汝鹏,李 NFDA1 璇,等.原发性胃淋巴瘤204例临床病理特征与预后影响因素分析[J].中华外科杂志,2012,50(2):106-109. |
| [9] | Persky DO, Unger JM, Spier CM, et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014[J]. J Clin Oncol, 2008, 26 (14):2258-2263. |
| [10] | Aleman BM, Haas RL, van der Maazen RW. Role of radiotherapy in the treatment of lymphomas of the gastrointestinal tract[J]. Best Pract Res Clin Gastroenterol,2010, 24(1):27-34. |
| [11] | 赵鸿鹰, 王宇, 赵鸿雁, 等. 6 例幽门螺杆菌阴性的胃黏膜相关组织淋巴瘤临床分析[J].中国肿瘤临床,2008,35(18): 1052-1053. |
| [12] | Ishikura S, Tobinai K, Ohtsu A, et al. Japanese multicenter phase II study of CHOP followed by radiotherapy in stage I-II, diffuse large B-cell lymphoma of the stomach[J]. Cancer Sci, 2005,96(6): 349-352. |
| [13] | Park YH, Lee SH, Kim WS, et al. CHOP followed by involved field radiotherapy for localized primary gastric diffuse large B-cell lymphoma: results of a multi center phase II study and quality of life evaluation[J]. Leuk Lymphoma,2006,47(7): 1253-1259. |
| [14] | Gospodarowicz MK, Pintilie M, Tsang R, et al. Primary gastric lymphoma: brief overview of the recent Princess Margaret Hospital experience[J]. Recent Results Cancer Res,2000,156:108-115. |
| [15] | Gobbi PG, Ghirardelli ML, Cavalli C, et al. The role of surgery in the treatment of gastrointestinal lymphomas other than low-grade MALT lymphomas[J]. Haematologica, 2000, 85(4): 372-380. |
| [16] | Koch P, Probst A, Berdel WE, et al. Treatment results in localized primary lymphoma: data of patients registered within the German multicenter study(GIT NHL 02/96)[J]. J Clin Oncol, 2005,23(28): 7050-7059. |
 2015, Vol. 35
2015, Vol. 35