2. 宁波市医疗中心李惠利医院放疗科
三维适形放疗(3DCRT)及调强放射治疗(IMRT)已成为现阶段食管癌放射治疗的主要治疗手段[1]。但食管癌三维适形放疗过程中是否进行区域淋巴结预防性照射仍存在较多争议。Zhao等[2]研究分析了食管癌仅行累及野照射的治疗失败模式,认为放疗后主要的失败模式为照射野内复发及远处转移,照射野外区域淋巴结转移仅占8%,因此,认为累及野放疗是可行的。但是该研究的研究对象为普通人群,中位年龄为64岁(44~84岁),尚未有针对老年人进行亚组分析研究结果。老年人因其脏器功能较差,伴发基础疾病较多,尤其肺的耐受性下降,减少肺放射剂量,缩小照射野范围对他们更为重要。而对于不能耐受化疗的老年患者,缩小照射野范围是否增加野外区域淋巴结转移亦值得探讨。因此,本研究对此进行了回顾性分析,观察淋巴结累及野照射(IFI)和预防性照射(ENI)的总生存率、疾病无进展生存率及失败模式,肺受照剂量及放射性肺炎发生情况,探讨老年食管癌患者行根治性单纯放疗时仅行累及野放疗的可行性。
1.研究对象:收集2007年10月至2010年12月期间在浙江大学医学院附属第一医院及宁波市医疗中心李惠利医院就诊的70岁以上食管鳞癌患者共79例。所有病例均为初治患者,胃镜病理证实为食管鳞癌,未发现其他脏器转移,KPS评分均>70,无严重心肺脑等慢性疾病。根据治疗方式分为IFI和ENI两组,两组患者的年龄、性别、分段和淋巴结转移情况差异均无统计学意义(P>0.05),见表 1。
| 表 1 79例老年食管癌患者的临床特征 |
2.放疗技术:放疗采用调强放射治疗(IMRT),大体肿瘤靶体积(GTV)为食管原发灶和肿大淋巴结(气管食管沟淋巴结短径≥0.5 cm,纵隔淋巴结短径≥1 cm),同时参考食管镜及食管钡餐的结果,IFI组临床靶体积(CTV)为GTV+食管原发病灶上、下3 cm的正常食管,计划靶体积(PTV)为CTV外放0.5 cm。ENI组CTV1在 GTV 左右前后方向均放 0.5 cm ( 平面 ),上下各外放3 cm,PTV1为CTV1+ 0.5 cm。CTV2包括预防照射的淋巴引流区。具体范围:颈段及胸上段为锁骨上淋巴引流区、食管旁、 2、4、5、7区;中段为食管旁、2、4、5、7区的淋巴引流区;下段为食管旁、 4、5、7区和胃左、贲门周围的淋巴引流区。其中区域淋巴结的划分依据美国1996年AJCC-UICC对胸部淋巴结的分组[3]。PTV2在 CTV2基础上各外放0.5 cm。危及器官为双肺、脊髓和心脏。IFI组CTV的剂量为52.0~66.5 Gy,平均剂量为64 Gy。IFI组PTV的剂量处方为54.0~70.0 Gy(其中1名老年患者接受40 Gy照射后复查,原发病灶已经完全缓解,总剂量为54 Gy),单次剂量为1.8~2.2 Gy,共5.4~7.4周,平均剂量为63.0 Gy。ENI组的CTV的剂量为52.0~68.5Gy,平均剂量为64.5 Gy。ENI组PTV1的剂量处方为54.0~71.0 Gy(其中2名患者因放射性食管炎无法耐受,完成总量54 Gy),单次剂量1.8~2.2 Gy,共5.4~7.6周,平均剂量62.6 Gy,IFI组PTV与ENI组PTV1剂量差异无统计学意义(P>0.05)。ENI组PTV2处方剂量为50.4~54.0 Gy,采用同程加速方法放疗。
3.随访:随访时间3~68个月,中位随访时间24个月。患者放疗结束后6~8周开始随访评价。随访采用X射线钡餐造影及颈胸腹部增强CT评价。治疗后2年内每3个月复查1次;2年后如果患者无复发证据,则每4~6个月1次。
4.疗效观察指标:观察患者1、2、3年的疾病无进展时间,总生存率及放射不良反应包括放射性食管炎、放射性肺炎、血液学毒性等发生情况。疾病无进展生存时间定义为放疗结束至随访期间出现疾病复发或转移的时间,总生存时间定义为放疗结束至死亡的时间。放疗结束后6个月内原病变部位出现病灶者,将其定义为局部未控,超过6个月以后局部出现病灶者将其定义为肿瘤复发,其中放疗野内的复发成为野内复发,放疗野外局部复发为野外复发,随访期间出现其他器官新病灶定义为远处转移。
5. 统计学处理:数据以x表示,采用SPSS 20软件进行统计分析,总生存率及疾病无进展生存相关的统计用Kaplan-Meier法,组间计数资料比较采用χ2检验,计量资料用t检验。P < 0.05为差异有统计学意义。1.治疗疗效:IFI组的1、2、3年疾病无进展生存率分别为60.4%、34.9%、29.7%,ENI组为64.5%、54.0%及35.0%,两组比较差异无统计学意义(P>0.05)。两组的1、2、3年总生存率分别为IFI组72.9%、43.4%、31.5%,ENI组73.0%、53.0%、38.3%,两组比较差异无统计学意义(P>0.05),见图 1,两组中位生存期分别为25.3月和28.9月,ENI组有提高生存的趋势,两组比较差异无统计学意义(P>0.05)。
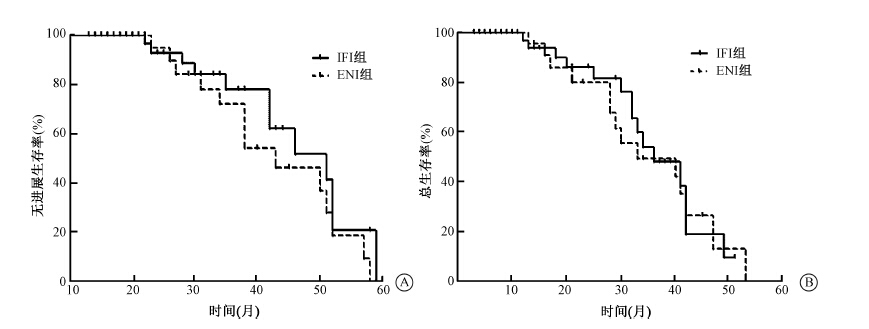 | 注:IFI.累及野照射,ENI.预防野照射图 1 两组的疾病无进展生存率(A)及总生存率(B) |
2.失败模式分析:根据失败部位分为远处转移、放疗野内复发及放疗野外复发3种类型。IFI组11例发生远处转移(其中4例出现远处转移的同时出现局部复发),9例放疗野内复发(其中3例为疾病未控),4例出现放疗野外复发(其中2例为食管第二原发肿瘤,1例为腹膜后淋巴结转移,1例为食管气管沟淋巴结转移),故该组照射野外区域淋巴结转移2例;ENI组8例出现远处转移(其中2例出现远处转移的同时出现疾病复发),6例放疗野内复发(其中2例为局部未控),并无放疗野外局部复发。两组局部失败的比例分别为27.0%及22.5%(P>0.05),两组失败模式比较差异无统计学意义,见表 2。
| 表 2 累及野照射组和预防野照射组的治疗结果比较 |
3. 放疗参数及不良反应比较:两组的肺V5、V20、V平均比较差异有统计学意义(t=4.66、29.90、15.63,P < 0.05),见表 2。放射性肺炎的发生率ENI组明显高于IFI组,差异有统计学意义(χ2=4.55、4.77,P < 0.05),尤其是3级反应,分别为19%和4%。两组治疗期间出现的1~2级及3级放射性食管炎及血液学毒性比较差异均无统计学意义(χ2=0.03、0.17、0.23、0.10,P>0.05),两组均未出现4级反应。
随着人均寿命的增加,老年食管癌的比例亦越来越高。因老年患者伴发的基础疾病较多,常不能耐受手术治疗,甚至不能耐受同步放化疗。Hishikawa等[4]报道,高龄(>70岁)食管癌患者的手术死亡率高达23%。因此,放射治疗成为老年食管癌患者的首选治疗方案。三维适形及IMRT能更加准确评估正常组织的放射治疗剂量和放射损伤的概率,能提高靶区在剂量学上的适形性和减少正常组织的放射损伤[5],故越来越多的食管癌患者选择 3D-CRT/IMRT作为其主要的治疗方式。而在根治性放疗的食管癌患者中是否进行食管癌淋巴结预防性放疗是个极其有争议的话题。
在RTOG85-01及RTOG94-05研究中[6, 7],进行区域淋巴结预防照射后治疗相关不良反应较大,尤其在RTOG94-05研究中其致死性不良反应可达10%,这是无法接受的,而进行如此大范围的区域淋巴结预防照射后,其3年生存率仅为27%及33%。目前越来越多的研究支持食管癌行3D-CRT/IMRT放疗,放疗靶区仅包括GTV上下3~5 cm,外扩1~2 cm,不进行淋巴结预防性照射的治疗模式,即行累及野照射(IFI),因其放疗失败的主要原因仍为野内失败及远处转移,照射野外的区域淋巴结转移仅有4%~8%[2, 8, 9]。本研究中因部分老年患者无法耐受手术及化疗,采用单纯根治性放疗。 IFI组出现4例放疗野外局部复发,其中2例系食管非放疗段第二肿瘤,仅2例(7.7%)表现为照射野外区域淋巴结转移,ENI组无发生照射野外区域淋巴结转移,两组复发模式比较差异无统计学意义。结果提示,对于老年性患者采取单纯根治性累及野照射并未增加野外复发及远处转移风险。另外,两组的近期疾病无进展生存及总生存亦无明显差异。本研究IFI组的1、2、3年总生存率与Zhao等[2]的研究结果类似,分别为72.9%、43.4%、31.5%对77%、56%、41%,后者稍偏高,其生存优势可能体现在同步放化疗疗效及研究人群的KPS稍偏高。
放射性肺炎(RP)是胸部放射治疗中主要的剂量限制性不良反应,多项研究证实放射性肺炎的发生风险与照射剂量和暴露体积因素相关[10, 11],美国放射肿瘤学协作组前瞻性研究发现,V20 < 20%无RP发生;V20为22%~31%时,8%患者发生2级RP;V20≥32%时,才发生3级以上的RP[12]。另外本研究的患者平均年龄在75岁以上,放射性肺炎发生风险更高。Giroux等[13]就曾在研究中用Logistic多因素回归分析中发现年龄>75岁及曾用健择化疗是放射性肺炎发生的独立危险因素。因此,减少肺照射剂量在老年患者中尤为重要。本研究IFI组及ENI组的V5、V20、V肺平均及放疗靶体积差异均有统计学意义,两组放射性肺炎的比较差异也有统计学意义。相比于ENI,IFI可明显减少肺照射剂量,减少放射性肺炎的发生,从而减少老年患者肺功能的损伤,提高老年患者的生存质量。
综上所述,对于年龄>70岁的老年食管鳞癌患者,淋巴结累及野放疗与预防性淋巴引流区放疗相比,总生存率及疾病无进展生存率类似,但前者能显著减少肺受照体积,从而减少放射性肺损伤,提高老年患者生存质量。故对于老年食管癌患者而言,累及野根治性放疗是一种可行的放疗设野方法。
| [1] | 蒋杰,王奇峰,肖泽芬,等. 132例食管癌三维适形放疗的疗效分析[J].中华放射肿瘤学杂志,2009,18(1):47-51. |
| [2] | Zhao KL, Ma JB, Liu G, et al. Three-dimensional conformal radiation therapy for esophageal squamous cell carcinoma: is elective nodal irradiation necessary? [J]. Int J Radiat Oncol Biol Phys, 2010, 76(2):446-451. |
| [3] | Cymbalista M, Waysberg A, Zacharias C,et al.CT demonstration of the 1996 AJCC-UICC regional lymph node classification for lung cancer staging[J]. Radiographics,1999,19(4):899-900. |
| [4] | Hishikawa Y, Kurisu K, Tanrguchae M, et al. Radiotherapy for carcinoma of the esophagus in patients aged eighty or older[J].Int J Radiat Oncol Biol Phys, 1991, 20(4):685-688. |
| [5] | 吴隆秋,赵快乐.食管癌的放射治疗进展[J].中国癌症杂志, 2011, 21(7):538-541. |
| [6] | Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer: long-term follow-up of a prospective randomized trial (RTOG 85-01) [J]. JAMA, 1999, 281(17):1623-1627. |
| [7] | Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123 (Radiation Therapy Oncology Group 94-05) phase III trial of combined-modality therapy for esophageal cancer: high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5):1167-1174. |
| [8] | Button MR, Morgan CA, Croydon ES, et al. Study to determine adequate margins in radiotherapy planning for esophageal carcinoma by detailing patterns of recurrence after definitive chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 818-823. |
| [9] | Welsh J, Settle SH,A-mini A, et al. Failure patterns in patients with esophageal cancer treated with definitive chemoradiation[J].Cancer,2012,118(10):2632-2640. |
| [10] | Palma DA, Senan S, Tsujino K, et al. Predicting radiation pneumonitis after chemoradioation therapy for lung cancer: an international individual patient data meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2013, 85 (2):444-450. |
| [11] | Schallenkaml JM, Miller RC, Brinkmann DH, et al. Incidence of radiation pneumonitis after thoracic irradiation: dose-volumn correlates[J]. Int J Radiat Oncol Biol Phys, 2007, 67(2):410-416. |
| [12] | Graham MV, Purdy JA, Emami B, et al. Clinical dose-volume histogram analysis for pneumonitis after 3D treatment for non-small cell lung cancer(NSCLC)[J]. Int J Radiat Oncol Biol Phys, 1999, 45(2):323-329. |
| [13] | Giroux Leprieur E, Fernandez D, Chatellier G, et al. Non-small cell lung cancer: risk factors of radiation pneumonitis[J]. Cancer Radiother, 2012, 16(4):257-262. |
 2015, Vol. 35
2015, Vol. 35