2. 军事医学科学院放射与辐射医学研究所
非清髓骨髓造血干细胞移植(nonmyeloablative stem cell transplantation,NST)是一种新的移植模式,与传统的移植相比,NST具有预处理强度轻、并发症少、安全性高、疗效好等优点[1, 2]。
本实验室前期工作发现,重组人粒细胞集落刺激因子(rhG-CSF)照后大剂量单次给药可提高致死性照射小鼠的存活率,促进受照小鼠的多系造血功能的恢复[3],提示其对照后残留的造血干祖细胞有保护作用,并支持其重建机体造血。多方面的证据表明,rhG-CSF受体多分布在造血祖细胞及成熟的粒细胞上,还没有证据表明rhG-CSF受体在造血干细胞上有表达,rhG-CSF照后大剂量单次给药保护造血干细胞存活的机制还不清楚。为此,本研究建立了非清髓骨髓移植小鼠模型,研究了rhG-CSF照后大剂量单次给药对非清髓骨髓移植小鼠造血重建的作用,为其临床应用及作用机制研究提供实验依据及线索。
1.动物和主要试剂:C57BL/6J和绿色荧光蛋白(GFP) C57BL/6J雄性小鼠,6~8周龄,体重18~22 g,由军事医学科学院实验动物中心提供,许可证号SYXK-(军)C13-C04。rhG-CSF购于杭州九源基因工程有限公司,批号为20120809。RPMI 1640培养液,购于美国GIBCO公司。
2. 观察rhG-CSF照后大剂量单次给药对NST小鼠造血恢复的影响:将C57BL/6J小鼠采用随机数字表法分为5组:未移植组,照后0.5、6、24和48 h移植组。每组10只。全部小鼠经6 Gy全身照射后(剂量率246.39 cGy/min)0.5 h皮下注射rhG-CSF 1 mg/kg,其中移植组于相应时间接受骨髓移植。分别于照射前(设为100%),照射后第5、9、12、16、22、30天尾静脉取血20 μl,使用MEK-7222K(日本光电公司)血细胞分析仪检测外周血象,包括白细胞、红细胞和血小板。
3. 观察不同剂量rhG-CSF照后单次给药对NST小鼠造血恢复的影响:将C57BL/6J小鼠采用随机数字表法分为4组,单纯移植组,rhG-CSF 0.25、0.5和1.0 mg/kg组。每组10只。全部小鼠经6 Gy全身照射后24 h接受骨髓移植。其中给药组于照后0.5 h皮下注射相应剂量的rhG-CSF,移植对照组给予生理盐水。进行外周血象检测。
4. 骨髓移植:供体C57BL/6J 或GFP C57BL/6J小鼠脱颈处死后,取双侧股骨,用RPMI 1640培养液冲出骨髓腔内的骨髓,制备有核细胞悬液,浓度1.5×107/ml,经尾静脉注入受体小鼠体内,注入细胞数为3 ×106/ 0.2 ml。
5. rhG-CSF照后大剂量单次给药对NST小鼠骨髓植入率的影响:将C57BL/6J小鼠采用随机数字表法分为两组:单纯移植组和移植+ rhG-CSF组。两组经6 Gy全身照射(剂量率230.25 cGy/min)后24 h接受骨髓移植(供体为GFP C57BL/6J),其中移植+rhG-CSF于照后0.5 h皮下注射rhG-CSF 1 mg/kg,移植对照组给予相应生理盐水。分别于照射前,照射后第5、9、12、16、22、30天尾静脉取血20 μl,用FACSCalibur流式细胞仪(美国BD公司)检测外周血白细胞中GFP阳性细胞在有核细胞中的比例。
6. 统计学处理:实验数据使用SPSS 18.0软件处理,以均数±标准差表示,数据比较采one-way ANOVA一元方差分析,组间比较采用LSD法。P<0.05为差异有统计学意义。
1.rhG-CSF照后大剂量单次给药对不同时间接受NST小鼠造血恢复的影响:在照射后不同时间段,rhG-CSF照后大剂量单次给药对照后不同时间接受NST小鼠外周血白细胞、红细胞和血小板等指标均有促进作用,与未移植组比较,差异具有统计学意义(F=17.76、14.75、8.66, P<0.05,图 1),尤其对照后24 h接受骨髓移植组效果最佳。
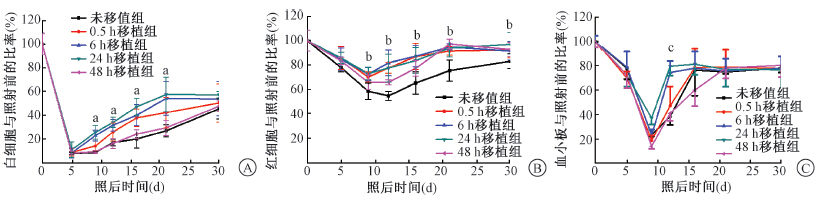 | 注:A.白细胞;B.红细胞;C.血小板;各移植组与未移植组相比,aF=17.76、bF=14.75、cF=8.66, P<0.05图 1 rhG-CSF照后大剂量单次给药对不同时间NST小鼠外周血象的影响 |
2. 不同剂量rhG-CSF照后单次给药对NST小鼠造血恢复的影响:在照后不同时间段,不同剂量rhG-CSF照后单次给药对NST小鼠外周血白细胞、红细胞和血小板等指标均有促进作用,与单纯移植组比较,差异具有统计学意义(F=5.34、8.97、16.54, P<0.05,图 2),以rhG-CSF 1.0 mg/kg组效果最好。
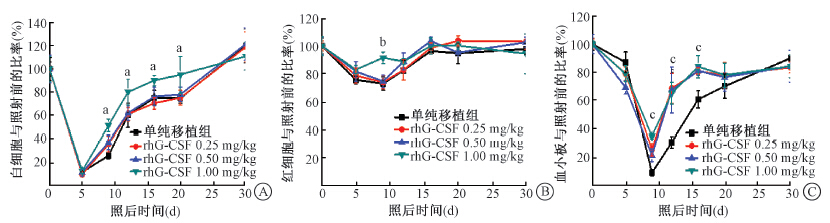 | 注:A.白细胞;B.红细胞;C.血小板;各rhG-CSF组与单纯移植组相比,aF=5.34、bF=8.97、cF=16.54, P<0.05图 2 不同剂量rhG-CSF照后单次给药对NST小鼠外周血象恢复的影响 |
3. rhG-CSF照后大剂量单次给药对NST小鼠骨髓植入率的影响:照射小鼠接受GFP小鼠骨髓细胞移植后,随着照后时间的延长,rhG-CSF组和单纯移植组小鼠外周血白细胞中GFP+细胞比例均逐渐增加,在照后第30天,两组GFP+细胞比例升至70%左右。但在照后多个时间点,GFP+细胞比例在两组之间均无明显差异。同批两组小鼠外周血象显示rhG-CSF组小鼠外周血白细胞数于照后第9~21天均明显高于单纯移植组(F=35.61, P<0.05,图 3)。表明rhG-CSF照后大剂量单次给药可显著促进NST小鼠多系造血功能恢复,但对输入的外源造血干细胞植入没有明显影响。
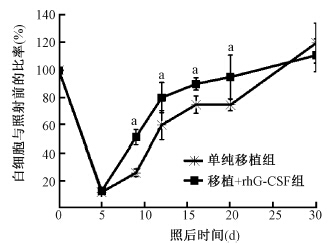 | 注:arhG-CSF组与单纯移植组相比,F=35.61, P<0.05图 3 rhG-CSF大剂量单次给药对接受GFP骨髓移植小鼠外周血白细胞数的影响 |
NST是应用比经典预处理强度低的放、化疗剂量来抑制受者的免疫应答,使异基因造血干细胞在受者体内得以植入,移植后再用免疫抑制剂,以达到宿主和移植体之间的双向免疫耐受,形成嵌合体,并诱导移植体抗肿瘤效应,清除宿主体内的肿瘤细胞或遗传学异常的造血干细胞,最终治愈血液恶性肿瘤的一种新型的移植方法。
射线作为骨髓移植预处理的手段之一,不仅杀伤骨髓造血干、祖细胞,而且也损伤骨髓造血微环境。研究发现,机体受照后造血基质细胞分泌的造血刺激活性物质在照后早期降低,极期升高,而造血抑制活性物质照后早期升高并持续一段时间,指出二者的失衡可能是加重造血细胞辐射损伤的一个关键环节[4]。本研究提出照后早期(24 h以内)给予大剂量造血因子干预,逆转二者的失衡,可减轻放射引起的造血损伤,促进造血恢复。随后在多种照射动物模型上证实这一设想是可行的。
造血因子治疗急性放射病的推荐用法是照后1~ 3 d开始给药,每天1次,直至造血基本恢复。研究发现rhG-CSF(1.0 mg/kg)照后30 min 1次皮下给药,可使9.75 Gy照射小鼠30 d存活率提高到90%~100%[5];而rhG-CSF常规方案治疗(0.25 mg/kg,7~14 d,照后当天开始给药),仅使8.0 Gy照射小鼠30 d存活率提高到35%。随后在2.3 Gy中子照射比格犬模型上(重度偏重骨髓型急性放射病),比较了rhG-CSF照后早期大剂量给药(0.2 mg/kg,照后30 min和24 h各皮下给药1次)与常规治疗(0.01 mg/kg×20 d,照后当天开始皮下给药)对45 d活存动物骨髓象恢复的影响,发现常规治疗的5只动物有3只存在不同程度的骨髓造血抑制,而大剂量治疗的4只动物,骨髓象均已恢复到正常水平[6, 7]。近期文献报道,照后早期单次或间隔给予大剂量PEG化修饰rhG-CSF(0.3 mg/kg)可明显促进6 Gy全身照射猕猴中性粒细胞恢复,其疗效优于常规的rhG-CSF(0.01 mg·kg-1·d-1)[8]。
本研究探索了照后移植时间对rhG-CSF疗效的影响,显示rhG-CSF照后早期大剂量单次给药对0.5~48 h内接受非清髓骨髓移植小鼠的造血恢复均有不同程度的促进作用,其中对24 h移植组小鼠的白细胞、红细胞和血小板的恢复最佳。随后观察了不同剂量rhG-CSF照后早期单次给药对非清髓骨髓移植小鼠造血恢复的影响,发现0.25~1.0 mg/kg rhG-CSF照后早期单次给药可不同程度地促进非清髓骨髓移植小鼠的多系造血的恢复,尤以大剂量rhG-CSF(1.0 mg/kg)给药时效果更为明显。同时建立GFP荧光小鼠非清髓骨髓移植小鼠模型,观察了rhG-CSF早期干预对外源性造血干细胞植入的影响,发现rhG-CSF照后早期大剂量单次给药对输入的外源造血干细胞的植入没有明显影响,表明rhG-CSF对内源照后残存的干、祖细胞以及外源输入的造血干、祖细胞的功能重建均有促进作用。
关于rhG-CSF照后早期大剂量单次给药促进非清髓骨髓移植小鼠造血功能重建的报道较少。有报道显示,SHIP1为含SH2结构域的肌醇5-磷酸酶,在骨髓造血细胞及微环境细胞中均有表达;SHIP1酶解PI(3,4,5)P3生成PI(3,4)P2,通过PI3K/AKT/NF-κB信号转导通路调节体内rhG-CSF生成[9]。给予SHIP1抑制剂或诱导敲除SHIP1后,小鼠血浆G-CSF含量增加,骨髓造血干细胞和间充质干细胞(MSC)数量均显著增多;而应用G-CSF中和抗体可逆转SHIP1抑制剂对小鼠的造血调控作用[10]。SHIP1 通过调节PI3K/Akt/β-catenin信号转导通路,促进MSC向成骨细胞分化,而敲低小鼠SHIP1可抑制MSC分化,增加骨髓MSC数量[11]。rhG-CSF在体内代谢较快,消除半衰期为3~5 h;本研究rhG-CSF照后0.5 h给药,当于照后24 h接受骨髓移植时,小鼠体内rhG-CSF消失殆尽,而此时rhG-CSF促进移植后造血功能恢复效果最佳。结合文献资料,本研究分析rhG-CSF照后0.5 h给药,可能通过促进骨髓MSC增殖或抑制其凋亡,改善了照后骨髓微环境,对移植的外源性造血干细胞及体内残存的健康的内源性造血干细胞的功能重建均有促进作用,其确切机制有待于进一步深入研究。
| [1] | Slavin S,Nzgler A,Naparstek E, et al. Nonmyeloablative stell cell transplantation and cell therapy as an alternative to conventional bone marrow transplantion with lethal cytoreduction for the treatment of malignant and nonmalignant hematologic diseases[J]. Blood,1998,91(3):756-763. |
| [2] | 艾辉胜. 非清髓异基因造血干细胞移植——造血干细胞移植的新方向[J]. 解放军医学杂志,2001,26(1):1-4. |
| [3] | 赵燕芳,韩阿如娜,邢爽,等. 大剂量重组人粒细胞集落刺激因子对8.0 Gy 60Co γ射线照射小鼠长期存活率及远后效应的影响[J]. 国际药学研究杂志,2010,37(3):217-221. |
| [4] | 从玉文,陈家佩,邵源.辐射后造血细胞对造血因子增殖反应性变化的研究[J]. 军事医学科学院院刊,1999,23(2):119-122. |
| [5] | 韩阿如娜,余祖胤,柳晓兰,等. 大剂量rhG-CSF早期单次给药对60Co γ射线照射小鼠的治疗作用[J]. 解放军医学杂志,2011,13(7):761-764. |
| [6] | Li M,Yu ZY,Xing S, et al. High dose granulocyte colony-stimulating factor enhances survival and hematopoietic reconstruction in canines irradiated by 2.3 Gy mixed fission neutron and gamma ray[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2011,19(4):991-998. |
| [7] | Yu ZY,Li M,Han AR, et al. rhG-CSF improves radiation-induced myelosuppression and survival in the canine exposed to fission-neutron irradiation[J]. J Radiat Res,2011,52(4):472-480. |
| [8] | Farese AM,Cohen MV,Stead RB,et al. Pegfilgrastim administered in an abbreviated schedule, significantly improved neutrophil recovery after high-dose radiation-induced myelosuppression in rhesus macaques[J]. Radiat Res,2012,178(5):403-413. |
| [9] | Hazen AL, Smith MJ, Desponts C, et al. SHIP is required for a functional hematopoietic stem cell niche[J]. Blood, 2009, 113(13):2924-2933. |
| [10] | Brooks R, Iyer S, Akada H, et al. Coordinate expansion of murine hematopoietic and mesenchymal stem cell compartments by SHIPi[J]. Stem Cells, 2015, 33(3):848-858. |
| [11] | Iyer S, Viernes DR, Chisholm JD, et al. SHIP1 regulates MSC numbers and their osteolineage commitment by limiting induction of the PI3K/Akt/β-catenin/Id2 axis[J]. Stem Cells Dev, 2014, 23(19):2336-2351. |
 2015, Vol. 35
2015, Vol. 35


