通过实验构建并证实了环氧合酶-2(Cox-2)基因的siRNA载体pRNA-U6.1- siCox214可成功转染出沉默的的食管癌EC9706细胞,重组Cox-2基因载体pcDNATM4-Cox-2可成功转染出上调的Cox-2基因,同时利用脂质体转移技术证明了siRNA沉默Cox-2基因表达可明显增强食管癌EC9706细胞的放射敏感性[1],本研究则通过几个方面对其影响放射敏感性的机制进行探讨。
1.细胞系及主要试剂:人食管癌细胞系(EC9706)郑州大学基础医学院病理生理教研室提供。siRNA表达载体pRNA-U6.1、siRNA无关序列对照质粒(pRNAT-U6.1-Con)购自美国GenScript公司;Cox-2单克隆抗体、AKT抗体、pAKT抗体:磷酸化位点anti-phospho-AKT (Ser473)购自美国Santa Cruz公司。
2.实验分组:共分5组,上调组、下调组、siRNA对照组、载体对照组和空白对照组。上调组将转染pcDNATM4-Cox-2的EC9706细胞,经荧光定量RT-PCR和Western blot鉴定高效表达Cox-2基因。 下调组为稳定转染pRNA-U6.1-siCox214的EC9706细胞,经荧光定量RT-PCR和Western blot鉴定高效沉默细胞Cox-2基因表达。siRNA对照组即稳定转染pRNAT-U6.1-Con的EC9706细胞。载体对照组即稳定转染pcDNATM4/HisMax C的EC9706细胞。空白对照组即未转染的EC9706细胞。
3.细胞照射:培养下调组、siRNA对照组、上调组、载体对照组和空白对照组细胞至对数生长期,用德国西门子直线加速器6 MV X射线(剂量率为200 cGy/min)照射上述5组细胞后进行后续实验。按实验要求给予0、1、2、4、6、8、10 Gy剂量,室温下照射剂量1次给予。
4.RT-PCR方法分别检测细胞中Cox-2、基质金属蛋白-2(MMP-2)、Bcl-2、Bax等mRNA的表达水平:使用德国Qiagen公司的小量总RNA提取试剂盒提取各组细胞的mRNA,使用其公司的反转录试剂盒进行反转录,采用TaqMan探针检测法,分别使用各自的引物和探针[1],分别检测其表达水平。按照日本TaKaRa公司Premix Ex TaqTM (Perfect Real Time) TaqMan试剂盒及ABI7500 fast扩增仪使用说明进行操作。以Cox-2、MMP-2、Bcl-2、Bax的表达量及内参照β-肌动蛋白表达量的比值为其相对表达水平。
5.Western blot方法检测细胞中AKT蛋白和磷酸化AKT蛋白表达量:使用北京Applygen公司的蛋白提取试剂盒提取蛋白样品(按照说明书进行),配制12%SDS-PAGE凝胶进行样品处理、上样与电泳处理,采用槽式湿转膜方式获取杂交膜,用25 ml TBS洗膜5 min,置膜于25 ml封闭缓冲液中1 h,室温,摇动。15 ml TBS/T洗3次,加入1∶400 β-肌动蛋白单克隆抗体,室温孵育1 h。15 ml TBS/T洗3次,加入1∶2 000的辣根过氧化酶(HRP)标记的辣根过氧化物酶标记的山羊抗鼠IgG抗体二抗,室温孵育1 h,缓慢摇动。15 ml TBS/T洗3次,15 ml TBS洗1次。显色检测蛋白(按相应试剂说明操作)。成像扫描分析系统保存图像。
6.流式细胞仪检测细胞凋亡率及细胞周期测定:分别取0、2和4 Gy照射处理的下调组、siRNA对照组、上调组、载体对照组和空白对照组细胞,细胞计数1×106/ml。用100 μl的标记溶液,(FITC-Annexin V和PI加入到孵育缓冲液中,终浓度均为1 μg/ml)重悬细胞,室温下,避光孵育15 min;离心半径 10 cm,1 500 r/min 离心5 min,收集沉淀细胞。用孵育缓冲液洗1次后加入荧光溶液,4℃孵育20 min。流式细胞仪检测,各组细胞均设5个平行样品。
7.集落形成实验检测细胞集落形成率及相对存活率:采用细胞软琼脂集落形成实验(取0.8 ml细胞悬液和琼脂的混合物,含细胞数200个铺于底层琼脂上,每个样品做5个复孔。凝固后放入37℃、5%CO2培养箱中孵育2 h待用)。照射后37℃、5%CO2饱和湿度的环境下,静置培养2周。使用倒置显微镜下用划线方法观察计数存活集落。存活集落是指单个细胞培养形成的集落,其细胞数≥50个,为1个存活集落。
8.CCK-8试剂检测细胞增殖能力:分别取不同剂量照射处理的各组细胞计数后,分别调整各组培养细胞密度至1×105 /ml,将1×104(100 μl/孔)个细胞各组接种于96孔细胞培养板内,各组细胞均设置5个复孔,采用CCK-8细胞增殖检测试剂盒,分别测定各组细胞孔内的吸光度(A)值,计算出平均值,绘制各组细胞的生长曲线。细胞增殖抑制率=[1-(DB-D空白)/(DA-D空白)]×100%。
9.Transwell小室检测细胞体外侵袭能力:取各组细胞调整密度至5×105 /ml,200 μl加入Transwell小室,常规5% CO2培养48 h。使用结晶紫染色,然后用正置显微镜进行观察和拍照,采用3~5个视野,计数取平均值。 10.统计学处理:数据用x±s表示。使用SPSS 13.0软件进行分析。结果采用单因素方差分析。P<0.05为差异有统计学意义。
1.RT-PCR检测结果:空白对照组、siRNA对照组、载体对照组细胞的Cox-2 mRNA相对表达量差异无统计学意义。下调组与空白对照组相比均显著降低,差异有统计学意义(F=46.18,P<0.05)。由表 1可知,2和4 Gy照射后各组细胞Cox-2 mRNA表达量均呈现下调组Cox-2 mRNA表达下调(F=58.88、57.96,P<0.05),上调组Cox-2 mRNA表达上调(F=32.09、21.81,P<0.05)。在2和4 Gy照射后,上调组Bcl-2 mRNA表达量较空白对照组均有升高,差异有统计学意义(F=3.36,4.32,P<0.05);下调组MMP-2 和Bcl-2 mRNA表达量较空白对照组均有降低(F=3.86、8.09、3.73、5.64,P<0.05),Bax mRNA表达量较空白对照组均有升高(F=7.03、7.42,P<0.05)。而只有下调组细胞在2和4 Gy照射后,其MMP-2 mRNA和Bcl-2 mRNA表达水平逐渐降低,且组内降低的差异有统计学意义(F=25.99、13.13,P<0.05)。其Bax mRNA表达水平逐渐升高,且组内升高的差异有统计学意义(F=7.26,P<0.05)。
| 表 1 两种细胞在24和48 h的细胞凋亡率x±s |
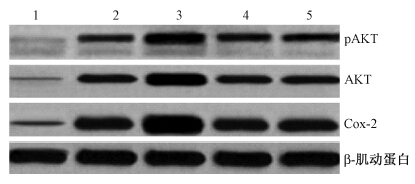 | 图 1 Western blot结果 1. 下调组;2.siRNA对照组;3.上调组;4.载体对照组; 5.空白对照组 |
2.Western blot检测:由图 1可知,各组细胞Cox-2蛋白印迹一致,空白对照组、siRNA对照组、载体对照组有较强的印迹,而下调组印迹最浅。总AKT蛋白和磷酸化AKT蛋白(pAKT)印迹一致,空白对照组、siRNA对照组、载体对照组有较强的印迹,而下调组印迹最浅。
3. 细胞凋亡检测:在2和4 Gy照射后下调组细胞凋亡率与空白对照组相比(13.46±0.61 vs. 7.22±0.67,19.16±0.72 vs. 10.75±1.24)显著升高,差异有统计学意义(F=15.39、13.09,P<0.05);而空白对照组、siRNA对照组、载体对照组、下调组和上调组中同组细胞在照射后其细胞凋亡率均有随照射剂量增加而上升的趋势,其中下调组细胞随照射量的增加凋亡率上升陡度最大,且差异有统计学意义(F=317.40,P<0.05)。
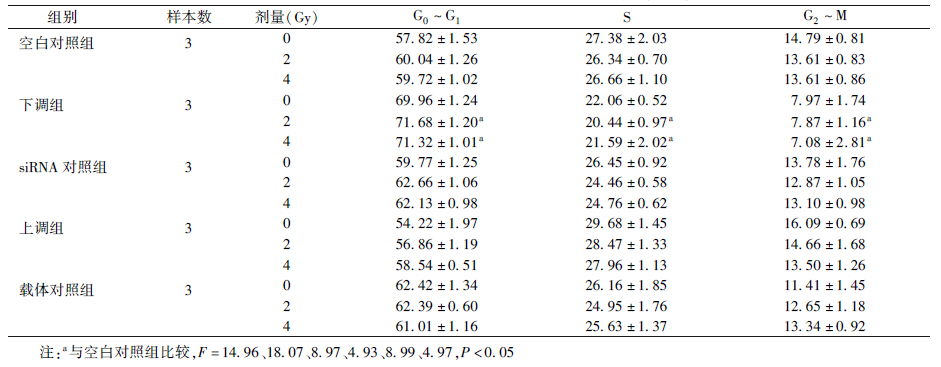
4. 细胞周期测定:由表 2可知,在2和4 Gy照射后下调组G0~G1期细胞比例比对照组升高(F=14.96、18.07,P<0.05),而S期(F=8.97、4.93,P<0.05)和G2~M期细胞比例与对照组比较均降低,差异有统计学意义(F=8.99、4.97,P<0.05)。空白对照组、siRNA对照组、载体对照组和上调组中同组细胞在照射后其G0~G1、S和G2~M期细胞比例没有明显变化;而下调组细胞则随着照射强度的增加,其G0~G1期细胞比例逐渐升高,S和G2~M细胞比例逐渐降低。
| 表 2 不同剂量照射各组不同细胞周期的分布比率(%,x±s) |
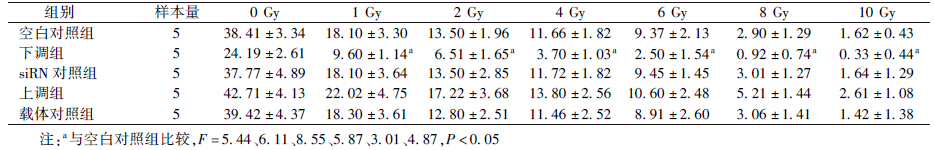
5. 集落形成实验:由表 3可知,下调组细胞在1、2、4、6、8和10 Gy照射后集落形成率与空白对照组比较,均降低,差异有统计学意义(F=5.44、6.11、8.55、5.87、3.01、4.87,P<0.05)。不同剂量照射各组细胞相对存活率的比较见图 2。采用多靶单击模型拟合后的放射增敏比为1.18(致死剂量D0之比)或1.23(准阈剂量Dq之比)。
| 表 3 不同剂量照射各组细胞集落形成率(%,x±s) |
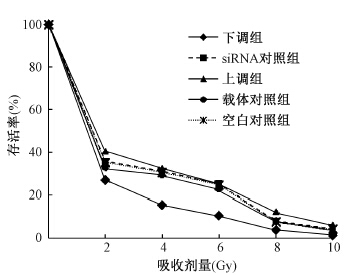 | 图 2 不同剂量照射各组细胞相对存活率 |
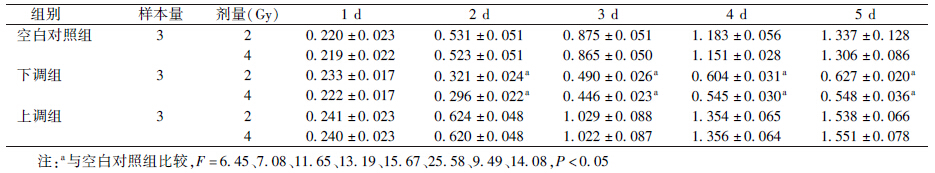
6.细胞增殖检测:由表 4可知,在2 Gy照射后下调组细胞在2、3、4、5 d吸光度(A)值比空白对照组降低(F=6.45、11.65、15.67、9.49,P<0.05);4 Gy照射后也明显降低,差异有统计学意义(F=7.08、13.19、25.58、14.08,P<0.05)。2和4 Gy照射后各组细胞在3、4、5 d时上调组细胞的增殖抑制率均为负值,说明上调Cox-2基因表达对辐射具有抗拒作用。
| 表 4 CCK-8试剂检测各组细胞照射后不同时间的吸光度(A)值(x±s) |
7. 体外侵袭实验:在2和4 Gy照射后下调组细胞体外侵袭实验穿透细胞数较空白对照组(36.21±8.61 vs. 100.22±8.64;30.23±7.12 vs. 99.64±10.23)降低,差异有统计学意义(F=11.73、12.45,P<0.05)。其中,下调组细胞随照射量的增加,其体外侵袭实验穿透细胞数下降陡度最大。提示沉默Cox-2表达的食管癌EC9706细胞侵袭能力随照射剂量的增加而显著减弱,而Cox-2较高水平表达的食管癌细胞,射线照射剂量对细胞侵袭能力的影响不显著。
Cox是前列腺素合成过程中一个主要限速酶参与多种疾病的病理生理过程。研究表明,Cox-2在多种肿瘤组织中高表达,并参与肿瘤的发生、发展,促进了恶性肿瘤的侵袭转移[2, 3]。Cox-2的表达与淋巴结转移及TNM分期呈正相关,目前在头颈部肿瘤中的研究报道较多,但在食管鳞癌方面较少。
本研究利用克隆形成实验研究下调Cox-2 基因表达对人食管癌细胞EC9706的体外放射增敏作用,结果发现,Cox-2下调组联合X射线照射组平均D0、Dq均低于单纯照射组,说明其放射敏感性较单纯照射组高,根据两组D0、Dq求得的放射增敏比(SER)为1.18、1.23,说明下调Cox-2基因表达对EC9706细胞确实具有一定的放射增敏作用。本研究结果证实,食管癌EC9706细胞中MMP-2 mRNA和BCL-2 mRNA的表达量与Cox-2 mRNA的表达量呈正相关,同时,Bax mRNA的表达量随Cox-2 mRNA的表达量呈负相关。其中,下调Cox-2 mRNA的表达降低细胞增殖侵袭的能力,增加G0~G1期细胞的比例,从而影响细胞的放射敏感性。
MMP-2是降解细胞外基质(EMC)成分的主要酶之一,在血管新生、肿瘤生长和转移过程中发挥重要作用。有研究表明[4, 5],肿瘤细胞中MMP-2高表达会加速细胞外基质和血管基底膜的降解,使肿瘤细胞容易从癌巢的进出血管中迁移出来,影响其黏附性和能动性,促进其侵袭、转移。Bcl-2家族是线粒体凋亡途径中被认为很重要的凋亡调节蛋白,其高表达能够阻止多种诱导凋亡的因素(如射线、化学药物等)诱发细胞凋亡[6]。Bax具有促进细胞凋亡的作用,其表达并不阻断凋亡,而是具有对抗Bcl-2蛋白从而抑制凋亡[7, 8, 9],因此,Bcl-2蛋白表达降低或者Bax表达升高,都可以促进细胞凋亡,增加肿瘤细胞的放射敏感性。
食管癌主要生物学特征是局部浸润和转移,最近的研究认为,在肿瘤浸润转移的发展过程中,细胞外生长信号通过磷脂酞肌醇-3激酶(pI3K)的作用产生PIP3,后者激活AKT启动一系列与细胞周期调控、细胞凋亡、端粒酶活性、血管生成、细胞迁移相关的程序[10]。而电离辐射、紫外线和细胞毒性药物均可能激活PI3K/Akt信号转导途径,导致肿瘤细胞进行应激调节,维持细胞生命活动的稳定,导致辐射抗拒现象。本研究结果提示,食管癌EC9706细胞中存在较高水平的AKT蛋白表达和较高程度的磷酸化水平,且细胞Cox-2的表达水平与AKT和磷酸化AKT(pAKT)呈正相关。
综上所述,本研究通过双向调控人食管癌Cox-2特异性siRNA转染的EC9706细胞,发现下调细胞内Cox-2 mRNA表达可以提高放射敏感性,其机制可能是,下调细胞内Cox-2 mRNA表达继而下调MMP-2、Bcl-2 mRNA表达,上调Bax表达,导致肿瘤细胞的侵袭及转移能力的降低,促进其向G0~G1期细胞转换,诱导细胞凋亡。同时使AKT和磷酸化AKT(pAKT)水平下降,影响PI3K/Akt信号转导途径降低其放疗抗拒的能力。
| [1] | 吴慧,卢晓旭,刘冬梅,等. 小干扰RNA沉默Cox-2表达增强食管癌EC9706细胞的放射敏感性[J]. 中华医学杂志, 2012, 92(23):1621-1625. |
| [2] | Peng JP, Chang HC, Hwang CF, et al. Over expression of cyclooxygenase-2 in nasopharyngeal carcinoma and association with lymph node metastasis[J]. Oral Oncol, 2006, 42(6):653. |
| [3] | Daisuke S, Daniel V, Hidekazu K, et al. Increasing cyclooxygenase-2 (cox-2) gene expression in progression of Barrett's esophagus to adenocarcinoma correlates with that of Bcl-2[J]. Int J Cancer, 2006, 119(4) :765-770. |
| [4] | John A, Tuszynski G. The role of matrix metalloproteinases in tumor angiogenesis and tumor metastasis[J]. Pathol Oncol Res, 2001, 7(1):14-23. |
| [5] | Yu XF, Han ZC. Matrix metalloproteinases in bone mmarrow: roles of gelatinases in physiological hematopoiesis and hematopoietic malignancies[J]. Histopathology, 2006, 21(5): 519-531. |
| [6] | O'Neill J, Manion M, Schwartz P, et al. Promises and challenges of targeting Bcl-2 anti-apoptotic proteins for cancer therapy[J]. Biochim Biophys Acta, 2004, 1705(1):43-51. |
| [7] | Leung RK, Whittaker PA. RNA interference: from gene silencing to gene-specific therapeutics[J]. Pharmacol Ther, 2005, 107(2):222-239. |
| [8] | Kirkin V, Joos S, Zornig M. The role of Bcl-2 falIlily members in tumor genesis[J]. Biochim Biophys Acta, 2004, 1644(2-3):229-249. |
| [9] | McCabe ML, Dlamini Z. The molecular mechanisms of oesophageal cancer[J]. Int Immunopharmacol, 2005, 5(7-8):1113-1130. |
| [10] | Zhong H, Chiles K, Feldser D, et al. Modulation of hypoxia inducble factor 1 alpha expression by the epidermal growth factor/phosphatidy linositol3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells implications for tumor angiogenesis and therapeutics[J]. Cancer Res, 2000, 60(6):1541-1544. |
 2015, Vol. 35
2015, Vol. 35