2. 南京医科大学附属常州市第二人民医院病理科 213003;
3. 南京医科大学附属南京第一医院肿瘤外科
脂肪来源干细胞(adipose-derived stem cells,ASCs)具有多向分化潜能,在一定条件下,可向脂肪细胞、软骨细胞、肌肉细胞和成骨细胞分化[1]。ASCs治疗放射性皮肤损伤的实验及临床研究已取得一定的疗效[2, 3, 4, 5]。对于用ASCs治疗放射性肌损伤方面报道较少[6]。本研究利用同种异体ASCs进行兔骨骼肌放射损伤模型的移植治疗,分析骨骼肌放射损伤的病理学改变,探讨ASCs移植对骨骼肌放射损伤修复影响。
1.实验动物:选用南京市青龙山实验动物公司提供的健康新西兰白兔 [许可证号SCXK(苏)2007-0008,合格证号0004282],64只雌雄各半。实验动物置于恒温、恒湿的动物房内分笼饲养,每日光照12 h。实验中对动物的处置符合动物伦理学标准。荧光标记抗体CD 90-FITC/IgG-FITC购自美国Abcam公司;荧光标记抗体IgG-RBITC/CD 34-RBITC/ CD 31-FITC及Rabbit Anti-TGFβ1购自北京博奥森公司;CM-Dil活细胞染色剂购自美国Invitrogen公司。
2.ASCs的分离和培养:取26周龄新西兰兔,体重(3 000±500)g,经戊巴比妥钠麻醉后固定,切取腹股沟及颈背部皮下脂肪,用含有100 U/ml青霉素及链霉素的PBS液冲洗后充分剪碎,加入等体积0.1%的Ⅰ型胶原酶,37℃恒温条件下消化90 min,过滤,以离心半径10 cm、1 500 r/min离心10 min,取上清,用含有10% FBS的DMEM培养基(美国GIBCO公司)重悬细胞并计数,以2×105/ml的密度将细胞接种于培养瓶。24 h后首次换液,以后每2~3天换液1次。待贴壁细胞生长达80%~90%融合时用0.25%胰蛋白酶消化后以1∶3传代。
3.ASCs的鉴定、标记和扩增:取第3代处于对数生长期的细胞,消化后制备细胞密度为1×106/ml的细胞悬液,利用与兔组织存在交叉反应的抗体进行CD31、CD34、CD90检测,所有单抗均设IgG同型对照。取第2代细胞,经消化、离心后利用磷酸盐缓冲液(PBS)重悬细胞,按照CM-Dil染色试剂说明书进行染色。标记后的ASCs置于避光环境下继续培养。
4.动物实验设计:64只8周龄新西兰兔,雌雄不限,体重(1 500±250)g,采用随机数字表法分为ASCs组和PBS组,每组32只。参照文献[7]建立骨骼肌放射性损伤的模型,两组动物均经腹腔注射戊巴比妥钠麻醉后俯卧位固定,采用德国SIEMEMS直线加速器9 MeV电子线对单侧臀部进行1次性80 Gy照射,源皮距100 cm,剂量率300 cGy/min,最大剂量深度约为2 cm,照射面积为5 cm×5 cm,未照射一侧作为各组的正常对照。照射后24 h,ASCs组照射部位局部肌肉注射含CM-Dil标记的5×107/ml ASCs的PBS悬液1 ml,PBS组照射部位局部肌肉注射1 ml PBS。各组局部照射后1、4、8和26周,各处死8只实验动物,取照射野治疗区域皮下约2 cm处肌肉组织3块,冰冻切片、荧光显微镜下观察组织中CM-Dil标记的ASCs分布情况; 10% 中性甲醛固定,常规包埋、切片,行苏木精-伊红 (HE) 染色,观察骨骼肌细胞损伤情况以及用2.5%的戊二醛4周和26周肌肉组织,用以制备透射电镜超薄切片。
5.肌组织放射损伤分级:ASCs组、PBS组及正常对照组的臀肌组织切片HE染色对照,参照Gallet 等[8]进行肌细胞损伤病理损伤分级作适当补充,设立肌细胞损伤参数,按如下标准分为0~3级,0级:正常肌细胞;1级:肌细胞核萎缩,肌细胞肿胀变性;2级:肌细胞核萎缩,<20%的肌细胞坏死;3级:肌细胞核萎缩,≥20%的肌细胞坏死。由两位研究者进行盲法形态学分析。
6.再生肌细胞计数:由于再生的肌细胞分布不均匀,在纤维化及坏死区分布较少,本实验先在低倍镜(×40和×100)下确定富含增生肌细胞的区域,随后计数5个高倍镜 (×400)视野的再生肌细胞数,以比较26周PBS组和ASCs组来自肌卫星细胞代偿增生的肌细胞,将肌细胞内含有体积增大、HE染色呈淡蓝色,位于中央的细胞核的计数为一个增生的肌细胞。由两位研究者进行盲法形态学分析。
7.透射电镜超微结构观察:利用日本JEM-1010透射电镜观察超微结构变化。
8.统计学处理:采用SPSS 16.0软件包进行统计分析,计量资料用均数±标准差表示,行两样本均数t检验。肌损伤分级用非参数分析Mann-Whitney 检验。P﹤0.05 为差异有统计学意义。
1.实验动物的大体观察:两组动物进食及饮水量无明显区别,整个实验周期中均未出现腹泻等放射性肠炎、烦躁不安等神经系统症状,两组实验动物均无死亡。照射2周后,两组动物照射部位开始出现皮肤脱毛,不同程度的干性及湿性脱皮;照射14周后,PBS组及ASCs组受照射的部位开始出现不同程度的放射性皮肤、肌肉损伤表现,如皮肤苍白,肌肉僵硬、萎缩及肢体活动受限等。
2.ASCs的CM-Dil体外标记及体内示踪:第3代ASCs光镜下观察细胞形态似成纤维样细胞样,胞质丰富,胞核饱满居中。荧光显微镜激发波长为553 nm条件下观察经CM-Dil染色的ASCs贴壁培养后,细胞形态与染色前一致,细胞膜及胞质呈均匀的红色荧光,胞核未染色。ASCs组CM-Dil标记的ASCs荧光显微镜下呈斑点及小斑片状红色荧光,1周时沿注射针道分布,4周时向周围损伤肌组织迁移,8周时荧光强度明显衰减,26周未见明显荧光显示。
3.ASCs细胞表面抗原鉴定:流式细胞仪检测ASCs低表达造血干细胞特异性抗原 CD34(0.2%)和内皮细胞特异性抗原 CD31(0.3%),高表达其特异性抗原CD90(阳性率93.1%,图 1)。
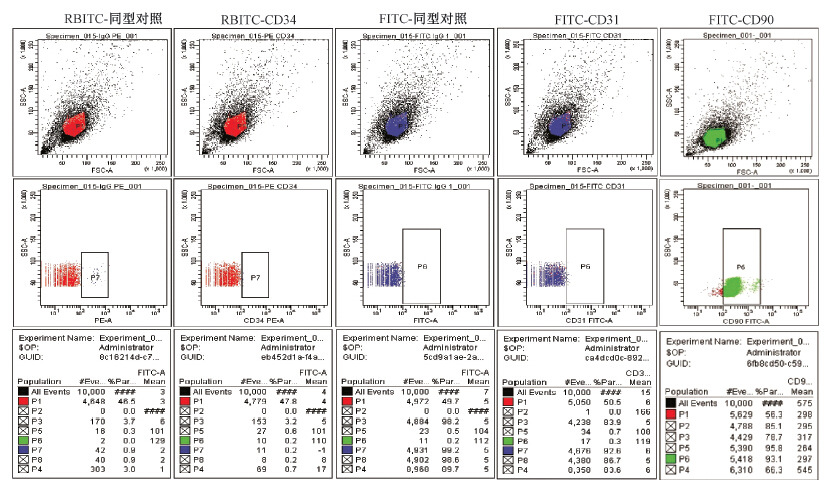 | 图 1 ASCs细胞表面抗原鉴定 CD 34呈低表达(P7 0.2%);CD 31呈低表达(P6 0.3%);CD 90呈高表达(P6 93.1%) |
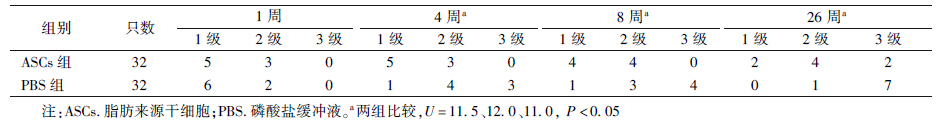
4.光镜检查:9 MeV电子线单次照射80 Gy后ASCs组及PBS组肌细胞损伤参数评分较正常对照组增高。PBS组肌细胞损伤参数评分在4、8和26周高于ASCs治疗组(U=11.5、12.0、11.0,P﹤0.05,表 1)。
| 表 1 两组照射后不同时间肌细胞损伤情况(只) |
ASCs组 26周可见较多肌卫星细胞代偿增生区,分布不均,纤维化明显区肌卫星细胞代偿增生稀少,ASCs组再生肌细胞数(27.01±9.36)显著高于PBS组(5.23±4.23)(t=15.12,P<0.05),表明ASCs具有修复放射性肌损伤功能(图 2)。
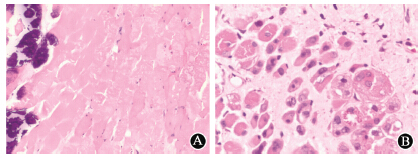 | 图 2 照射后26周ASCs对放射损伤骨骼肌肌卫星细胞增生的影响HE染色 ×400 A.PBS组肌细胞部分肿胀变性,部分萎缩,可见坏死、钙化、细胞核萎缩、碎裂、消失,肌卫星细胞增生不明显 HE染色 ×100; B. ASCs组聚集的肌卫星细胞代偿增生区,增生的肌细胞中央可见体积增大、HE染色呈淡蓝色细胞核 |
5. 肌组织电镜检查:照射80 Gy后4周,ASCs组及PBS组均见肌节肿胀,粗细不均,明暗带结构不清晰。肌原纤维出现多灶性坏死,形成电子密度深浅不一的无定形结构区。部分细胞核缩小,染色质减少、边集。线粒体肿胀,线粒体嵴断裂、消失,基质密度减低,呈空泡样变性,但ASCs组损伤程度较PBS组轻。照射后26周,PBS组超微结构损伤程度进一步加重,坏死范围扩大,ASCs组超微结构损伤较PBS组损伤程度轻,坏死区范围小,肌细胞间隙可见孤立的微型细胞结构,其形态呈肌原纤维状,胞质结构与周围固有的肌丝类似,但缺乏肌原纤维的明暗带结构,这些细胞结构在PBS组中未见显示,提示可能为来源于ASCs分化的幼稚成肌细胞(图 3)。
 | 图 3 ASCs对放射损伤骨骼肌超微结构的影响 ASCs组 80 Gy照射后26周,肌细胞肌间隙可见孤立的细胞结构,其胞质呈肌原纤维状(→),与周围固有的肌丝类似,但缺乏肌原纤维的明暗带结构 ×25 000 |
骨骼肌放射损伤可导致一系列临床症状并影响患者的生活质量甚至危及生命[9],目前临床上尚无有效的治疗手段。ASCs从脂肪组织中提取获得,扩增迅速,经过数代的培养仍可保持其多向分化潜能[10],ASCs在一定条件下能够分化成肌细胞[11]。因此,ASCs有可能成为骨骼肌放射损伤修复的种子细胞。
当肌细胞受损伤时位于肌纤维膜外基底膜内的肌卫星细胞群被激活、分裂,修复损伤的肌纤维或形成新的肌纤维[12]。放射损伤削弱了机体内源的肌源性前体细胞的再生,而在损伤的微环境中供体干细胞移植能促进肌细胞的损伤修复[13]。只有当骨骼肌肌细胞受损伤,如放射损伤[14],干细胞经静脉移植后再生的肌细胞中才能出现供体干细胞,表明干细胞能归巢到损伤的肌细胞中参与肌细胞的再生。LaBarge和Blau[15]给予GFP标记的骨髓间质干细胞(bone-marrow-derived stem cells,BMSCs)注射入放射损伤小鼠骨骼肌组织中,发现GFP标记的BMSCs变成了薄膜包绕的单核卫星细胞,研究认为BMSCs首先占据了肌肉干细胞壁龛,然后帮助再生成熟的肌细胞。
本研究中,ASCs组显示CM-Dil标记的ASCs随时间延长在损伤肌组织中向针道四周迁移,荧光逐渐减弱、模糊,8周后与肌细胞融合,分界不清,表明ASCs在放射损伤骨骼肌细胞中能长期存在。本研究中PBS组放射损伤区未见明显的肌卫星细胞代偿增生,本研究与文献报道一致[13],表明高剂量照射妨碍或削弱了内源性肌卫星细胞代偿增生。本研究中ASCs组光镜下肌细胞损伤分级程度较PBS组轻,照射26周后损伤区可见较多区域的肌卫星细胞代偿增生,表明ASCs移植具有修复骨骼肌放射损伤的作用,ASCs移植后可能直接参与肌细胞再生或促进肌卫星细胞代偿增生,具体机制仍不明确,有待进一步研究。
Misao等[16]利用Dil标记自体骨髓来源的骨髓单核细胞经静脉移植后电镜下观察发现兔急性心肌梗死区出现成簇的不成熟和相对成熟的心肌样细胞超微结构。本研究在电镜下观察发现,ASCs组肌细胞间隙出现孤立的细胞结构,其形态呈肌原纤维状,胞质结构与肌丝类似,但缺乏肌原纤维的明暗带结构,这些细胞结构在PBS组中未见显示,提示可能为来源于ASCs分化的幼稚成肌细胞,表明ASCs在放射损伤的微环境下具有成肌的可能。
综上所述,本研究认为ASCs能减轻受照射骨骼肌的病理组织学损伤,促进肌卫星细胞的代偿增生、再生肌组织,可能是修复骨骼肌放射损伤的部分机制。
| [1] | Zuk PA, Zhu M, Mizuno H, et al.Multilineage cells from human adipose tissue: implications for cell-based therapies[J].Tissue Eng, 2001,7(2):211-228. |
| [2] | Akita S, Akino K, Hirano A, et al.Noncultured autologous adipose-derived stem cells therapy for chronic radiation injury[J].Stem Cells Int, 2010,2010(12):1-8. |
| [3] | Akita S, Akino K, Hirano A, et al.Mesenchymal stem cell therapy for cutaneous radiation syndrome[J].Health Phys, 2010,98(6):858-862. |
| [4] | Ebrahimian TG, Pouzoulet F, Squiban C, et al.Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing[J].Arterioscler Thromb Vasc Biol, 2009,29(4):503-510. |
| [5] | Hadad I, Johnstone BH, Brabham JG, et al.Development of a porcine delayed wound-healing model and its use in testing a novel cell-based therapy[J].Int J Radiat Oncol Biol Phys, 2010,78(3):888-896. |
| [6] | Agay D, Scherthan H, Forcheron F, et al.Multipotent mesenchymal stem cell grafting to treat cutaneous radiation syndrome: Development of a new minipig model[J].Exp Hematol, 2010,38(10):945-956. |
| [7] | 孙威, 倪新初,孙苏平.高剂量照射兔骨骼肌放射损伤的超微病理研究[J].中华放射医学与防护杂志, 2012,32(6):593-596. |
| [8] | Gallet P, Phulpin B, Merlin JL, et al.Long-term alterations of cytokines and growth factors expression in irradiated tissues and relation with histological severity scoring[J].PLoS One, 2011,6(12):e29399. |
| [9] | Ghosh PS,Milone M.Clinical and laboratory findings of 21 patients with radiation-induced myopathy[J].J Neurol Neurosurg Psychiatry, 2015,86(2):152-158. |
| [10] | Nakagami H, Maeda K, Morishita R, et al.Novel autologous cell therapy in ischemic limb disease through growth factor secretion by cultured adipose tissue-derived stromal cells[J].Arterioscler Thromb Vasc Biol, 2005,25(12):2542-2547. |
| [11] | Dicker A, Le Blanc K, Aström G, et al.Functional studies of mesenchymal stem cells derived from adult human adipose tissue[J].Exp Cell Res, 2005,308(2):283-290. |
| [12] | Schmalbruch H,Lewis DM.Dynamics of nuclei of muscle fibers and connective tissue cells in normal and denervated rat muscles[J].Muscle Nerve, 2000,23(4):617-626. |
| [13] | Walsh S, Nygren J, Pontén A, et al.Myogenic reprogramming of bone marrow derived cells in a W(4)(1)Dmd(mdx) deficient mouse model[J]. PLoS One, 2011,6(11):e27500. |
| [14] | Nygren JM, Liuba K, Breitbach M, et al.Myeloid and lymphoid contribution to non-haematopoietic lineages through irradiation-induced heterotypic cell fusion[J].Nat Cell Biol, 2008,10(5):584-592. |
| [15] | LaBarge MA,Blau HM.Biological progression from adult bone marrow to mononucleate muscle stem cell to multinucleate muscle fiber in response to injury[J].Cell, 2002,111(4):589-601. |
| [16] | Misao Y, Takemura G, Arai M, et al.Bone marrow-derived myocyte-like cells and regulation of repair-related cytokines after bone marrow cell transplantation[J].Cardiovasc Res, 2006,69(2):476-490. |
 2015, Vol. 35
2015, Vol. 35