耐辐射奇球菌(Deinococcus radiodurans,DR)是目前为止发现的耐辐射能力最强的生物之一[1, 2]。因其对电离辐射、紫外线等辐射引起的致死和突变效应具有极强的抗性,近年来倍受辐射生物学、医学和环境工程学者的关注[3, 4]。pprI基因是耐辐射奇球菌DNA损伤修复和保护途径的总开关基因,可通过调控耐辐射奇球菌recA、pprA等基因的表达而加速电离辐射引起的DNA损伤的修复[5]。研究表明,该基因转化大肠杆菌,可以增强大肠杆菌的辐射抗性[6]。然而,由于原核生物与真核生物这两大种系在基因、蛋白组成和调控机制存在巨大差异,原核pprI基因能否转入BALB/c小鼠并在其体内发挥放射防护的作用,迄今尚未见国内外有关文献报道。本实验采用活体电转染技术,将本实验室构建pEGFP-c1-pprI基因真核表达载体[7],转染到BALB/c小鼠中,采用多种放射生物学指标,研究原核pprI基因对高等真核哺乳动物急性辐射损伤的防护作用。
1. 质粒:pEGFP-c1-pprI真核表达载体由本实验室制备保存。
2. 主要试剂与仪器:质粒大量抽提试剂盒购自德国QIAGEN公司,凋亡试剂盒购自南京凯基生物科技发展有限公司,活体基因导入仪(ECM830)购自美国BTX公司,血液细胞分析仪购自深圳迈瑞公司,流式细胞仪(Cytomics FC500)购自美国Beckman公司。
3. 实验动物及分组:SPF级纯品系BALB/c雄性小鼠共178只,购自上海斯莱克实验动物公司,6~8周龄,体重(18±2)g,经1周适应期饲养后,将小鼠用随机数字表法分为质粒转染剂量组(8只),死亡率观察组(90只)和放射效应观察组(80只)。其中,死亡率观察组90只,又分为3个组,单纯照射组,转染空载体pEGFP-c1的空载体组,转染pEGFP-c1-pprI的转基因组,每组30只;放射效应观察组又分为对照组(未照射)5只,单纯照射组、空载体组和转基因组各25只。
4. 质粒活体电转染小鼠:不同剂量的无内毒素的pEGFP-c1-pprI质粒1 μg/μl分别注射小鼠后腿股前肌肉,注射1 min后,用ECM830型活体基因导入仪,给予不同电场强度刺激。转染后24 h处死小鼠,取注射部位的肌肉做冰冻切片,用荧光显微镜观察GFP的荧光强度,确定重组质粒pEGFP-c1-pprI注射的最佳剂量和最佳电场强度。死亡率观察组和放射效应观察组的空载体组和转基因组分别于照前24 h将质粒pEGFP-c1和重组质粒pEGFP-c1-pprI以最佳剂量(50 μg/μl)注射入小鼠股前肌,1 min后用ECM830型活体基因导入仪以最佳电场强度进行转染。
5. 照射条件:苏州大学60Co γ源照射,吸收剂量率为0.38 Gy/min,死亡率观察组吸收剂量为6 Gy,放射效应观察组吸收剂量为4 Gy。
6. 死亡率观察:单纯照射组、空载体组和转基因组小鼠,经γ射线6 Gy照后饲养于无菌室中,观察30 d,每天记录小鼠的死亡情况。
7. 小鼠外周血象的检测:小鼠经γ射线照射4 Gy后,分别于照后1、7、14、28和35 d小鼠眼球取血,置于含EDTA的抗凝管中,用血液细胞分析仪测定WBC、PLT和淋巴细胞分类计数。
8. 小鼠胸腺、脾脏淋巴细胞和骨髓细胞凋亡率检测:小鼠经γ射线照射4 Gy后,分别于照后1、7、14、28和35 d小鼠处死,取胸腺和脾脏置于2 ml PBS中,梳刮制备淋巴细胞单细胞悬液。取股骨后用1 ml PBS冲洗骨髓腔,制备骨髓细胞单细胞悬液。将上述单细胞悬液离心半径6.5 cm,2 000 r/min,离心5 min后用PBS洗1次,再次同样离心弃上清,加3 ml Tris-NH4Cl溶液 (pH 7.2)混匀,静置5 min,破除红细胞,然后加PBS至10 ml中止。离心收集细胞(1~5)×105个,加入500 μl的Annexin V结合液悬浮细胞,再加入5 μl Annexin V和5 μl PI,避光室温孵育10 min,送流式细胞仪检测。
9. 小鼠组织器官的病理观察:对照组小鼠3只,处死后取肺、睾丸;单纯照射组、空载体组和转基因组分别于照射后第7和28天每组取5只小鼠处死,取肺、睾丸制作石蜡病理切片,显微镜下观察病理图片。
10. 统计学处理:数据以x±s表示。采用SPSS 16.0统计软件对血象和细胞凋亡数据进行单因素方差分析,对组间实验数据进行LSD检验。小鼠生存率分析采用Log-rank检验。P < 0.05为差异有统计学意义。
1. 根据小鼠肌肉组织GFP绿色荧光强度确定最佳质粒注射剂量和电场强度:质粒注射剂量一定(50 μg/50 μl)时,随着电场强度增大,小鼠肌肉组织的GFP的荧光强度逐渐增强,于200 V/cm时达到最强,之后随着电场强度增大,GFP的荧光强度反而降低;电场强度一定(200 V/cm),随着质粒注射剂量的增加,小鼠肌肉组织的GFP的荧光强度逐渐增强,于注射剂量为50 μg时达到最强,之后增加注射剂量,GFP的荧光强度反而降低。因此,死亡率观察组和放射效应观察组中的空载体组和转基因组注射剂量定为50 μg/50 μl,用ECM830型活体基因导入仪给予电场强度200 V/cm,持续50 ms,频率1 Hz的电脉冲8个。
2. 小鼠受照后的死亡率:各组小鼠经6 Gy γ射线照射后30 d内单纯照射组、空载体组、转基因组小鼠死亡率分别为60.0%、63.3%和30.0%。转基因组小鼠的死亡率较单纯照射组和空载体组均降低,差异有统计学意义(χ2=4.90、6.24,P < 0.05)。空载体组小鼠死亡率与单纯照射组相比,差异无统计学意义。3组小鼠的死亡多集中于照射后15 d内。
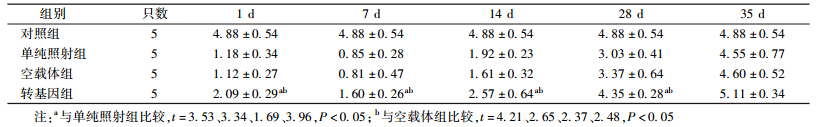
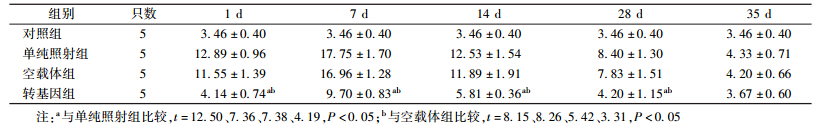
3. 小鼠外周血白细胞计数:4 Gy γ射线照射后各组小鼠不同时间点外周血白细胞计数的变化见表 1。由表 1可知,照后1 d,各组小鼠的外周血白细胞计数均开始降低,并于照后7 d降至最低,14 d开始恢复,至35 d恢复正常;在照后1、7、14和28 d,转基因组小鼠外周血白细胞计数明显高于单纯照射组,差异有统计学意义(t=3.53、3.34、1.69、3.96,P < 0.05),并且明显高于空载体组,差异有统计学意义(t=4.21、2.65、2.37、2.48,P < 0.05);与单纯照射组和空载体组相比,在照后1、7、14和28 d,转基因组小鼠外周血白细胞计数减少,差异有统计学意义(F=16.26、8.10、6.37、10.74,P < 0.05)。
| 表 1 照射后不同时间小鼠外周血白细胞计数的变化(×109/L,x±s) |
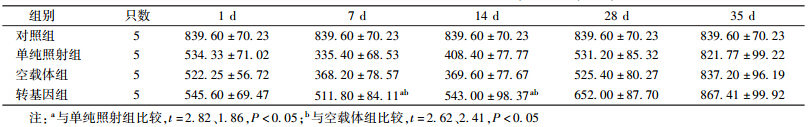
4. 小鼠外周血血小板计数:4 Gy γ射线照射后小鼠不同时间点外周血血小板计数变化列于表 2。照后1 d,各组小鼠的外周血血小板计数均出现降低,并于照后7 d降至最低,14 d开始恢复,至35 d恢复正常;在照后7和14 d,转基因组小鼠外周血血小板计数明显高于单纯照射组,差异有统计学意义(t=2.82、1.86,P < 0.05)并且明显高于空载体组,差异有统计学意义(t=2.62、2.41,P < 0.05);与单纯照射组和空载体组相比,转基因组小鼠外周血血小板计数在7和14 d减少幅度少于另两组,差异有统计学意义(F=7.36、5.71,P < 0.05)。
| 表 2 照后不同时间小鼠外周血血小板计数的变化(×109/L,x±s) |
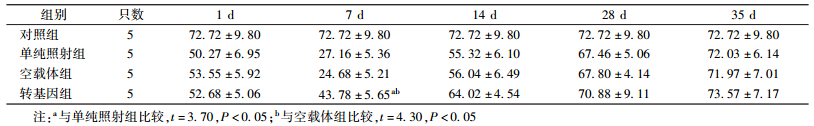
5.小鼠外周血淋巴细胞百分率:4 Gy γ射线照射后不同时间点小鼠外周血淋巴细胞百分率变化见表 3。由表 3可知,照后1 d各组小鼠的外周血淋巴细胞百分率均出现降低,并于照后7 d降至最低,14 d开始恢复,至35 d恢复正常;在照后7 d,转基因组小鼠外周血淋巴细胞百分率明显高于单纯照射组,差异有统计学意义(t=3.70,P < 0.05),并且明显高于空载体组,差异有统计学意义(t=4.30,P < 0.05);与单纯照射组和空载体组相比,转基因组小鼠外周血淋巴细胞百分率在7 d减少,差异有统计学意义(F=18.43,P < 0.05)。
| 表 3 照后不同时间小鼠外周血淋巴细胞百分率的变化(%,x±s) |
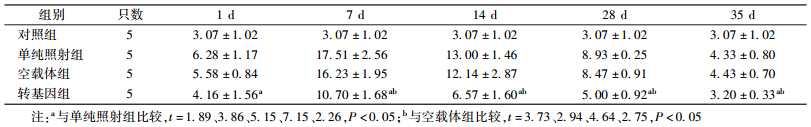
6. 小鼠胸腺细胞凋亡率:4 Gy γ射线照后不同时间点小鼠胸腺细胞凋亡率的变化见表 4。由表 4可知,照后1 d各组小鼠胸腺细胞凋亡率均出现增高,并于照后7 d增高至最高值,14 d开始恢复,至35 d基本恢复正常;在照后1、7、14、28和35 d,pEGFP-c1-pprI基因转染组小鼠胸腺细胞凋亡率明显低于单纯照射组,差异有统计学意义(t=1.89、3.86、5.15、7.15、2.26,P < 0.05)并且在照后7、14、28和35 d明显低于空载体组,差异有统计学意义(t=3.73、2.94、4.64、2.75,P < 0.05);与单纯照射组和空载体组相比,在照后1、7、14、28和35 d,转基因组小鼠胸腺细胞凋亡率增高幅度少于另两组,差异有统计学意义(F=3.88、14.91、14.14、39.86、5.65,P < 0.05)。
| 表 4 照后不同时间小鼠胸腺细胞凋亡率的变化(%,x±s) |
7. 小鼠脾脏细胞凋亡率:4 Gy γ射线照后不同时间点小鼠脾脏细胞凋亡率的变化列于表 5。由表 5可知,照后1 d各组小鼠脾脏细胞凋亡率均出现增高,并于照后7 d增至最高值,14 d开始恢复,至35 d恢复正常;在照后1、7、14和28 d,pEGFP-c1-pprI基因转染组小鼠脾脏细胞凋亡率明显低于单纯照射组,差异有统计学意义(t=12.50、7.36、7.38、4.19,P < 0.05)并且明显低于空载体组,差异有统计学意义(t=8.15、8.26、5.42、3.31,P < 0.05);与单纯照射组和空载体组相比,转基因组小鼠脾脏细胞凋亡率在照后1、7、14和28 d虽然也增高,但是增高幅度少于另两组,差异有统计学意义(F=97.95、56.61、33.55、14.71,P < 0.05)
| 表 5 照后不同时间小鼠脾脏细胞凋亡率的变化(%,x±s) |
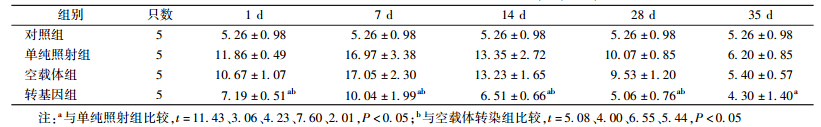
8. 小鼠骨髓细胞凋亡率:4 Gy γ射线照射后不同时间点小鼠骨髓细胞凋亡率变化列于表 6。由表 6可知,照后1 d各组小鼠骨髓细胞凋亡率均出现增高,并于照后7 d增至最高值,14 d开始恢复,35 d恢复正常;在照后1、7、14、28 和35 d,pEGFP-c1-pprI基因转染组小鼠骨髓细胞凋亡率明显低于单纯照射组,差异有统计学意义(t=11.43、3.06、4.23、7.60、2.01,P < 0.05)并且在照后1、7、14和28 d明显低于空载体组,差异有统计学意义(t=5.08、4.00、6.55、5.44,P < 0.05);与单纯照射组和空载体组相比,在照后1、7、14、28和35 d,转基因组小鼠骨髓细胞凋亡率增高幅度少于另两组,差异有统计学意义(F=53.70、11.75、21.78、41.40、4.54,P < 0.05)。
| 表 6 照后不同时间小鼠骨髓细胞凋亡率的变化(%,x±s) |
9. 小鼠肺脏的病理变化:各组小鼠照射后7和28 d肺脏的组织学变化见图 1。单纯照射组小鼠照射后7 d,肺泡壁血管充血严重,红细胞渗出较多,肺泡间隔水肿严重;空载体组小鼠照射后7 d,红细胞渗出增多,充血增多,肺泡腔出现水肿液。转基因组小鼠照射后7 d,肺泡毛细血管壁充血较单纯照射组、空载体组轻,有红细胞渗出,肺泡腔轻度水肿。单纯照射组、空载体组小鼠照射后28 d,红细胞渗出减少,肺泡间隔水肿,上皮增生变厚,肺泡受压变形。pEGFP-c1-pprI基因转染组小鼠照射后28 d,红细胞渗出减少,肺泡间隔轻微增厚,组织结构基本恢复正常。
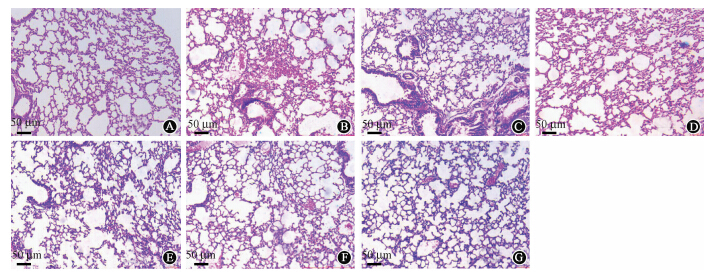 | 注:A为正常小鼠肺脏组织切片,B~D分别为照后7 d单纯照射组、空载体组、转基因组小鼠肺脏组织切片,E~G分别为照后28 d单纯照射组、空载体组、转基因组小鼠肺脏组织切片图 1 小鼠肺脏组织病理切片图 HE ×100 |
10.小鼠睾丸的病理变化:各组小鼠照后7和28 d的睾丸组织学变化示于图 2。由图 2可见,照后7 d单纯照射组、空载体组睾丸破坏严重,生精小管及支持细胞萎缩坏死,精原细胞及各级精母细胞变性坏死,数量减少,中间腔空虚,管腔内出现胶原物质,转基因组变化较轻;照后28 d时,单纯照射组和空载体转染组"空白区"增多,而转基因组小鼠的部分生精小管及支持细胞再生完成,各级精原细胞排列整齐紧密。
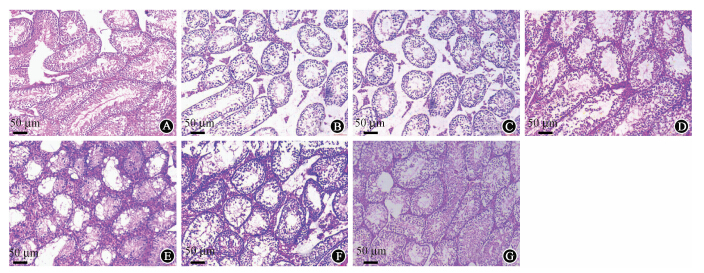 | 注:A为正常小鼠睾丸组织切片,B~D分别为照后7 d单纯照射组、空载体组、转基因组小鼠睾丸组织切片,E~G分别为照后28 d单纯照射组、空载体组、转基因组小鼠睾丸组织切片图 2 小鼠睾丸组织病理切片图 HE ×100 |
电离辐射在给人类经济和生活带来巨大裨益的同时,各种核与辐射事故亦不断发生,其大剂量电离辐射会引起广阔地域和人群的急性放射损伤 (acute radiation injury,ARI)。近年来,为了应对核突发事件,提高国家核安全水平,急性放射损伤救治与防护的研究已成为世界各国重点投资和研究的领域,迄今有关文献报道极少。耐辐射奇球菌发现50余年来,耐辐射奇球菌pprI基因及其蛋白的功能及抗辐射机制的研究多局限于原核细胞内,即耐辐射奇球菌自身或大肠杆菌系统[5, 6, 7]。本实验室近年来研究表明,耐辐射奇球菌pprI基因转染对BALB/c小鼠中子急性放射损伤具有显著的防护作用[8, 9]。本实验在此基础上,观察带有荧光标记的耐辐射奇球菌pprI基因对辐射敏感的SPF级BALB/c小鼠的辐射防护作用,结合造血免疫系统的变化,重要脏器病理的变化,进一步阐明耐辐射奇球菌pprI基因对哺乳动物的抗辐射作用。
活体基因电转染通过直流电场的瞬间作用将外源目的基因导入活体的靶组织或器官。该方法被认为是一种可行性较高的高效转染方法,已经被应用于很多组织和动物模型[10, 11]。pprI基因是耐辐射奇球菌DNA损伤修复的关键基因,本研究证实,转染了pEGFP-c1-pprI的稳转细胞株辐射抗性增强,细胞DNA损伤修复加快[7]。高剂量电离辐射可以导致严重的ARI,进而引起多器官的损伤和死亡率增高。BALB/c小鼠对辐射相当敏感,本实验发现pprI基因转染组小鼠的死亡率明显低于单纯照射组及空载体转染组,表明pprI基因成功转染到小鼠体内后对小鼠起到了辐射防护作用,降低了受照小鼠的死亡率。
电离辐射所致的造血系统的变化可作为ARI诊治及预后的重要判断指标[12]。本实验检测了不同组别小鼠受照后不同时间点白细胞、血小板、淋巴细胞百分率及胸腺、脾脏、骨髓细胞凋亡率的变化。结果显示小鼠白细胞、血小板及淋巴细胞百分率在照后均降低,胸腺、脾脏、骨髓细胞的凋亡率均增高,但pprI基因转染组小鼠的血象降低程度及细胞凋亡增高程度均低于单纯照射组和空载体组。表明pprI基因可以提高机体的防御能力,通过胸腺、脾脏、骨髓细胞的凋亡来调节免疫及造血系统,加快放射损伤的修复。
ARI常表现为多系统的损伤,除了造血功能抑制,放射性肺损伤、生殖系统损伤等都是常见的病理变化。实验结果显示,小鼠在受4 Gy γ射线照射后,肺脏血管通透性增高、肺泡充血水肿、肺泡腔出现水肿液,而pprI基因转染组小鼠肺脏的病变轻于单纯照射组和空载体组,且恢复较快,表明pprI基因对肺脏有明显的保护作用,可以减少肺脏充血、水肿,减轻肺纤维化,促进修复。睾丸对射线高度敏感,受照后睾丸生精小管及支持细胞萎缩坏死,精原细胞及各级精母细胞变性坏死,数量减少,中间腔空虚,而pprI基因转染组小鼠病变较轻,至28 d部分生精小管及支持细胞再生完成,各级精原细胞排列整齐紧密,组织结构基本恢复正常,表明pprI基因可以保护睾丸组织,加速修复。
综上所述,pprI基因转染可以提高小鼠受照后的生存率,并且可能通过加强造血系统、免疫系统及其他重要脏器的修复能力来提高整个机体的辐射抗性。本研究为原核pprI基因的进一步临床应用提供了有价值的资料。
| [1] | Battista JR, Eral AM, Park MJ. Why is Deinnococcus radiodurans so resistant to ionizing radiation[J]. Trends Microbiol, 1999, 7(9):362-365. |
| [2] | Minton KW. DNA repair in the extremely radioresistant bacterium Deinnococcus radiodurans[J]. Mol Microbiol, 1994, 13(1): 9-15. |
| [3] | Brim H, McFarlan SC, Fredrickson JK, et al. Engineering Deinococcus radiodurans for metal remediation in radioactive mixed waste environments[J]. Nat Biotechnol, 2000,18(1): 85-90. |
| [4] | Lange CC, Wackett LP, Mintonation KW, et al. Engineering a recombinant Deinococcus radiodurans for organopollutant degradation in radioactive mixed waste environment[J]. Nat Biotechnol,1998,16(10):929-933. |
| [5] | Hua Y, Narumi I, Gao G, et al. PprI: a general switch responsible for extreme radioresistance of Deinococcus radiodurans[J]. Biochem Biophys Res Commun, 2003, 306(2): 354-360. |
| [6] | Gao G, Tian B, Liu L, et al. Expression of Deinococcus radiodurans PprI enhances the radioresistance of Escherichia coli[J]. DNA Repair, 2003, 2(12): 1419-1427. |
| [7] | 文玲,施怡,任丽丽,等. 耐辐射球菌pprI基因真核表达载体的构建及其抗辐射作用[J].中华放射医学与防护杂志, 2014,34(8):563-568. |
| [8] | 杨占山,李娜,王天昶. 一种含有原核基因pprI的真核重组质粒及其用途[P]. 中国,ZL200910003512.2.2011-04-06. |
| [9] | 陈婷婷,连利霞,牟英,等. 抗辐射球菌pprI基因活体电转染救治小鼠γ射线损伤的实验研究[J]. 辐射研究与辐射工艺学报,2010, 28(3):166-171. |
| [10] | Wang Q, Jiang W, Chen Y, et al. In vivo electroporation of minicircle DNA as a novel method of vaccine delivery to enhance HIV-1-specific immune responses[J]. J Virol, 2014, 88(4): 1924-1934. |
| [11] | Bodles-Brakhop AM, Heller R, Draqhia-AKli R. Electroporation for the delivery of DNA-based vaccines and immunotherapeutics: current clinical developments[J]. Mol Ther, 2009, 17(4):585-592. |
| [12] | Shao L, Feng W, Li H, et al. Total body irradiation causes long-term mouse BM injury via induction of HSC premature senescence in an lnk4a- and Arf-independent manner[J]. Blood, 2014, 123(20):3105-3115. |
 2015, Vol. 35
2015, Vol. 35