辐射作为一种物理刺激因素能诱发细胞自噬[1]。自噬是细胞接受内外刺激后,由相关蛋白分子通过级联反应组装成含有溶酶体酶的自噬小泡,进而降解细胞内代谢废物或受损线粒体等亚细胞器的过程[2]。细胞外刺激可以通过一些胞内分子的介导激活细胞自噬,例如可通过细胞内的活性氧(ROS)分子介导[2]。而ROS又是辐照中产生引发细胞损伤的重要物质[3],且ROS能调节细胞内的氧化还原状态[4]。胞内氧化还原状态的改变能调控一种重要的酪氨酸激酶—src激酶活性[5, 6, 7]。本研究从α粒子照射对细胞自噬系统的影响出发,探讨不同剂量辐照诱发的ROS水平与自噬之间的关系,以及辐照引发的细胞内ROS变化对src激酶系统的影响。
1. α粒子发射装置与试剂:采用旋转可调α源,241Am作为放射源(中国原子能科学研究院提供),α粒子在细胞表面的平均能量为3.5 MeV,剂量率为1 cGy/s[8]。雷帕霉素购自美国Sigma公司,PI购自美国Invitrogen公司。
2.细胞培养与照射:人胚肾上皮细胞HEK293(美国模式培养物集存库ATCC)培养在含有10%胎牛血清(美国Hyclone公司)的DMEM培养基(美国GIBCO公司)中,放入温度为37℃、CO2浓度为5%的细胞培养箱中培养。贴壁后12 h,接种到底部3.5 μm厚度聚酯薄膜(mylar膜)的特制培养皿中,以便于α粒子从培养皿底部穿透到达细胞。当细胞在mylar膜上培养到70%~80%密度时,分别接受0、10和300 cGy的α粒子照射。
3.免疫印迹实验与抗体:用含有50 mmol/L Tris-HCl(pH 7.5),150 mmol/L NaCl,0.5%脱氧胆酸钠,1%乙基苯基聚乙二醇(NP-40)和蛋白酶抑制剂(Roche)的细胞裂解液裂解细胞。裂解出的胞内蛋白在10%或12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离,转到聚偏二氟乙烯膜(PVDF)上(Millipore)。用以下抗体检测转移到PVDF膜上的蛋白:鼠源性β-肌动蛋白单克隆抗体、兔源性src和src (tyrosine 419)多克隆抗体(美国Santa Cruz公司),兔源性LC3I/II多克隆抗体(美国Cell Signaling公司)。
4. 细胞转染实验:HEK293细胞接种时密度控制在30%左右,待细胞贴壁并继续增殖到密度为40%左右时,用脂质体TurboFect(美国Thermo Scientific公司)转染试剂包裹表达载体GFP和GFP-LC3转染细胞。
5. ROS检测:细胞内ROS水平用分子探针2',7'-二氯氢化荧光素二乙酸酯(DCFH-DA,美国Molecular Probes公司)示踪,用酶标仪激发的荧光值量化得出。辐照后的细胞用含有1%胎牛血清(FBS)的自配D-Hank's缓冲液37℃洗2 min,然后用2 μmol/L的DCFH-DA在细胞培养箱内孵育40 min,再用4℃ D-Hank's洗两遍。用酶标仪在波长(485/520 nm)处获得探针的荧光值,最后与对照组相比得出ROS的相对数值。在时程实验中,受高低剂量α粒子辐照后的细胞分别在照射后2、4和6 h时间点用上述方法检测细胞内ROS的量。
6. 二甲基亚砜(DMSO)预处理照射细胞:HEK293细胞在照射前分为两组,即对照组和DMSO处理组。辐照前对照组3皿细胞均不作任何处理;处理组3皿细胞分别加入10 μl DMSO,至其工作浓度为0.5%。预处理1 h后,每组内3皿细胞分别予以0、10及300 cGy α粒子照射,4 h后用免疫印迹法检测胞内相关蛋白水平变化。
7. 流式细胞术测细胞死亡率:HEK293细胞在照射前分为两组,即对照组和雷帕霉素处理组。辐照前,对照组内3皿细胞分别加入0.2 μl乙醇(溶剂对照);处理组内3皿细胞分别加入0.2 μl雷帕霉素(溶解在乙醇中的1 mmol/L雷帕霉素储存液),至雷帕霉素工作终浓度为0.1 μmol/L(辐照特制培养皿含2 ml细胞培养基)。处理2 h,每组内3皿细胞分别予以0、10及300 cGy的α粒子照射。8 h后细胞用PI(美国Invitrogen公司)进行单染,上机前用4℃ PBS缓冲液洗两遍。以流式细胞仪(美国BD公司)在488 nm波长处激发并用PE通道检测PI荧光,所测数据用FlowJo 7.6软件进行后期数据分析。
8. 统计学处理:数据用x±s表示。采用GraphPad Prism 5软件进行统计学处理,组间比较采用配对t检验。P<0.05为差异有统计学意义。
1.细胞辐射自噬发生的剂量相关性:在10 cGy α粒子照射下,LC3I/II比例相比0 cGy降低(t=4.07,P<0.05);而在300 cGy照射下,LC3I/II比例相比0 cGy时升高(t=2.93,P<0.05),见图 1。
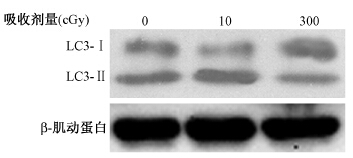 | 图 1 不同剂量α射线照射后4 h检测HEK293细胞内源性蛋白LC3的变化 |
细胞在转染绿色荧光蛋白质粒GFP以及GFP-LC3 18 h后予以高低剂量α粒子照射发现,10 cGy照射使胞质内呈现点状GFP-LC3的细胞比例比0 cGy增多(t=12.29,P<0.05),见图 2;而0和300 cGy组胞质内均无点状GFP-LC3出现。
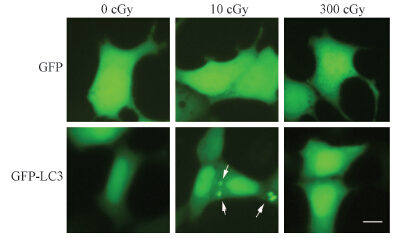 | 注:箭头示胞质内GFP-LC3出现点状分布图 2 HEK293细胞转染GFP及GFP-LC3质粒后经α射线照射后6 h镜下观察 ×400 |
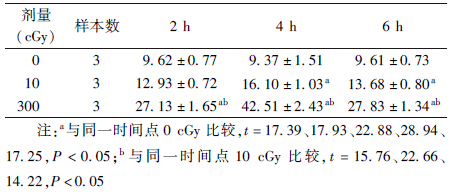
2. α粒子辐照对胞内ROS水平和src激酶磷酸化影响:在照射后2、4和6 h内,ROS水平在10 cGy α射线辐照后略微升高,而在300 cGy辐照后,ROS水平大幅上升(t=22.88、28.94和17.25,P<0.05),且均在辐照后4 h达到最大值,见表 1。进一步检测src激酶的活性变化,如图 3所示,与0 cGy 相比,10 cGy的照射使src第419位酪氨酸位点磷酸化水平升高(t=5.66,P<0.05);而300 cGy辐照下,src 419位点磷酸化水平降低(t=4.67,P<0.05)。
| 表 1 不同剂量α粒子照射后不同时间对细胞内ROS影响(x±s) |
 | 图 3 HEK293细胞经不同剂量α粒子照射后4 h内源性蛋白src、p-src(419)的变化 |
3. DMSO对不同剂量辐照诱导的src激酶活性变化的影响:10与300 cGy照射导致的src激酶活化和抑制效应部分被逆转,即辐照前用DMSO预处理细胞后,高低剂量的α粒子照射对src激酶磷酸化水平无显著影响,见图 4。
 | 图 4 两组HEK293细胞不同剂量照射后4 h细胞内源性蛋白src、p-src(419)的表达 |
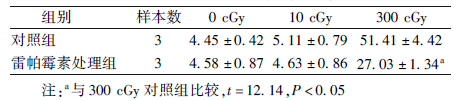
4.自噬诱导剂雷帕霉素对不同剂量照射细胞死亡率的影响:在10 cGy照射下,雷帕霉素处理组细胞死亡率与对照组相比,差异无统计学意义;而以300 cGy照射时,细胞死亡水平与对照组相比明显减少(t=12.14,P<0.05,表 2)。
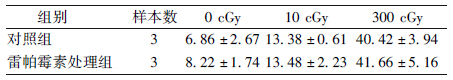
进一步检测雷帕霉素对照射细胞内ROS的影响,结果表明,高低剂量辐照前予以雷帕霉素处理细胞,均不能影响胞内ROS的产生量(表 3)。
| 表 2 雷帕霉素对高低剂量α粒子辐照诱导细胞死亡率的影响(%,x±s) |
| 表 3 雷帕霉素对高低剂量α粒子辐照诱导胞内产生ROS的影响(x±s) |
已有报道指出辐照能诱导正常和多种肿瘤细胞的自噬[1]。因此,用干预自噬系统的药物预处理照射前的肿瘤细胞,常用来增加肿瘤细胞对射线的敏感性。例如,自噬诱导剂雷帕霉素能增加抗X射线肝癌细胞系的凋亡,而自噬抑制剂3-MA能增强抗X射线肝癌细胞系的辐照抗性[9];用RNA干扰法抑制自噬相关基因能增加γ射线诱导的辐射抗性肿瘤细胞系的凋亡[10]。但目前关于通过对正常细胞系的自噬系统进行干预从而降低高剂量辐照诱导细胞死亡率的报道并不多。细胞在缺氧和ROS增多条件下都能诱发自噬的产生[2, 11, 12],但不同照射剂量诱发的胞内ROS水平与细胞自噬关系尚不清楚。本研究发现,低剂量(10 cGy)的α粒子能诱导细胞自噬,而在高剂量(300 cGy)时自噬被抑制,这在一定程度上揭示了辐射诱导自噬的剂量关系。
src酪氨酸激酶受细胞内氧化还原状态的调控[5, 6],而细胞内的ROS水平是引起细胞内氧化还原状态改变的主要因素[4],且ROS是引发细胞辐射损伤的关键因素之一[3]。本实验显示,低剂量和高剂量α粒子辐照对细胞的损伤不同,细胞自噬水平有显著差异。其原因可能是在低剂量(10 cGy)条件下,受辐照细胞产生的ROS较少,而低水平的ROS可以诱导细胞自噬[2],这时细胞的死亡率与未受α粒子辐照的细胞相似。表明低剂量α粒子辐照诱导的自噬可能为细胞对自身保护的一种适应性反应。进一步实验发现,由于高低剂量α粒子辐照引发的ROS水平存在显著差异,细胞内的氧化还原状态在细胞受高低剂量辐照时不同,导致src激酶活性不同。可以通过src激酶相应位点的磷酸化水平变化体现,即低剂量α粒子激活src激酶通路,而高剂量α粒子抑制src激酶通路,这可能是导致细胞在高低剂量α粒子照射下自噬系统分别被抑制和激活的原因。 而以ROS淬灭剂DMSO预处理照射细胞后,src激酶活性相对于未用DMSO处理组发生部分逆转。有报道指出src激酶的活性状态受细胞内的ROS浓度以及与src激酶所在的亚细胞定位有关。定位于细胞膜周围的src激酶形成双分子之间二硫键,使src灭活;而定位于胞质的src激酶形成分子内二硫键,使src激活[4]。这能部分解释不同照射剂量诱发的ROS水平差异对src激酶活性的相反影响。以上结果初步揭示,高低剂量α粒子辐照诱发的细胞内ROS水平的差异对细胞内激酶系统(src激酶)与自噬系统产生相似的影响趋势。
自噬在低剂量辐射时被诱导很可能是细胞对抗外界刺激的一种适应性反应,这种适应性在细胞受高剂量α粒子辐照时被抑制。因此,在受到高剂量辐射(300 cGy)时,细胞死亡率显著增多。受高剂量α粒子(300 cGy)照射前预先对细胞加入自噬诱导剂雷帕霉素,细胞死亡率明显降低,而雷帕霉素并未对辐照诱发的ROS产生影响。以上结果提示,雷帕霉素提升自噬水平后不是通过降低胞内ROS来降低细胞死亡率,很可能是通过加速细胞对辐照诱发的有害亚细胞器等自噬底物的清除,最终使细胞死亡率下降。
综上所述,α粒子辐照引起细胞自噬的激活或抑制的始动因素是由于细胞受不同剂量辐照后,产生的ROS不同。ROS本身又能引起细胞内氧化还原状态的改变,继而影响src激酶活性。不同剂量照射引发的自噬系统和src激酶活性的变化趋势非常类似,因此,src激酶和细胞自噬的上下游关系需待进一步证实。以自噬系统作为靶点,通过自噬诱导剂雷帕霉素提高自噬水平,进而减少辐射诱发的胞内损伤因子,最终降低高剂量α粒子诱发的细胞死亡率。上述结果对在肿瘤放射治疗中,为降低正常组织的辐射敏感性,达到对非肿瘤正常组织的辐射防护提供了一定的实验依据。
| [1] | Zois CE, Koukourakis MI. Radiation-induced autophagy in normal and cancer cells: towards novel cytoprotection and radio-sensitization policies?[J]. Autophagy, 2009, 5(4): 442-450. |
| [2] | He C, Klionsky DJ. Regulation mechanisms and signaling pathways of autophagy[J]. Annu Rev Genet, 2009, 43: 67-93. |
| [3] | Prise KM, O'Sullivan JM. Radiation-induced bystander signalling in cancer therapy[J]. Nat Rev Cancer, 2009, 9(5): 351-360. |
| [4] | Corcoran A, Cotter TG. Redox regulation of protein kinases[J]. FEBS J, 2013, 280 (9): 1944-1965. |
| [5] | Giannoni E, Buricchi F, Raugei G, et al. Intracellular reactive oxygen species activate Src tyrosine kinase during cell adhesion and anchorage-dependent cell growth[J]. Mol Cell Biol, 2005, 25 (15): 6391-6403. |
| [6] | Tang H, Hao Q, Rutherford SA, et al. Inactivation of SRC family tyrosine kinases by reactive oxygen species in vivo[J]. J Biol Chem, 2005, 280 (25): 23918-23925. |
| [7] | Akhand AA, Pu M, Senga T, et al. Nitric oxide controls src kinase activity through a sulfhydryl group modification-mediated Tyr-527-independent and Tyr-416-linked mechanism[J]. J Biol Chem, 1999, 274 (36): 25821-25826. |
| [8] | Chen S, Zhao Y, Han W, et al. Mitochondria-dependent signalling pathway are involved in the early process of radiation-induced bystander effects[J]. Br J Cancer, 2008, 98 (11): 1839-1844. |
| [9] | Kuwahara Y, Oikawa T, Ochiai Y, et al. Enhancement of autophagy is a potential modality for tumors refractory to radiotherapy[J]. Cell Death Dis, 2011, 2: e177. |
| [10] | Apel A, Herr I, Schwarz H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res, 2008, 68(5): 1485-1494. |
| [11] | Kundu M, Thompson CB. Autophagy: basic principles and relevance to disease[J]. Annu Rev Pathol, 2008, 3: 427-455. |
| [12] | Mizushima N, Klionsky DJ. Protein turnover via autophagy: implications for metabolism[J]. Annu Rev Nutr, 2007, 27: 19-40. |
 2015, Vol. 35
2015, Vol. 35