木村病(Kimura's disease,KD),是一种罕见的慢性炎性疾病,临床上表现为无痛性淋巴结肿大或软组织包块,进展缓慢,常因无自觉症状而被忽视,其病因及发病机制尚未明确。主要表现为头颈部无痛性软组织肿块,可多发,易复发,病理表现以淋巴细胞增生及嗜酸性粒细胞浸润为主,常伴有区域淋巴结或腮腺侵犯。本研究就5例木村病报道如下。
一、 资料与方法
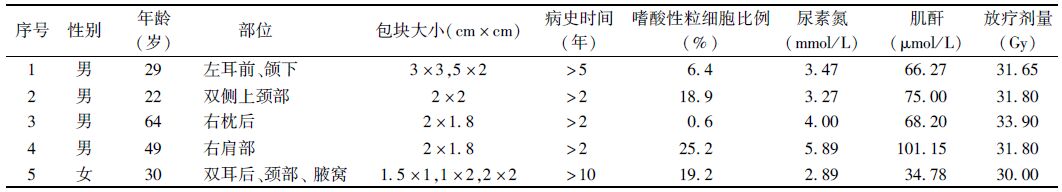
1. 一般资料:回顾性分析2009年1月—2014年3月贵州省肿瘤医院收治的木村病患者5例,临床特点见表 1。年龄22~64岁,中位年龄30岁,既往均无恶性肿瘤及放化疗史。临床表现为无痛性、结节状、表面光滑、质韧、边界不清的肿大包块,持续时间2~10年不等,缓慢长大,可多发或单发,不伴有皮肤瘙痒,就诊时最大包块直径达5 cm,5例中4例发生于头颈部,1例发生于右肩部。5例患者中3例外周血象中嗜酸粒细胞比例明显升高,2例患者尿素氮稍升高,但蛋白尿正常。包块切除术后经病理诊断证实,手术后均评价R2(肉眼残留)。
|
|
表 1 5例木村病患者的临床特征 |
2.治疗方法:5例患者手术治疗后病灶残留均行放射治疗,1例发生于右肩部放疗后复发行化疗。
放疗为直线加速器6 MV(瑞典医科达公司)X射线的适形调强放疗(IMRT),5例术后患者靶区肿瘤靶区(GTV)均为病变肿大淋巴结,临床靶区(CTV)为GTV外扩1 cm,并勾画危及器官。本组病例肿瘤放疗的剂量范围在GTV照射剂量给予30.0~33.9 Gy/15次,分割剂量为2.0~2.26 Gy,1次/d,5次/周。4号患者复发,应再行放疗,但因时间间隔短,故行COP方案化疗2周期,长春新碱1.5 mg第1天;环磷酰胺1.4 g 第1天;泼尼松片 100 mg/d 第1、2天,未复查,不能评价疗效。
二、结果
至2014年10月1日,5例患者均行随访,随访时间从7个月至5年,5例均存活(3例无瘤生存,2例带瘤生存),放疗结束后采用WHO标准评价疗效,5例均达到完全缓解(CR),其中1例为术后<2年复发放疗,疗效达到完全缓解后1年再次复发行受累野放疗,放疗后达到完全缓解,后再次复发,因放疗时间较短,无法再次行放疗,故行COP方案化疗,拒绝继续治疗,带瘤生存,化疗后嗜酸性粒细胞比例及肾功能均正常,近期随访患者带瘤生存,不良反应按Recist标准进行评价上消化道反应(恶心、呕吐)2例、皮肤反应2例,口腔黏膜炎Ⅰ度2例。
三、讨论
木村病由中国的金显宅首先于1937年报道,随后以日本学者Kimura(木村)的名字命名,是一种少见的、病因不明的累及头颈部软组织及浅表淋巴结的良性慢性炎症性疾病,也称不寻常性淋巴组织增多性肉芽肿[1]。
本病好发于亚裔人群,青壮年男性多见,80%患者发病年龄在30~40岁,近年来报道男女比例可高达6~10∶1[2],亦可见儿童患者[3]。因无明显自觉症状,常隐匿发病,病程往往从几个月到十几年不等,文献报道40%~100%有皮肤瘙痒及色素沉着,多发生于肿块处皮肤[4]。5例患者中,男性占4名,除1名老年外,其余3名均为青壮年,与上述文献相符,除肿大包块外,亦无明显自觉症状。
文献显示,病变区局部多表现为无痛性淋巴结或软组织肿块,进展缓慢,肿块周界不清楚,质软,与周围组织粘连,直径1~20 cm(平均3 cm)[5],可有消长史,部分患者还可发现腮腺、下颌下腺肿大,超过50%的病例有淋巴结肿大[6],有时淋巴结肿大是该病的唯一表现,实验室检查特点为外周血象中嗜酸性粒细胞比例和计数明显升高。本病虽为良性病变,预后良好,但较易复发,故需采用较为积极的治疗方法。传统治疗方式有外科手术切除、小剂量放射治疗以及药物治疗。治疗时需要根据实际情况采取最为合适的方案,多采用综合治疗方案。临床上对单发局部肿瘤一般先手术切除,因肿瘤边界不清,手术不易彻底切除,且切除后极易复发,复发率可高达40%,故术中宜行冷冻切片检查以保证足够切除范围,减少复发[7]。临床经验总结发现,手术后加小剂量放疗或手术后联合糖皮质激素治疗可明显提高治愈率。对于病变范围大、多发、界限不清或局部浸润以及术后复发的病例主张首选放射治疗[8],本病对放疗敏感,多数报道有效率为100%,对于手术或放疗后复发的病灶,再次放疗仍有效[9, 10],与本组结果一致。Hareyama等[11]发现放疗剂量为26~30 Gy,靶区包含病变区邻近淋巴结时,局部控制率即可达90%,本组患者中,1例患者术后复发再次放疗达到完全缓解后1年区域复发,其余4例患者术后残留病灶及时补充放疗未见复发。Chitapanarux等[9]对8例确诊的KD患者行放射治疗,总剂量30~40 Gy,不良反应可耐受,随访21个月无1例复发。有学者认为放疗至肿块缩小70%以上即可停照,放疗结束后未消除的病灶可继续缩小[12],但尚未证实此法相较于传统的放疗,其复发率差异是否存在统计学意义。对于少数皮质激素耐药患者也可采用环磷酰胺 CHOP化疗方案,或单用环磷酰胺的方案进行治疗[13]。本组病例数较少,其中1例患者手术治疗后行放疗,再次放疗不允许,故采用COP方案化疗,化疗后带瘤存活,不失为一种可选择的补救措施。
IMRT应用于头颈部肿瘤以及前列腺肿瘤的报道相继发表,并证实了该技术具有使肿瘤靶体积获得高度适形的剂量学特点,可提高肿瘤靶体积照射剂量,同时又能较好地保护肿瘤周围正常组织和器官[14, 15]。由于IMRT可以将一个照射野分成多个细小的子野(线束),对这些线束给予不同的权重,使射野内产生优化不均匀的强度分布,进而使高剂量区域分布与靶体积形状高度一致,最大限度地将放射剂量集中在靶区内以杀灭肿瘤细胞,在PTV和危及器官计划靶区(PRV)之间获得更适合的剂量分布[16]。本研究中,5例患者中完成了剂量在30.0~33.9 Gy范围的放疗,均获得较好的疗效,仅1例完成规定剂量后1年区域复发。本研究中放射治疗不良反应轻,放疗所致上消化道反应、口腔黏膜炎及皮肤反应均为I度,可以耐受。
综上所述,木村病主要是局部包块的手术切除和放疗,疗效好,病变组织对放疗较敏感,不适宜手术这可选用,或在术前应用以缩小肿块,利于进行手术,术后加用小剂量放疗可以减少复发。手术后联合调强放疗疗效好、不良反应小、耐受性好,可继续扩大病例数,行进一步分析。
| [1] | 程茂杰, 常建民. 木村病[J]. 中华皮肤科杂志, 2010, 43(3):218-220. |
| [2] | Chen H, Thompson LD, Aguilera NS, et al. Kimura disease:a clinicopathologic study of 21 cases[J]. Am J Surg Pathol, 2004, 28(4):505-513. |
| [3] | Soeria-Atmadja S, Oskarsson T, Celci G, et al. Maintenance of remission with cyclosporine in paediatric patients with Kimura's disease -two case reports[J]. Acta Paediatr, 2011, 100(10): 186-189. |
| [4] | 杨珂, 谷京城.木村病临床研究进展[J].辽宁医学院学报, 2012,33(2):179-181. |
| [5] | 袁佳, 李卫国, 吴新中, 等. 颜面部多发性复发性嗜酸性粒细胞增生性淋巴肉芽肿1例及文献复习[J]. 广东牙病防治, 2010, 18(7): 367-369. |
| [6] | 肖鑫武, 施毅, 宋勇. Kimura病(附1例报告)[J]. 东南国防医药, 2005, 7(1): 7-9. |
| [7] | 姜蕾, 姜晓钟, 赵云富, 等. 头颈部Kimura病的临床病理特点与诊断[J]. 临床与实验病理学杂志, 2007, 23(3): 321-323. |
| [8] | 刘祖平, 付晓霞. 木村病临床病理分析[J].现代实用医学, 2010,22(4):471-472. |
| [9] | Chitapanarux I, Ya-In C, Kittichest R, et al. Radiotherapy in Kimura' s disease: a report of eight cases[J]. Med Assoc Thai, 2007, 90(5): 1001-1005. |
| [10] | Kilciksiz S, Calli C, Eski E, et al. Radiotherapy for Kimura's disease case report and review of the literature[J]. J BUON, 2007, 12(2): 277-280. |
| [11] | Hareyama M, Oouchi A, Nagakura H, et al. Radiotherapy for Kimura's disease the optimal dosage[J]. Int J Radiat Oncol Biol Phys, 1998, 40(3): 647-651. |
| [12] | Cecen E, Kaar-Döger F, Etensel B. An extremely rare causeof generalized lymphadenopathy in children: Kimura's disease[J]. Turk J Pediatr, 2010, 52(5): 534-537. |
| [13] | 林沁, 庄永泽, 陈淑娇. Kimura病1例报告(附文献复习)[J]. 福州总医院学报, 2011, 18(1): 62-63. |
| [14] | Urbano TG, Clark CH, Hansen VN, et al. Intensity modulated radiotherapy (IMRT) in locally advanced thyroid cancer: acute toxicity results of a phase I study[J]. Radiother Oncol, 2007, 85(1): 58-63. |
| [15] | De Meerleer GO, Fonteyne VH, Vakaet L, et al. Intensity-modulated radiation therapy for prostate cancer: late morbidity and results on biochemical control[J]. Radiother Oncol, 2007, 82(2): 160-166. |
| [16] | Mendenhall WM, Amdur RJ, Palta JR. Intensity modulated radiotherapy in the standard management of head and neck cancer: promises and pitfalls[J]. J Clin Oncol, 2006, 24(17): 2618-2623. |
 2015,Vol. 35
2015,Vol. 35