2. 浙江大学医学院附属第一医院放疗科
对不能完全切除或Masaoka Ⅲ期以上的胸腺瘤患者进行术后放疗能明显降低复发概率并延长患者的生存期,已成为临床的标准治疗方法[1, 2, 3]。IMRT计划一般都使用单一能量(6、10或15 MV)的光子束优化计划[4],而关于混合能量(mixed-energy)光子束放疗计划剂量分布特点及临床应用的报道目前尚少。由于胸腺位于前纵隔,如果射束分别从胸廓的前后体表入射则到达靶区的穿透路径长度差异很大。因此,本研究混合能量光子束计划选择位于人体前方的射野为低能6 MV光子束,反之位于人体后方的射野则选择10 MV高能光子束,即在特定的机架角度上使用不同能量的光子束设计IMRT计划,并分别与单能光子束IMRT计划比较进行剂量学统计分析,以期能为临床制定合适的放疗计划提供参考。
1. 研究对象:随机选取2012年9月至2014年10月本院12例浸润型胸腺瘤术后行放射治疗的患者,Masaoka Ⅲ期,病理类型为上皮细胞或混合型,其中,男性7例,女性5例,年龄35~64岁,中位年龄54岁。
2. CT图像的获取及靶区与重要器官的勾画:所选取的12例浸润型胸腺瘤术后患者均使用热塑膜固定,仰卧位平躺在CT模拟机(德国西门子公司)上行定位扫描,图像重建层厚、层间隔均为3 mm。获得的重建图像传输到Eclipse 11.0计划系统,由医生在CT图像上勾画瘤床边缘外10 mm为临床靶体积(CTV),前后左右方向外放7 mm、上下方向外放10 mm生成计划靶体积(PTV)。使用计划系统自动勾画功能生成身体轮廓(Body),手动勾画心脏、左肺、右肺、脊髓等危及器官(OAR)。脊髓外扩5 mm定义为脊髓计划危及区(planing risk volume of spinal cord,PRV Cord),Body减去PTV定义为健康组织(Health Tissue),为便于计划优化分别定义80%、60%处方剂量的剂量限制环结构。
3. 计划设计:使用Varian Eclipse 11.0治疗计划系统行IMRT计划的制定,治疗设备选取配备60对叶片多叶准直器的Trilogy直线加速器(美国瓦里安公司),每个病例分别使用6、10 MV及混合6/10 MV的光子束能量进行计划设计及优化,3种计划均采用固定机架角调强计划(FF-IMRT)共面4野,入射角分别为320°、0°、40°和180°。在混合能量IMRT计划中,由于从后面入射的180°射野从体表到达PTV穿透路径长,故选择10 MV的光子束,6 MV光子束则应用于人体前面的3个机架角度上(图 1)。因为本研究是一剂量学分析研究,所以在优化时对12例患者的计划靶区均给予60 Gy的处方剂量,实际治疗剂量由临床医师根据病理分型调整处方剂量。优化时PTV与危及器官的剂量体积主要约束条件如下:PTV的V60≥98%且V66≤2%;双肺V20≤35%,V5≤60%;心脏V30≤40%;脊髓外放5 mm的PRV cord结构,剂量约束为D1cc≤45 Gy;Body的最大剂量 Dmax≤66 Gy。3组计划除了光子束能量外其余参数及优化条件均相同。所有的计划在优化完成后使用滑窗(sliding window)技术及各向异性分析算法(anisotropic analytical algorithm,AAA)3 mm网格进行剂量计算,PTV剂量归一在98%的PTV体积满足处方剂量。
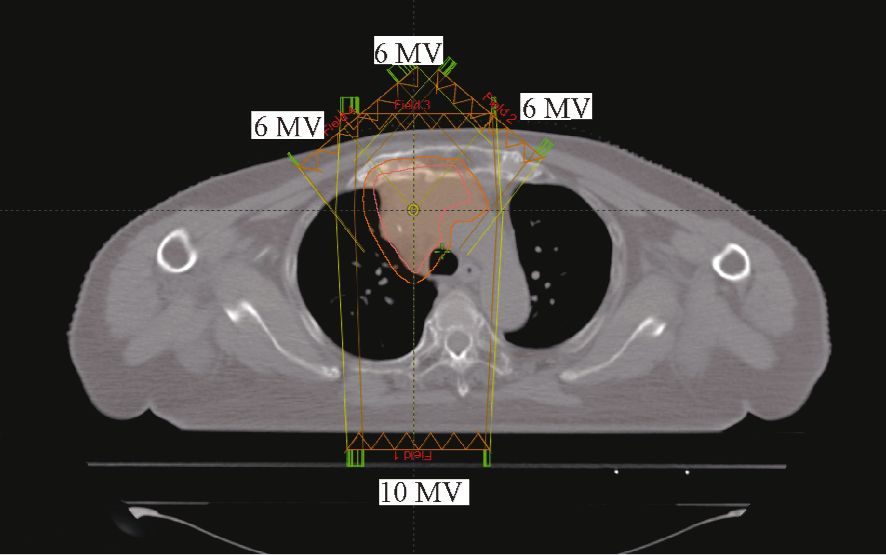 |
图 1 混合能量计划射野示意图 |
4. 剂量体积分析:对每一患者3种放疗计划的靶区及危及器官都使用剂量体积直方图(DVH)来进行分析。参考ICRU 83号报告,对于PTV采用D2%为近似最大剂量,D98%为近似最小剂量。另外,使用适形指数(CI)及均匀指数(HI)评估靶区的剂量分布,计算方法参考RTOG 0921报告的标准,其中HI=(D2%-D98%)/D50%,CI=TVRI2/TV×VRI。公式中Dn%是指n%的PTV体积所接受的剂量,TVRI为处方剂量线覆盖的靶区体积,TV为靶区体积,VRI为受到处方剂量照射的体积。其中,HI的值为越接近0越好,CI的值为越接近1越好。对于双肺使用V5、V10、V20、V30和Dmean等参数评估其受量;使用平均剂量Dmean、V30、V40指标评估心脏受量;D1cc评估脊髓和脊髓外放5 mm的剂量;健康组织用V5、V10、V20评估其受量。同时统计3种计划的总机器跳数(MU)。
5. 统计学处理: 数据以x±s表示。采用SPSS 19.0软件对6和10 MV以及混合光子束能量的3种计划的参数比较行配对t检验,P<0.05为差异有统计学意义。1. PTV剂量及MU:靶区近似最大剂量D2%只有6 MV和混合能量光子束计划差异有统计学意义,且混合能量光子束略优(t=3.107,P<0.05);6 MV光子束HI大于混合能量光子束计划,差异有统计学意义(t=2.924,P<0.05);而CI两者之间差异均有统计学意义(t=7.584,P<0.05),其中10 MV计划最优,6 MV适形度最差,混合能量介于两者之间。对MU两两比较,差异均有统计学意义(t=3.453、-2.927,P<0.05),其中10 MV和混合能量光子束计划的MU数明显低于6 MV计划,见表 1。
|
|
表 1 不同能量计划PTV的剂量及机器跳数MU统计比较(x±s) |
2. 危及器官剂量体积:3种计划OAR的剂量体积参数均达到临床要求,混合能量光子束计划与6及10 MV的计划相比,对减少双侧肺的受照剂量有一定的优势,双肺V5指标与6 MV比较,差异有统计学意义(t=11.364,P<0.05);双肺V10指标 6和10 MV与混合能量光子束计划比较,差异有统计学意义(t=9.726、6.365,P<0.05);双肺V20指标 6和10 MV与混合能量比较,差异有统计学意义(t=6.702、5.175,P<0.05);双肺V30指标 6 MV与混合能量光子束计划比较,差异无统计学意义,10 MV与混合能量光子束计划比较,差异有统计学意义(t=6.216,P<0.05);双肺平均剂量Dmean 在6或10 MV与混合能量光子束计划比较,差异有统计学意义(t=3.711、1.218,P<0.05)。心脏V30和平均受量Dmean参数6和10 MV与混合能量光子束计划的结果比较,差异无统计学意义,但心脏的V40参数混合能量光子束计划小于10 MV,差异有统计学意义(t=3.653,P<0.05),见表 2。
|
|
表 2 不同能量计划双肺及心脏剂量体积比较(x±s) |
脊髓剂量在3种计划中统计D1cc和Dmean,Dmean参数10 MV计划的大于混合能量光子束计划(t=0.928,P<0.05)。脊髓外放5 mm结构D1cc 6和10 MV及混合能量光子束调强计划结果相近,差异无统计学意义。健康组织(Health Tissue)的V5参数6和10 MV大于混合能量光子束计划,差异有统计学意义(t=6.263、4.971,P<0.05);V10、V20参数混合能量光子束计划优于单能计划,差异有统计学意义(t=7.135、5.244、4.040、-0.311,P<0.05,表 3)。
|
|
表 3 不同能量计划脊髓及健康组织剂量体积比较(x±s) |
传统三维适形放疗计划对每一射束的强度不进行调制,所以剂量的分布依赖于射束角度和能量的选择。低能光子线(≤6 MV)由于穿透力有限,一般用于距离体表比较近的肿瘤,而高能光子束(≥6 MV)穿透力强,则被用于治疗位于深部的肿瘤。但随着IMRT技术在临床的上的广泛应用,若射野的数量足够多则能量的选择对于剂量分布的影响较小[5]。已有一些关于胸腺瘤术后不同放疗技术计划剂量学的研究报道[6, 7]。也有学者研究了混合光子束能量的物理特性及临床应用可行性[8],关于调强放疗技术及射束能量的选择对于靶区及正常器官剂量学分析也有较多的文献报道[9, 10],但极少有关于胸腺瘤混合能量光子束计划剂量学的报道。
从统计结果来看,6和10 MV与混合能量光子束IMRT计划在剂量学方面均能达到临床的要求,PTV靶区剂量的近似最大值D2%参数,混合光子束计划优于6 MV单能光子束的计划,但劣于10 MV单能光子束计划。理论上低能光子束具有较小的半影,可在靶区周围容易形成包绕程度好的剂量分布,并可减少与靶区相邻OAR的受照剂量,具有较好的CI和HI,但会在靠近射束入射的区域产生高剂量[5, 11]。在本研究统计的结果中适形指数10 MV计划最优,6 MV最差,混合能量则介于两者之间。均匀指数6 MV调强计划差于混合能量计划,且两者差异有统计学意义。这一结果与前述文献的报道并不一致,一个可能的原因是高能光子束比低能光子束具有更强的穿透能力,对于浅表的组织来说高能光子束具有更少剂量沉积的特点,这一特性对位于瘤床前面的皮肤及周围其他正常组织的保护是有利的。另外一个可能的原因是,位于人体正后方180°机架角的射野若选择6 MV能量,则射束从胸廓后面的体表入射在到达靶区前的穿透路径很长,而低能光子相比高能光子束在给予靶区相同剂量的同时,在经过路径中会沉积更多的能量[12]。3组计划MU之间差异也较大,6 MV计划比10 MV计划约增加10%,与混合能量计划相比也约增加了4%。双侧肺的剂量体积参数各种类型计划之间大部分的差异有统计学意义,如前所述,由于胸腺瘤位置的特殊性,计划设计时应充分考虑减少两肺低剂量的受照体积,所以射野的数量和角度受到限制[13],因此,本研究中IMRT计划在胸廓前方设计三野并且尽量合理地缩小射野的夹角,另外在正后方仅给予180°的射野,以期最大程度地减少射束穿过双肺的体积。心脏体积剂量指标6 MV。健康组织(Health Tissue)的V5参数6及10 MV的计划均大于混合光子束计划且差异有统计学意义,这对于现在越来越重视照射体积内辐射二次致癌的风险具有积极的临床价值[14]。
综上所述,对于浸润型胸腺瘤术后放疗的患者,混合光子束能量IMRT计划如果合理选择射野角度和射野数量,并依据射野角度观测皮肤到治疗靶区的深度选择不同的光子束能量,可充分利用低能及高能光子束的不同特点,总体上可以改善IMRT计划的质量,具有一定的临床参考价值。
| [1] | Mayer R,Beham-Schmid C,Groell R,et al. Radiotherapy for invasive thymoma and thymic carcinoma. Clinicopathological review[J]. Strahlenther Onkol,1999,175(6):271-278. |
| [2] | Fan C,Feng Q,Chen Y. Postoperative radiotherapy for completely resected Masaoka stage Ⅲ thymoma:a retrospective study of 65 cases from a single institution[J]. Radiat Oncol,2013,8(1):199-206. |
| [3] | 李洪选,吕长兴,刘俊,等. 胸腺瘤术后放疗疗效与WHO组织学分型和Masaoka分期相关性分析[J]. 中华放射肿瘤学杂志,2009,18(5):386-389. |
| [4] | Hartford AC,Galvin JM,Beyer DC,et al. American College of Radiology (ACR) and American Society for Radiation Oncology (ASTRO) practice guideline for intensity-modulated radiation therapy(IMRT)[J]. Am J Clin Oncol,2012,35(6):612-617. |
| [5] | Pirzkall A,Carol MP,Pickett B,et al. The effect of beam energy and number of fields on photon-based IMRT for deep-seated targets[J]. Int J Radiat Oncol Biol Phys,2002,53 (2):434-442. |
| [6] | Komaki R,Gomez DR. Radiotherapy for thymic carcinoma: adjuvant,inductive,and definitive[J]. Front Oncol,2014,3:330-335. |
| [7] | 刘路,杨瑞杰,李金娜,等. 胸腺瘤术后调强放射治疗和容积弧形调强放射治疗剂量学分析[J]. 生物医学工程与临床,2014,1:20-27. |
| [8] | 单国平,严英师. 混合射线束的百分深度剂量分布[J]. 中华放射医学与防护杂志,2003,23(5):370-371. |
| [9] | Woudatra E,Heijimen BJ,Storchi PR. Automated selection of beam orientations and segmented intensity modulated radiotherapy (IMRT) for treatment esophagus tumors[J]. Radiother Oncol,2005,77(3):254-261. |
| [10] | Park JM,Choi CH,Ha SW,et al. The dosimetric effect of mixed-energy IMRT plans for prostate cancer[J]. J Appl Clin Med Phys,2011,12(4):147-157. |
| [11] | Park JM,Kim JI,Choi CH,et al. Photon energy-modulated radiotherapy: monte carlo simulation and treatment planning study[J]. Med Phys,2012,39 (3):1265-1277. |
| [12] | Followill DS,Nusslin F,Orton CG. Point/counterpoint: IMRT should not be administered at photon energies greater than 10 MV[J]. Med Phys,2007,34 (6):1877-1879. |
| [13] | Rosca F,Kirk M,Soto D,et al. Reducing the low-dose lung radiation for central lung tumors by restricting the IMRT beams and arc arrangement[J]. Med Dosim,2012,37(3):280-286. |
| [14] | Amemiya K,Shibuay H,Yoshimura R,et al. The risk of radiation-induced cancer in patients with squamous cell carcinoma of the head and neck and its results of treatment[J]. Br J Radiol,2005,78(935):1028-1033. |
 2015,Vol. 35
2015,Vol. 35