宫颈癌患者如果具有不良预后因素,术后辅助治疗常采用同步放化疗,除放射性肠炎及放射性膀胱炎等不良反应外,骨髓抑制常常成为治疗中较严重的并发症,使得治疗中断或无法继续治疗,进而影响到患者的疗效。因此,保护骨髓功能(bone marrow sparing,BMS),减轻骨髓抑制程度,成为盆腔精确放疗的重要任务[1, 2]。调强放疗(IMRT)在提高靶区剂量的同时,能显著降低正常组织的剂量,减轻不良反应[3, 4]。据文献报道,限定骨髓剂量放疗计划(BMS-IMRT)和IMRT计划相比,提高了靶区适形度,危及器官受量没有增加,而且使骨髓低剂量受照体积减小,利于降低骨髓抑制的程度及发生率[5]。本研究观察宫颈癌术后分别行BMS-IMRT计划与IMRT计划同期放化疗患者的近期疗效及不良反应,比较二者的差异。
1. 入组标准:宫颈癌术后患者,手术方式为广泛子宫切除+盆腔淋巴结清扫术,术中无肉眼残存;KPS评分≥70;均有术后病理诊断;术后分期为Ⅰ~Ⅱa期,且具有下列不良预后因素之一[宫旁浸润、切缘阳性、淋巴结转移、宫颈局部肿瘤体积巨大(≥4 mm)、脉管瘤栓、宫颈肌层浸润深度≥外1/3等];术前未做新辅助化疗。
2. 一般临床资料:2011年1月至2012年6月在本院手术的宫颈癌患者70例,应用抽签法随机分为限定骨髓剂量组(BMS-IMRT组)34例及非限定骨髓剂量组(IMRT组)36例。年龄27~65岁,中位年龄37岁;KPS评分100、90、80分别为15、35、11例。术后病理为鳞状细胞癌64例,腺癌6例。术后分期Ⅰ期49例,Ⅱa期21例。具备1~2项高危因素者46例,具备3项高危因素者18例,具备4项高危因素者3例,具备5项以上高危因素者3例。所有患者均符合入组标准。本研究通过医院伦理委员会批准,患者签署知情同意书。
3. 治疗方法:给予强化CT模拟定位,定位前口服复方泛影普胺20 ml+温水800 ml充盈小肠和膀胱,定位图像传至荷兰飞利浦Pinnacle 9.6计划系统,勾画治疗靶区,设计逆向IMRT计划。靶区勾画范围:CTV为髂总、髂外、髂内、闭孔、骶前淋巴引流区及宫旁、阴道上1/3及残端;PTV为CTV头脚方向外放1.0 cm,前后左右外放0.5 cm,处方剂量95%PTV 45 Gy/25次,1.8 Gy/次,5次/周。限定骨髓剂量组勾画骨盆(包括腰骶骨、髂骨、坐骨、耻骨、股骨上段及双侧股骨头),并给予单独限量:骨盆V30≤50%(V30为接受30 Gy剂量照射的体积百分比)。IMRT组骨盆不给予限定剂量。两组患者其他危及器官限量为:膀胱V40≤50%,直肠V40≤50%,小肠Dmax≤50 Gy,V30≤30%。化疗自放疗第1天开始,单药顺铂(40 mg/m2),第1、8、15、22、29天。
4. 靶区及危及器官参数比较:靶区分析指标为均匀指数(HI)和适形指数(CI),HI=D5/D95,D5指靶区5%的PTV的剂量, D95指靶区95%的PTV的剂量。CI=VPTV/VI,VPTV为靶区PTV的体积,VI指PTV内最低剂量的等剂量线所包绕的体积。
5. 近期疗效及不良反应评价标准:治疗期间每周查血常规,评价患者血液学不良反应,并观察泌尿系统及消化系统症状。放疗后1年内每3个月、1年以后每6个月复查盆腔强化CT及胸片、腹部B超检查,全面评价患者情况,统计2年局部控制率及生存率。不良反应按照美国肿瘤放射治疗协作组(RTOG)急性放射损伤评价标准(1995)。
6. 随访:生存及复发时间从放疗之日起计算至事件发生日。随访截止到2014年6月,随访时间6~24个月,中位随访时间19个月,随访率97%。
7. 统计学处理:结果用x±s表示。使用SPSS 17.0软件分析,两组计划剂量比较行配对t检验,近期疗效及不良反应比较用χ2检验。P<0.05为差异有统计学意义。
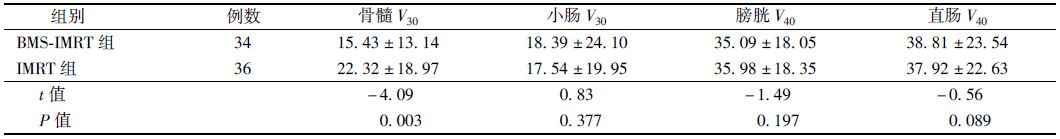
1. 靶区及危及器官参数比较:IMRT组HI优于BMS-IMRT组(0.98±0.04 vs. 1.21±0.01,t=6.50,P<0.05),而BMS-IMRT组CI优于IMRT组(0.72±0.09 vs.0.67±0.11,t=3.61,P<0.05)。BMS-IMRT组骨髓V30低于IMRT组,差异有统计学意义(t=-4.09,P<0.05)。而小肠、膀胱、直肠的剂量体积参数差异无统计学意义。两组危及器官的剂量和受照体积参数见表 1。
|
|
表 1 两组危及器官的剂量和受照体积参数比较(%,x±s) |
2. 近期疗效:IMRT组有3例因出现3级骨髓抑制,未完成化疗。随访2年患者全部生存,生存率100%,2年局部控制率:BMS-IMRT组:88.2%(30/34),IMRT组:88.9%(32/36),两组差异无统计学意义。
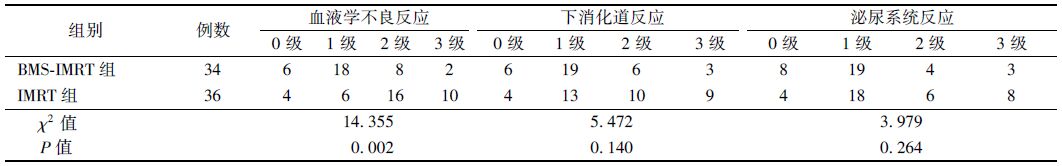
3. 不良反应:BMS-IMRT组血液学不良反应比IMRT组轻,且差异有统计学意义(χ2=14.355,P<0.05)。下消化道反应及泌尿系统不良反应,BMS-IMRT组和IMRT组相比,差异无统计学意义,见表 2。
|
|
表 2 两组患者不良反应比较(例) |
宫颈癌是常见的妇科肿瘤,早期患者单纯根治性手术与单纯根治性放疗疗效相当。但有不良预后因素的患者预后仍较差,术后同步放化疗能够较单纯放疗及单纯手术提高疗效,改善患者的生存率[6, 7],故术后同步放化疗成为宫颈癌术后具有不良预后因素患者的标准治疗。常用的方法为全盆腔照射联合铂类为基础的化疗,而顺铂单药周疗为常用化疗方案[8]。
以往术后同步放化疗常用的放疗技术为:盆腔对穿照射或盆腔四野盒式照射,这两种照射技术受到盆腔内膀胱、直肠、部分小肠的剂量限制,不良反应重,放疗剂量难以提高,因而局部控制率较低。随着三维适形放疗技术的开展,特别是调强适形放疗技术在临床的广泛应用,靶区的剂量分布更为优化,正常组织的剂量明显降低。2012年美国国立综合癌症网络(NCCN)宫颈癌指南中文版指出:对于接受子宫切除以及需要接受腹主动脉旁淋巴结放疗的患者,调强放疗技术有助于减少肠管及其他正常组织的放疗剂量。多项研究结果表明,应用调强放疗技术能够降低宫颈癌患者的正常组织损伤[9]。
宫颈癌患者术后同步放化疗的血液学不良反应比放射性膀胱炎、放射性肠炎等其他不良反应更为明显[10],临床上3~4级的血液学不良反应常使得治疗中断或无法继续治疗,有可能影响到患者的预后,因此,运用IMRT技术的剂量学优势,对骨髓功能进行保护,以减轻同步放化疗的不良反应是目前研究的热点问题。骨髓低剂量照射是造成急性骨髓抑制的主要原因[11, 12, 13],化疗也可以造成骨髓的急、慢性损伤,两种治疗方法联合,骨髓抑制程度明显增加。剂量学研究证明,宫颈癌同期放化疗时,≥2级的血液学不良反应与骨髓的V10≥90%、V20≥5%显著相关,而且宫颈癌IMRT中,当骨髓的V10≥90%时,2级中性粒细胞下降为32.0%,V10<90%时为5.6%[11, 14]。放疗引起的骨髓损伤除了与低剂量照射体积有关外,还与实际照射的剂量相关[15, 16],骨髓受照剂量>30 Gy时会出现完全的增生不良,骨髓功能长期不能恢复。从剂量学上讲,BMS-IMRT可以做到在保证靶区均匀性和适形度的前提下,降低骨髓的低剂量照射体积,从而降低急性骨髓抑制的发生率[5]。成年人主要的造血活性骨髓分布在腰骶部,占全身造血骨髓的50%以上[17]。在70例患者的放疗计划中,限定膀胱、直肠、小肠剂量的同时,对患者骨盆的剂量加以限制(V30<50%),结果表明,BMS-IMRT组的均匀性不如IMRT组,适形度明显优于IMRT组。IMRT组患者骨髓V30为(22.32+18.97)%,与BMS-IMRT组相比,骨髓受低剂量照射体积增加,差异具有统计学意义,且IMRT组的血液学不良反应较BMS-IMRT组增加,这与文献报道是一致的[5]。危及器官的剂量体积参数,小肠的V30、膀胱V40、直肠V40两组差异无统计学意义。张富利等[5]比较了BMS-IMRT和IMRT计划中,骨髓、小肠、膀胱及直肠的V10、V20、V30、V40等指标,认为两种计划差别不大。以上表明对骨髓单独限量以后,靶区的适形度得到提高,危及器官的受量没有显著的影响。临床随访结果显示,两组患者2年的局部控制率、生存率差异无统计学意义。血液学不良反应BMS-IMRT组较IMRT组明显减轻,IMRT组3例患者因重度骨髓抑制未完成化疗。而下消化系统反应及泌尿系统反应差异无统计学意义。以上结果与剂量学研究结果是一致的[18]。
通过该临床观察可以看出,BMS-IMRT确实降低了患者的血液学不良反应,而近期疗效与其他不良反应与常规IMRT无差别。因该组观察病例数较少,且随访时间短,需继续扩大样本量,延长随访时间,有可能在长期生存上得出阳性结果。另外,造血活性骨髓区域问题还需要应用更先进的方法来确定,而且应当进行多中心的研究,得出更高级别的证据,有望于BMS-IMRT在宫颈癌术后放疗中得到广泛应用,以提高患者的远期生存。
| [1] | 李斌,安菊生,吴令英,等.子宫颈癌术后盆腔不同体外照射方法的剂量学研究[J]. 中华放射肿瘤学杂志,2008,17(5):211-215. |
| [2] | Mell LK, Tiryaki H, Ahn KH, et al. Dosimetric comparison of bone marrow-sparing intensity-modulated radiotherapy versus conventional techniques for treatment of cervical cancer[J]. Int J Radiat Oncol Biol Phys,2008,71(5):1504-1510. |
| [3] | Brixey CJ, Roeske JC, Lujan AE, et al. Impact of intensity-modulated radiotherapy on acute hematologic toxicity in women with gynecologic malignancies[J]. Int J Radiat Oncol Biol Phys,2003,54(5):1388-1396. |
| [4] | Mundt A, Lujan AE, Rotmensch J, et al. Intensity-modulated whole pelvic radiotherapy in women with gynecologic malignancies[J]. Int J Radiat Oncol Biol Phys,2002,52(5):1330-1337. |
| [5] | 张富利,陈静,陈建平,等. 宫颈癌术后盆腔调强放疗计划方法的剂量学比较研究[J]. 中华放射肿瘤学杂志,2010,19(1):37-39. |
| [6] | Kim K, Kang SB, Chung HH, et al. Comparison of chemoradiation with radiation as postoperative adjuvant therapy in cervical cancer patient with intermediate-risk factors[J]. Eur J Surg Oncol,2008,35(2):192-196. |
| [7] | Fabrini MG, Gadducci A, Perrone F, et al. Clinical outcome of tailored adjuvant postoperative chemoradiotherapy in IB FIGO stage cervical cancer[J]. Anticancer Res,2009,29(10):4205-4210. |
| [8] | Takeshita S, Kita T, Motoike Y, et al. Postoperative concurrent chemoradiotherapy for the high-risk uterine cervical cancer[J]. J Obstet Gynaecol Res,2010,36(5):1009-1014. |
| [9] | Chen MF, Tseng CJ, Tseng CC, et al. Clinical outcome in posthysterectomy cervical cancer patients treated with concurrent Cisplatin and intensity-modulated pelvic radiotherapy: comparison with conventional radiotherapy[J]. Int J Radiat Oncol Biol Phys,2007,67(5):1438-1444. |
| [10] | Song S, Song C, Kim HJ, et al. 20 year experience of postoperative radiotherapy in IB-IIA cervical cancer patients with intermediate risk factors: impact of treatment period and concurrent chemotherapy[J]. Gynecol Oncol,2012,124(1):63-67. |
| [11] | Mell LK, Kochanski JD, Roeske JC, et al. Dosimetric predictors of acute hematologic toxicity in cervical cancer patients treated with concurrent cisplatin and intensity-modulated pelvic radiotherapy[J]. Int J Radiat Oncol Biol Phys,2006,66(5):1356-1365. |
| [12] | Mell LK, Schomas DA, Salama JK, et al. Association between bone marrow dosimetric parameters and acute hematologic toxicity in anal cancer patients treated with concurrent chemotherapy and intensity-modulated radiotherapy[J]. Int J Radiat Oncol Biol Phys,2008,70(5):1431-1437. |
| [13] | Giangreco DT, Albuquerque K, Norton J, et al. Predictors of hematologic toxicity and implications for bone-marrow sparing pelvic IMRT for cervical cancer[J]. Int J Radiat Oncol Biol Phys,2007,69(3):399. |
| [14] | Rose BS, Liang Y, Lau SK, et al. Correlation between radiation dose to 18F-FDG-PET defined active bone marrow subregions and acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys,2012,83(4):1185-1191. |
| [15] | Sacks EL, Goris ML, Glatstein E, et al. Bone marrow regeneration following large field radiation: influence of volume, age, dose, and time[J]. Cancer,1978,42(3):1057-1065. |
| [16] | Scarantino CW, Rubin P, Constine LS 3rd. The paradoxes in patterns and mechanism of bone marrow regeneration after irradiation.1.Different volumes and doses[J]. Radiother Oncol,1984,2(3):215-225. |
| [17] | 王健仰,金晶. 限定骨髓剂量的调强放疗对减轻同期放化疗急性血液毒性的研究进展[J].中华放射肿瘤学杂志,2013,22(4):329-332. |
| [18] | 孙帅,张福泉,胡克,等. 宫颈癌术后调强放疗同期化疗临床分析[J]. 中华放射肿瘤学杂志,2013,22(1):13-16. |
 2015,Vol. 35
2015,Vol. 35