研究证实,沙利度胺可以抑制肿瘤血管内皮生长因子(vascular endothelial growth factor,VEGF)和碱性纤维细胞生长因子(bFGF)的分泌,并具有免疫调节、抗肿瘤增生和转移的作用。本课题组在2012年的研究中发现沙利度胺能够降低食管癌患者放疗过程中血清VEGF的表达水平,联合治疗不仅能提高患者近期放疗的有效率,而且能改善患者的生活质量,增加治疗的顺应性[1]。在前期研究的基础上,本研究对81例食管癌患者继续随访,进一步研究沙利度胺干预对食管癌患者放疗后的长期生存的影响。
1.临床资料:2009年7月至2011年3月间经病理证实的在南京大学附属常州市第二人民医院放疗科初治的经病理证实的食管癌患者81例,KPS评分≥80分,因医学原因,无法或拒绝手术。
2.放疗方法:28例患者放疗采用X射线模拟定位机定位,采用一前两后斜3野照射,放射野上下界分别上下各放3~5 cm。前野宽6 cm,后斜野宽4.5~5.5 cm。53例患者采用CT模拟定位,给予三维适形放疗,肿瘤体积(GTV)包括CT显示管壁增厚的食管(并参照食管片和食管镜检查),以及短径≥1 cm的肿大淋巴结;临床靶体积(CTV)为GTV前后左右外放0.5~0.8 cm,上下2.5~3.0 cm及相应的淋巴引流区;计划靶体积(PTV)为CTV外放0.5 cm。处方剂量包括95% PTV,脊髓最大剂量<45 Gy,双肺V20<30%。所有患者采用6 MV X射线,分次剂量为1.8~2.0 Gy,每周5次,总剂量60~72 Gy。
3.VEGF的检测:患者分别于放射治疗前1周内、放疗中3~4周、放疗结束后1周内,抽取外周静脉血2 ml,混匀后于4℃,离心半径为10 cm,3 000 r/min离心10 min。分离出的血清存放在-70℃冰箱保存待测。检查方法采用双抗体夹心ABC-ELISA法按说明书操作。VEGF试剂盒为上海中金公司产品。
4.沙利度胺的给药方式:根据81例食管癌患者放疗3~4周之间检测血清VEGF水平的结果,VEGF水平较放疗前升高或不变的患者在放疗同时予口服沙利度胺,第1周100 mg/d,如果无中度以上不良反应,第2周开始增加至200 mg/d,服至放疗结束,均为晚上睡前服用。VEGF水平较放疗前降低的患者继续原方案放疗。
5. 患者情况及分组:81例食管癌患者,年龄40~79岁,详细分组见表 1。根据放疗中血清VEGF水平,32例患者的放疗中血清VEGF表达水平较放疗前高为用药组,另49例患者的放疗中血清VEGF表达水平较放疗前低为未用药组。用药组中,使用沙利度胺干预后患者放疗后血清VEGF水平较放疗中降低组共20例,较放疗中升高组12例。
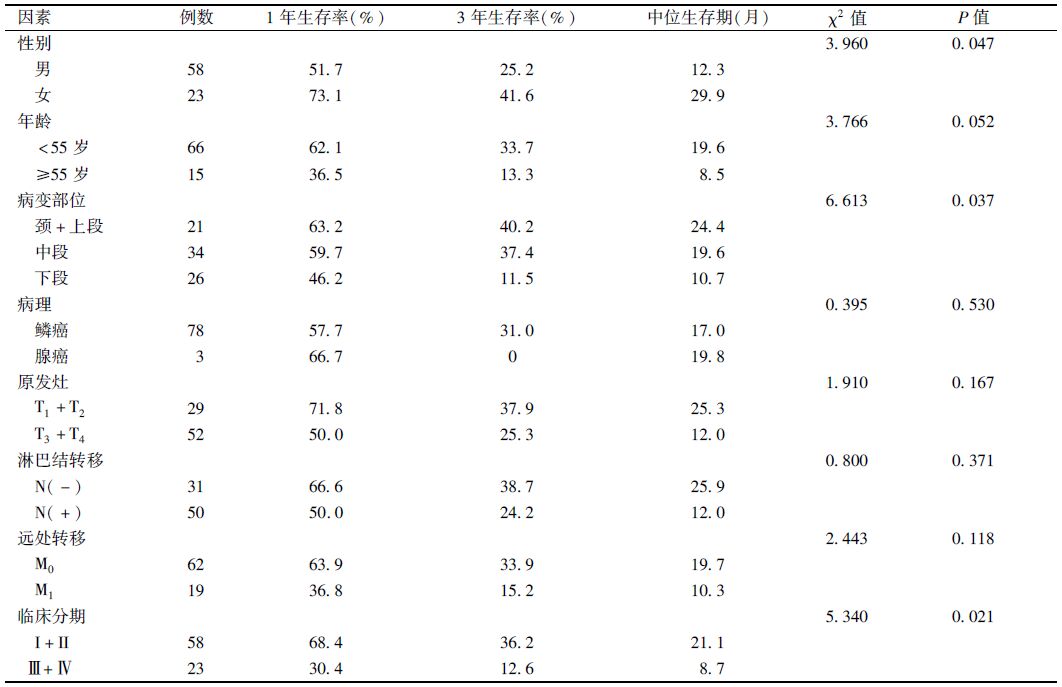
|
|
表 1 单因素分析81例患者临床特征和总生存率的关系 |
6.随访和统计学处理:随访时间至2014年11月30日,全部患者均满3年,随访率100%。采用SPSS 16.0软件统计分析,生存率等的计算采用Kaplan-Meier法并Log-rank检验及单因素分析,多因素分析采用Cox比例风险模型并用Forward:Wald刷选法评估独立预后因素。P<0.05为差异有统计学意义。
1. 沙利度胺联合放疗对食管癌患者长期生存的影响:用药组和未用药组的中位生存期分别为17.0个月和18.7个月。其1、3年生存率分别为59.4%、31.5%和56.4%、28.6%;两组OS比较,差异无统计学意义;两组PFS比较,差异无统计学意义。
2. 下调血清VEGF表达后对食管癌患者长期生存的影响:用药组在放疗后血清VEGF水平较放疗中降低20例,升高12例。降低组与升高组的中位生存期分别为19.7个月和10.7个月,1、3年生存率分别为65.0%、42.1%和43.3%、8.3%;两组OS比较,差异有统计学意义(χ2=4.345,P<0.05)。两组PFS比较,差异有统计学意义(χ2=4.157,P<0.05),见图 1。
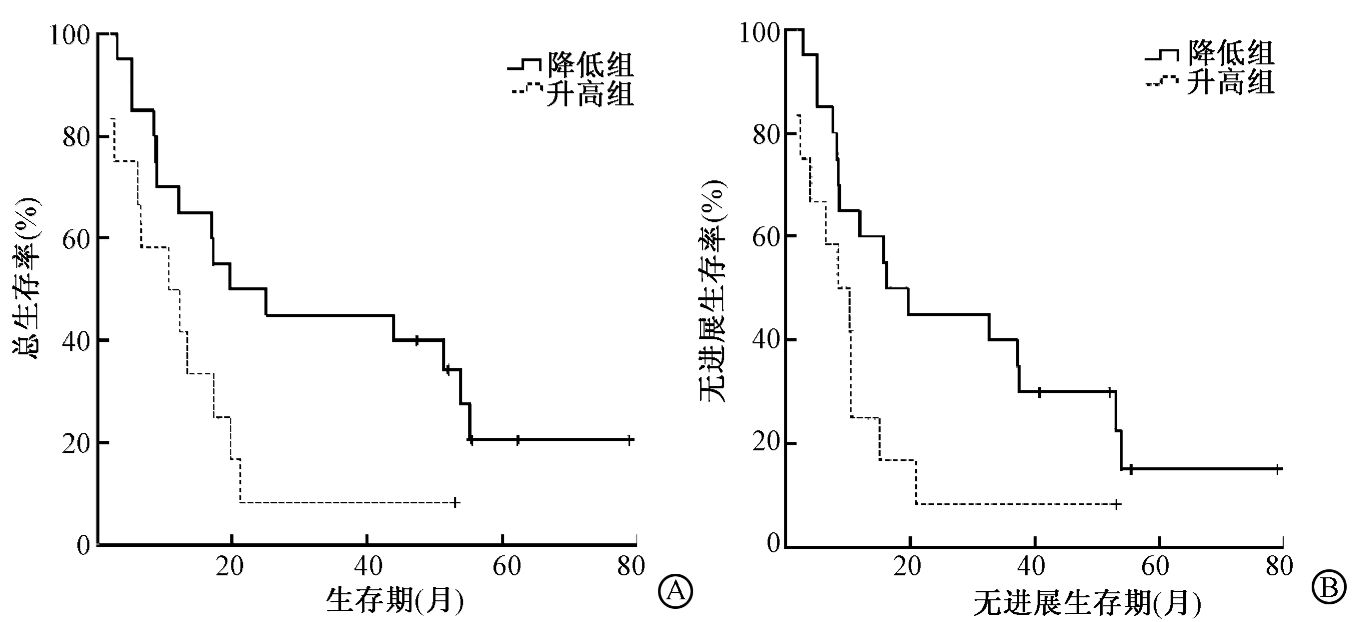 |
图 1 两组总生存率和无进展生存率的比较 A.总生存率;B.无进展生存率[ |
3. 81例食管癌患者的预后分析:单因素分析显示,性别、病变部位及临床分期对患者总生存期的影响,差异有统计学意义(χ2=3.960、6.613、5.340,P<0.05),见表 1。年龄、病理、原发灶、淋巴结转移及远处转移对患者总生存率的影响,差异无统计学意义。
将上述可能影响预后的因素进行Cox回归多因素分析,临床分期是总生存率的独立预后因素,性别、病变部位对患者预后没有影响,见表 2。
|
|
表 2 Cox回归多因素分析81例患者的各因素对总生存率的影响 |
放、化疗联合治疗是中晚期食管癌的主要治疗手段,然而对于那些难以耐受放、化疗结合的食管癌患者,耐受性较好的单纯放疗仍然是最佳的选择。目前如何提高放疗疗效,降低复发转移率,减轻不良反应,延长总生存率,是食管癌临床研究的重点。
VEGF即血管内皮生长因子,在肿瘤的发生发展中起至关重要的作用。肿瘤放射治疗的敏感性与肿瘤组织中的VEGF表达呈负相关[2],肿瘤的持续增殖呈乏氧状态,从而对放疗产生抗拒。本课题在前期研究中也发现食管癌患者的血清VEGF水平高于健康人群,且放疗中VEGF水平高的食管癌患者放疗近期疗效较差[3]。提示血清VEGF升高的肿瘤组织对放疗不敏感,导致放疗后复发的可能性增高。食管癌治疗失败的主要原因是复发,80%的复发发生在治疗后的两年内[4]。本研究认为沙利度胺是通过降低VEGF的表达,增加肿瘤的放疗敏感性,从而增加放疗疗效。另有学者根据多项Meta分析发现VEGF高表达的亚洲食管癌患者的生存期明显缩短[5, 6]。本研究发现,对于放疗中血清VEGF升高的食管癌患者使用沙利度胺干预后其OS及PFS与放疗中血清VEGF降低的患者比较,差异无统计学意义。结果进一步证实了前期对于沙利度胺可能通过降低血清VEGF水平,从而提高食管癌患者的生存期的假设。且在使用沙利度胺干预的用药组中,本研究结果显示,用药后VEGF水平降低的食管癌患者较继续升高的患者的总生存率及无进展生存率都高。这可能与一部分患者对沙利度胺耐药,用药后未能降低血清VEGF水平有关。
近年来,对于放疗联合VEGF抑制剂及放疗治疗食管癌的研究已有报道,但研究使用的VEGF抑制剂主要是传统抗血管生成药物,如贝伐单抗(Avastin)及恩度(Endontain)等。如樊锐太等[7]发现,恩度联合放化疗治疗局部中晚期食管癌疗效显著。Stewart [8]报道沙利度胺的抗肿瘤作用与一种名为cereblon的蛋白质有关,当沙利度胺与该蛋白结合后能够泛素化和降解B细胞和T细胞发育所必需的转录调控因子Ikaros与Aiolos,从而激活免疫系统(T细胞所产生的IL-2增加,从而刺激免疫应答反应)的同时,又减弱B细胞功能。而近期研究发现VEGF在肿瘤中有免疫抑制的作用,因其与IL-12低表达,抑制树突状细胞(DC)的成熟及降低自然杀伤性细胞,增加调节性T细胞有关。自然杀伤性T细胞在抗肿瘤中起着极其重要的作用[9, 10, 11, 12]。因此,在联合治疗中,沙利度胺可能与传统的VEGF抑制剂不同,它不仅能通过降低血清VEGF从而增加放疗敏感性的作用,而且在刺激自然杀伤性T细胞抗肿瘤中也起着重要作用。
在对食管癌患者的预后分析中显示,临床分期是总生存率的独立预后因素,性别、病变部位、病理对患者预后没有统计学意义。这与Shirai等[13]的研究结果一致。
综上所述,沙利度胺能够降低放疗中食管癌患者的血清VEGF水平,联合放疗能够增加其远期疗效,且对于用药后VEGF水平降低患者效果更好。且与传统的贝伐单抗及恩度相比,沙利度胺更经济实惠。然而,对于联合治疗的适用人群,以及沙利度胺的耐药机制,仍需进一步探讨。
| [1] | 于静萍,孙志强,倪新初,等. 沙利度胺联合放疗治疗食管癌的临床观察[J].中华放射医学与防护杂志,2012, 32(4):369-373. |
| [2] | Sekis I, Gerner W, Willmann M,et al. Effect of radiation on vascular endothelial growth factor expression in the C2 canine mastocytoma cell [J]. Am J Yet Res, 2009, 70(9):1141-1150. |
| [3] | 于静萍,孙志强,倪新初,等, 食管癌患者放疗前后血清血管内皮生长因子变化的临床意义[J]. 中华放射医学与防护杂志, 2011, 31(6):671-674. |
| [4] | Nieman DR, Peters JH. Treatment strategies for esophageal cancer[J]. Gastroenterol Clin North Am, 2013, 42(1):187-197. |
| [5] | Peng J, Shao N, Peng H, et al. Prognostic significance of vascular endothelial growth factor expression in esophageal carcinoma: a meta-analysis[J]. BUON, 2013, 18(2):398-406. |
| [6] | Xu XL, Ling ZQ, Chen W, et al. The overexpression of VEGF in esophageal cancer is associated with a more advanced TMN stage: a meta-analysis[J]. Cancer Biomark, 2013, 13(2):105-113. |
| [7] | 樊锐太,刘云,王鑫, 等, 恩度联合放化疗治疗中晚期食管癌的临床观察[J].中国实用医刊,2014, 41(6):13-15. |
| [8] | Stewart AK. How thalidomide works against cancer[J]. Science, 2014, 43(6168):256-257. |
| [9] | Ohm JE, Gabrilovich DI, SemPowski GD, et al. VEGF inhibits T-cell development and may contribute to tumor-induced immune suppression[J]. Blood, 2003, 101(12):4878-4886. |
| [10] | Bellati F, NaPoletano C, GasParri ML, et al. Current knowledge and open issues regarding bevacizumab in gynaecological neoplasms[J]. Crit Rev Oncol Hematol, 2012, 83(1):35-46. |
| [11] | Papamichail M, Perez SA, Gritzapis AD, et al. Natural killer lymphocytes: biology, development and function[J]. Cancer Immunol Immunother, 2004, 53(3):176-186. |
| [12] | Dikov MM, Ohm JE, Ray N, et al. Differential roles of vascular endothelial growth factor receptors 1 and 2 in dendritic cell differentiation[J]. J Immunol, 2005, 174(1):215-222. |
| [13] | Shirai K, Tamaki Y, Kitamoto Y, et al. Prognosis was not deteriorated by multiple primary cancers in esophageal cancer patients treated by radiotherapy[J]. J Radiat Res, 2013, 54(4):706-711. |
 2015,Vol. 35
2015,Vol. 35