2. 清华大学工程物理系
螺旋断层放射治疗(Tomotherapy)集调强和图像引导治疗为一体,利用反向CT成像原理,6 MV高能X射线进行放射治疗,360°旋转使得在人体内可以实现任何剂量分布要求。由于大范围的危及器官和正常组织暴露在照射野内,使得相对靶区较远距离的危及器官和正常组织有更多体积接受低剂量照射[1]。正常肺组织对低剂量敏感,研究证明放射性肺炎的发生与低剂量区体积密切相关,认为对小体积肺给予高剂量照射要优于对大体积肺给予低剂量照射,低剂量-体积参数V5、V10与放射性肺炎的发生密切相关,是放射性肺损伤有效的预测因子之一[2, 3]。临床中制定双肺V5<65%作为正常肺组织的剂量评估指标,已得到国外某些肿瘤放疗中心的认可[4]。本研究通过优化临床中单侧肺内病灶的肺癌Tomotherapy治疗计划,寻求一种临床可行的减少正常肺组织低剂量区体积的治疗计划方案。
1. 临床病例的选择:收集来自本院伽玛刀数据库的30例单侧病灶的肺癌病例,其中,男性17例,女性13例,年龄范围43~81岁,中位年龄65岁。该研究经本院肿瘤医院伦理委员会批准,患者均签订知情同意书。
2. 体位确定与CT定位:所有患者均用真空垫固定,采用西门子16排70 cm孔径螺旋CT扫描,层厚5 mm,扫描范围自锁骨上区域到膈下组织,保全双肺。
3. 靶区和危及器官的勾画:GTV为CT肺窗图像可见的肿瘤轮廓,包括病灶边缘的毛刺,不包括肺不张部分;CTV为GTV均匀外扩5 mm;PTV为CTV前后、左右方向均匀外扩5 mm,头脚方向外扩10 mm。"剂量限制1"为沿健侧肺叶外侧勾画出一定弧度的剂量限制器官,其弧度约为健侧肺外周弧度的1/4,上下边界与靶区PTV边界的范围一致,"剂量限制2"为健侧肺外周弧度的1/2,上下边界与靶区PTV边界的范围一致,危及器官包括气管、食管、脊髓等串行器官,勾画范围要求头脚方向超出PTV 2 cm,并行器官如患侧肺、健侧肺和双肺,并勾画CT图像外轮廓,用于靶区评估参数适形度指数的计算。
4. 治疗计划设计和优化:计划参数设置要求射野宽度为2.5 cm,螺距比为0.287,调制因子为2.5。治疗计划给予PTV处方剂量为70 Gy,要求至少95%的PTV达到处方剂量,脊髓最大剂量<45 Gy,气管最大剂量<45 Gy,食管最大剂量<60 Gy,心脏V50<30%、平均剂量<30 Gy,双肺V20和V5分别<35%和65%,剂量限制1 和 剂量限制2要求最大剂量<5 Gy。每例患者根据方案(表 1)要求设计7组治疗计划。同一例患者CT图像的不同治疗计划,靶区的权重保持一致,正常组织的限制剂量统一,均迭代至200次后停止优化。
|
|
表 1 7组方案的剂量限制器官射线出束类型[ |
5. 剂量参数计算:均匀度用均匀性指数(HI)表示,HI由公式D5/D95得出,其中D5为5%体积的GTV接受的剂量,D95为95%体积的GTV接受的剂量[5];适形度用适形度指数(CI)表示,CI=(Vt,ref/V<t)·(Vt,ref/Vref),其中Vt,ref为参考等剂量线所包绕的靶区体积,Vt为靶区体积,Vref为参考等剂量线包绕的所有区域的体积[6]。
6. 统计学处理:应用Excel 2007软件,数据用x±s表示。Graphpad Prism 5软件进行配对样本均数t检验,对所有数据行单因素方差分析。P<0.05为差异有统计学意义。
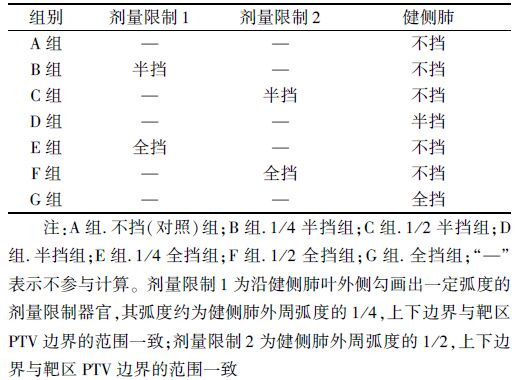
1. 靶区剂量学参数分析:PTV横断面的直径范围为(4.95~9.28)cm,中位值6.49 cm,平均体积为(109.22±45.60)cm3。E、F、G组的靶区最大剂量与A组比较,差异有统计学意义(t=2.60、5.56、4.96,P<0.05);E、F、G组的靶区最小剂量与A组比较,差异有统计学意义(t=2.33、4.53、2.58,P<0.05);F、G组的靶区中位剂量与A组比较差异有统计学意义(t=2.28、3.93,P<0.05);F、G组的平均剂量与A组比较差异有统计学意义(t=2.37、4.08,P<0.05);F、G组的靶区均匀性指数与A组比较差异有统计学意义(t=3.24、4.72,P<0.05);E、F、G组的适形度指数与A组比较差异有统计学意义(t=2.10、6.67、6.16,P<0.05),见表 2。
|
|
表 2 30例患者靶区剂量学参数(Gy,x±s) |
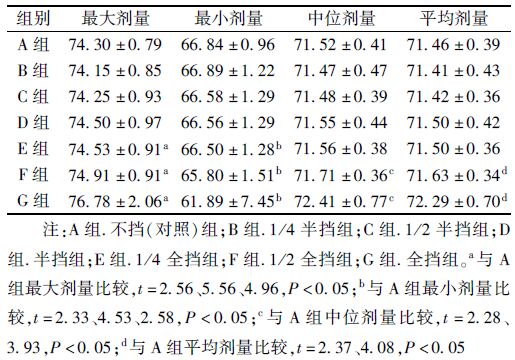
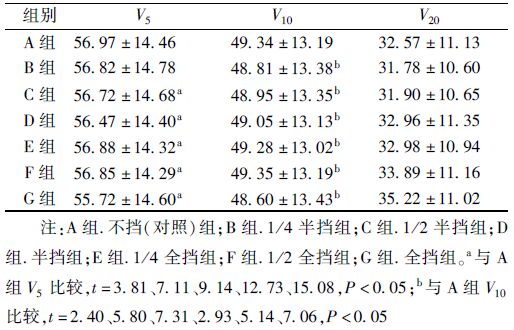
2. 双肺的剂量学参数分析:双肺的平均体积为(3 445.15±1 129.42)cm3。各组平均剂量与A组比较差异均有统计学意义(t=2.96、5.95、2.54、4.53、6.64、8.27,P<0.05);B组V5与A组比较差异无统计学意义,C、D、E、F、G组与A组比较差异有统计学意义(t=3.81、7.11、9.14、12.73、15.08,P<0.05);各组V10与A组比较差异均有统计学意义(t=2.40、5.80、7.31、2.93、5.14、7.06,P<0.05);各组V20与A组比较差异无统计学意义;B、C组的V30、V40、V60与A组比较差异无统计学意义,E、F、G组的V30与A组比较差异有统计学意义(t=2.74、3.42、4.35,P<0.05);D、E、F、G组的V40与A组比较差异有统计学意义(t=2.41、2.38、3.75、6.88,P<0.05);各组的V50与A组比较差异有统计学意义(t=2.22、2.43、2.52、2.19、3.22、5.31,P<0.05);E、F、G组的V60与A组比较差异有统计学意义(t=2.25、3.23、4.34,P<0.05),见表 3和4。
|
|
表 3 30例患者双肺V5、V10、V20参数(%,x±s) |
|
|
表 4 30例患者双肺V30~V60参数(%,x±s) |
3. 单次治疗时间对比:A、B、C、D、E、F、G组平均治疗时间分别为(3.61±0.42)、(3.92±0.45)、(4.06±0.46)、(4.41±0.57)、(4.21±0.51)、(4.74±0.58)和(6.47±1.37)min。B、C、D、E、F、G组平均治疗时间较A组分别增加8.51%、12.37%、22.17%、16.60%、31.36%和79.22%。
4. 1例患者不同限制条件靶区剂量分布:如图 1所示,B、C、D组对一定区域的健侧肺行半挡条件,低剂量V10的范围明显减少;E、F、G组对一定区域的健侧肺行全挡条件,低剂量区体积V5、V10的范围明显减少,勾画弧度越大,低剂量区体积减少越明显。
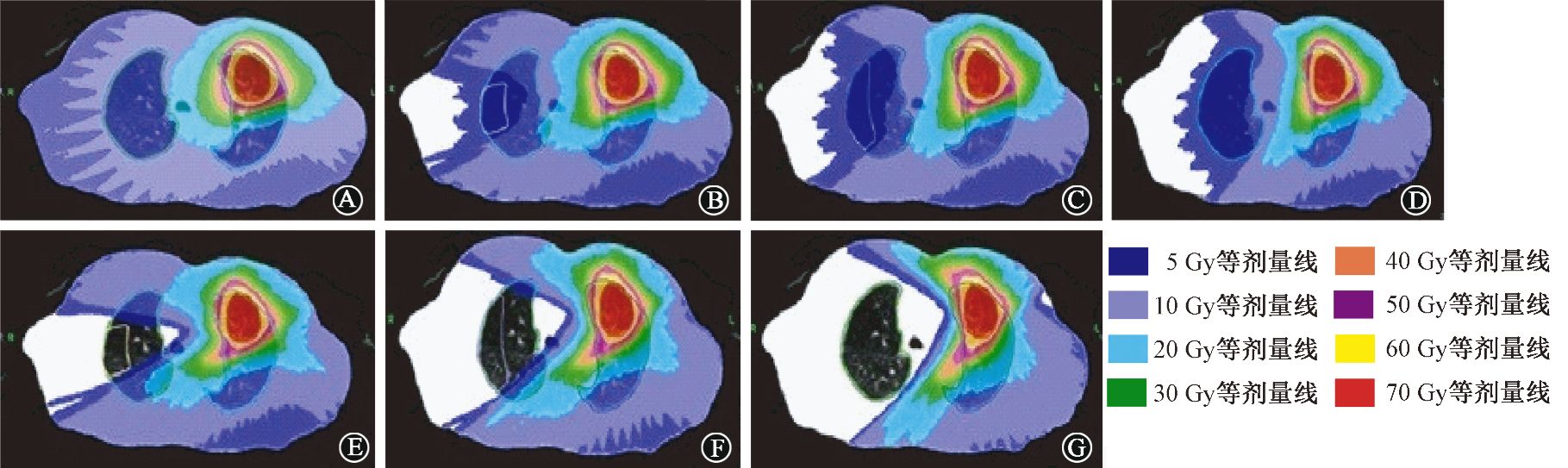 |
图 1 一例患者不同限制条件的靶区剂量分布图 A.不挡组;B.1/4半挡组;C.1/2半挡组;D.半挡组;E.1/4全挡组;F.1/2全挡组;G.全挡组 |
肺癌通常需要采取综合治疗,放射治疗作为综合治疗的重要手段之一,不仅能够用于早期和局部晚期病变的治疗,对于晚期转移病例,放射治疗也获得了令人满意的治疗效果[7, 8]。Jo等[4]回顾分析Tomotherapy治疗肺部转移灶,研究证明双肺V5是预测放射性肺炎发生的一个重要因素,发生放射性肺炎的概率随着双肺V5的增加呈正比例,并且V5达到65%时呈突然性增长。
目前,对于肺部肿瘤是否可以应用Tomotherapy照射治疗仍存争议。Kissick等[9]通过应用仿真型胸部模体模拟肺部肿瘤,人为制造1 cm的任意方向呼吸动度,并且不加任何呼吸运动控制装置。实验结果证明在没有较大、低频率(呼吸周期值大于铅门宽度除以床移动速度的比值)的移位情况下,Tomotherapy剂量分布的不确定度很小。实验推荐治疗时患者尽可能规则的呼吸,在没有低频移位的前提下,呼吸动度等于或者小于治疗的铅门宽度值时剂量输出模糊是可以接受的,并且无需加任何呼吸运动控制装置。对于类似肺部肿瘤等呼吸动度相对较大的情况,在能保证规则呼吸的前提下,Tomotherapy在照射时能够包含整个肿瘤,对剂量分布的影响很小[10]。
由于Tomotherapy旋转一圈产生51个投射角,且每一个投射角都拥有比常规调强更强的调制能力,通过对需要保护的正常组织的射野出束角度进行一定区域限制,可以使正常组织得到更好的保护[11]。该研究结果也证明,对健侧肺进行一定区域的限制,对于减少双肺的平均剂量和低剂量区体积有着积极作用。半挡对靶区的影响较小,可以有效减少双肺的平均剂量和低剂量区体积,且减少比例和被挡健侧肺弧度的大小存在正相关性,双肺的高剂量区体积也没有明显增加,治疗时间增加的比例,尚在临床可接受范围内。全挡一定弧度的健侧肺对靶区的平均剂量和适形度影响较大,虽然双肺的平均剂量和低剂量区体积得到了有效减少,但双肺的高剂量区体积增加明显,且治疗时间增加比例较大,在临床计划设计中,仍应综合考虑,确定是否使用全挡条件。
该研究目前仍属物理剂量学范畴,尚未能与临床数据结合,双肺低剂量区体积的减少是否可以在临床中有效降低放射性肺炎发生的概率,仍需结合临床进一步观察,得出更为可靠的结论。
| [1] | 马林, 王连元, 周桂霞. 肿瘤断层放射治疗[M]. 成都: 四川科学技术出版社, 2010. |
| [2] | 石健, 王强, 王冬青, 等. 固定野调强放疗对局部晚期肺癌放射性肺炎的影响[J]. 中华放射医学与防护杂志, 2012, 32(6): 633-634. |
| [3] | Song GH, Pyo H, Moon SH, et al. Treatment-related pneumonitis and acute esophagitis in non-small cell lung cancer patients treated with chemotherapy and helical tomotherapy[J]. Int J Radiat Oncol Biol Phys, 2010, 78(3): 651-658. |
| [4] | Jo I, Kay C, Kim J, et al. Significance of low-dose radiation distribution in development of radiation pneumonitis after helical-tomotherapy-based hypofractionated radiotherapy for pulmonary metastases[J]. J Radiat Res, 2014, 55(1): 105-112. |
| [5] | van der Geld YG, van Triest B, Verbakel WFAR, et al. Evaluation of four-dimensional computed tomography-based intensity-modulated and respiratory-gated radiotherapy techniques for pancreatic carcinoma[J]. Int J Radiat Oncol Biol Phys, 2008,72(4): 1215-1220. |
| [6] | Paddick I. A simple scoring ratio to index the conformity of radiosurgical treatment plans[J]. J Neurosurg, 2000, 93(Suppl 3): 219-222. |
| [7] | Yang J, Amini A, Williamson R, et al. Automatic contouring of brachial plexus using a multi-atlas approach for lung cancer radiation therapy[J]. Pract Radiat Oncol, 2013, 3(4): e139-e147. |
| [8] | Li HQ, Wang YJ, Li J, et al. The application of gamma stereotactic body radiation therapy in stage I/II non-small-cell lung cancer. Promising and encouraging outcome[J]. Saudi Med J, 2013, 34 (11): 1139-1144. |
| [9] | Kissick MW, Mo XH, McCall K, et al. A phantom model demonstration of tomotherapy dose painting delivery, including managed respiratory motion without motion management[J]. Phys Med Biol, 2010, 55 (10): 2983-2995. |
| [10] | Kissick MW, Flynn RT, Westerly DC, et al. On the impact of longitudinal breathing motion randomness for tomotherapy delivery[J]. Phys Med Biol, 2008, 53 (18): 4855-4873. |
| [11] | Qiu J, Liu ZK, Yang B, et al. Low-dose-area-constrained helical tomotherapy-based whole breast radiotherapy and dosimetric comparison with tangential field-in-field IMRT[J]. Biomed Res Int, 2013,2013: 513708. |
 2015,Vol. 35
2015,Vol. 35