对肿瘤细胞代谢的研究早在20世纪初就已开始,Warburg[1]首先发现活跃的糖酵解代谢是恶性肿瘤细胞显著的生化特征。即使在有氧条件下,恶性肿瘤细胞糖酵解代谢仍明显活跃,也经由糖酵解转化大量葡萄糖生成乳酸。这一特殊生化表型,被称为瓦博格效应(Warburg effect)。Christofk等[2]研究发现丙酮酸激酶同工酶M2(pyruvate kinase M2,PKM2)是瓦博格效应的关键酶之一,并在肿瘤的新陈代谢和生长发育中发挥重要作用。肿瘤细胞中PKM2表达大大升高,在多种肿瘤病理组织的研究中也验证了这一结果[3, 4, 5]。目前,对PKM2与细胞放化疗抵抗的研究很少。本实验利用RNAi技术有效干扰A549细胞中PKM2的表达,进而研究PKM2基因对非小细胞肺癌(non-small cell lung cancer,NSCLC)肿瘤细胞放射敏感性的影响,旨在探讨PKM2作为NSCLC新的治疗靶点的可行性。
1. 主要试剂和材料:RPMI 1640(美国GIBCO公司);胎牛血清(杭州四季青公司);TRIzol试剂(美国Invitrogen公司),转染试剂LipofectamineTM2000(美国Invitrogen公司),反转录试剂盒(日本Toyobo公司),兔抗人PKM2单克隆抗体、兔抗人β-肌动蛋白单克隆抗体、HRP标记的山羊抗兔二抗(美国CST公司),SYBR Premix Ex TaqTM(日本TaKaRa公司),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),细胞周期试剂盒、Annexin-V凋亡检测试剂盒(美国BD公司)。
2. siRNA的设计与制备:在美国国立生物信息中心数据库(NCBI)中查找到PKM2基因核苷酸序列(Gene ID:5315),采用美国Ambion公司在线设计软件,针对目的基因PKM2设计siRNA。针对PKM2基因的siRNA序列为:正义链:5'GGGUGAACUUUGCCAUGAATT 3';,反义链:5'UUCAUGGCAAAGUUCACCCTT 3'。阴性对照组siRNA序列为:正义链:5'UUCUCCGAACGUGUCACGUdTdT 3';反义链:5'ACGUGACACGUUCGGAGAAdTdT 3'。上述序列由上海吉玛制药公司合成并通过测序验证。
3. 细胞培养与转染:人肺癌A549细胞株购自中国科学院上海细胞研究所。用含10%胎牛血清的RPMI 1640细胞培养液在37℃、5%CO2培养箱中培养、消化传代,取对数生长期的A549细胞按5×105/孔接种于6孔培养板,当细胞贴壁生长达到80%融合时,按照LipfectamineTM2000转染说明书进行转染,荧光标记的siRNA检测转染效率。细胞分为3组:siRNA干扰组,阴性对照组,空白对照组。每组实验重复3次。空白对照组以等量培养基代替转染体系。继续放入37℃、5%CO2饱和湿度培养箱中培养。
4. 细胞照射:在室温下,采用本科室瑞典医科达直线加速器6 MV X射线垂直照射,剂量率为200 cGy/min。细胞上面覆盖1 cm组织等效填充物,源靶距SSD 100 cm。每个剂量点3个平行样本,每组实验重复3次。
5. RT-PCR检测PKM2 mRNA表达:用TRIzol试剂盒提取A549细胞(4×105细胞)的总RNA,定量后按反转录试剂盒说明书合成cDNA。采用SYBR Green法定量检测PKM2 mRNA表达,β-肌动蛋白作为内参照。PCR引物均由上海生物工程公司合成。PKM2引物序列:上游:5'CCCAGCTTCCCGATCAGTG 3';下游:5'GATGAGCCCAGTTCGGATCTC 3'。β-肌动蛋白引物序列:上游:5'GATCATTGCTCCTCCTGAGC 3';下游:5'ACTCCTGCTTGCTGATCCAC 3'。每组均设3个复孔,每次实验重复3次,将所得结果按2-△△Ct法[6]分析即可检测出样品PKM2 mRNA表达。
6. Western blot检测PKM2蛋白表达:细胞转染48 h后,分别提取各实验组细胞的总蛋白,用BCA蛋白浓度测定试剂盒测定蛋白浓度,上样总蛋白50 μg,经8%SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)后,湿转法将凝胶转移到PVDF膜。转膜完成后将膜用10%脱脂奶粉室温封闭2 h。之后加入PKM2一抗(1∶800稀释),置于摇床上4℃孵育过夜。次日,膜用TBS-T(三乙醇胺缓冲盐水溶液)洗涤3次,每次10 min,洗膜后加入二抗(1∶5 000)。最后暗室曝光,用超敏ECL化学发光试剂检测蛋白条带。
7. 集落形成实验:细胞转染48 h后,经胰酶消化后制成单细胞悬液。按吸收剂量0、2、4、6、8和10 Gy分别接种500、500、1 000、2 000、5 000和8 000个细胞于6孔板中,每组设3个复孔。细胞贴壁后分别予以X射线照射,置于37℃、5% CO2培养箱内继续培养14 d。镜下观察细胞集落形成后,弃去培养皿中的培养基,用PBS清洗两遍后加入甲醇固定,结晶紫染色,计数含50个细胞以上的细胞集落。集落形成率(PE,%)=各组集落数/接种细胞数;细胞存活分数(SF,%)=(处理组PE/对照组PE)×100%。以3次照射的存活分数均值进行分析,运用GraphPad Prism 5.0软件进行单击多靶模型曲线拟合,绘制剂量存活曲线,并计算多靶单击模型参数致死剂量(D0)、准阈剂量(Dq)、外推数(N)、照射2 Gy时细胞存活率(SF2)以及放射增敏比(SER)。SER=D0空白对照组/D0 siRNA干扰组。
8. 流式细胞仪检测细胞周期:细胞转染48 h后,给予10 Gy照射,各组分别继续培养48 h。培养结束后收集贴壁和悬浮细胞,1 000×g离心3~5 min,沉淀细胞,冷PBS洗两遍,弃上清。70%乙醇4℃固定过夜,弃乙醇,再次用冷PBS洗1次,弃上清。加入碘化丙啶染液0.5 ml,4℃避光孵育30 min,流式细胞仪检测其细胞周期的分布情况,Wincycle 32软件来分析不同细胞群体DNA含量。实验重复3次,取平均值。
9. 流式细胞仪检测细胞凋亡:细胞培养和照射方法同细胞周期实验,照射后48 h用胰酶消化和收集各组细胞(包括上清液中的细胞),冷PBS洗两遍后,加入100 μl结合缓冲液重悬,再加入5 μl Annexin V和 5 μl PI溶液,轻轻振匀,室温避光反应15 min,再加入300 μl结合缓冲液振匀,上流式细胞仪(美国Becton Dicknson公司,FACScort型)检测,CELL Quest软件进行数据获取,ModFit 2.0软件进行分析,计算细胞凋亡率。
10. 统计学处理:细胞存活曲线采用GraphPad Prism 5.0软件分析。数据用x±s表示,使用SPSS 20.0软件对数据进行分析。组间比较采用独立样本的t检验。P<0.05为差异有统计学意义。
1.siRNA下调A549细胞PKM2 mRNA及蛋白的表达水平:RT-PCR结果显示,siRNA干扰组与空白对照组的PKM2 mRNA表达差异有统计学意义(t=20.91,P<0.01),抑制率为(70.27±1.38)%;而阴性对照组与空白对照组间PKM2 mRNA表达差异无统计学意义(图 1)。Western blot检测结果表明,siRNA干扰组中细胞PKM2蛋白水平明显下降(t=47.00,P<0.01),经软件Image J分析条带灰度值并计算抑制率,得出该组PKM2蛋白表达抑制率为(70.42±1.18)%;阴性对照组与空白对照组相比,其PKM2蛋白表达量无明显变化(图 2)。说明本实验设计合成的干扰序列能特异性抑制PKM2基因的表达。
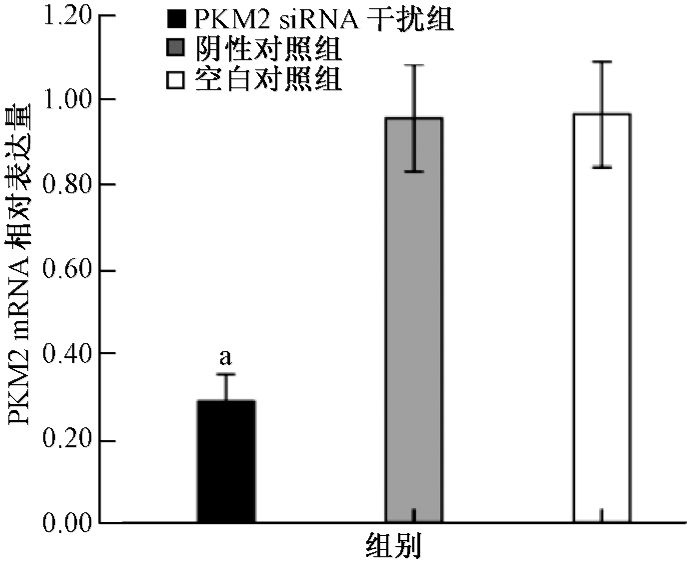 |
图 1 PKM2 siRNA转染抑制人肺癌A549细胞中PKM2 mRNA的表达[ 注:a与空白对照组比较,t=20.91,P<0.01 |
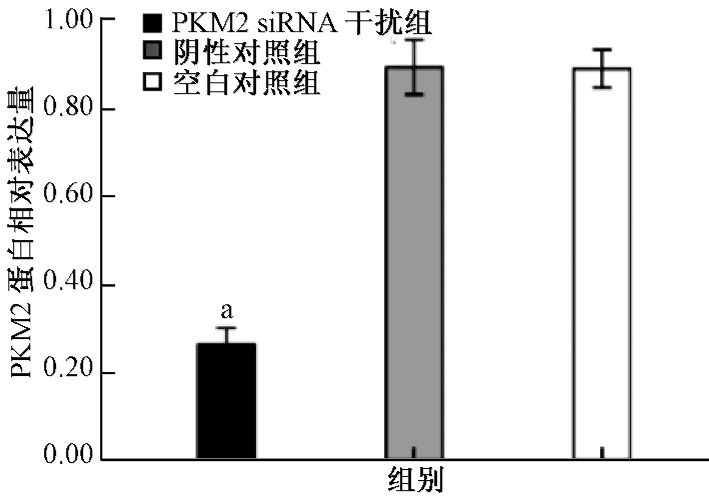 |
图 2 PKM2 siRNA转染抑制人肺癌A549细胞中PKM2蛋白的表达[ 注:a与空白对照组比较,t=47.00,P<0.01 |
2.集落形成实验:实验各组的剂量存活曲线见图 3,根据剂量存活曲线得到主要放射生物学参数,见表 1。经不同剂量X射线照射后,细胞存活分数显示,PKM2 siRNA干扰+X射线照射(IR)组的SF2低于阴性对照+IR组和空白对照+IR组,差异有统计学意义(t2 Gy=54.61、29.63,P<0.01);在4~10 Gy各照射剂量点亦是同样现象(t4 Gy=115.42、116.19,P<0.01;t6 Gy=34.75、26.59,P<0.01;t8 Gy=75.41、26.46,P<0.01;t10 Gy=87.16、21.41,P<0.01);阴性对照组和空白对照组细胞存活分数差异无统计学意义,表明X射线照射联合PKM2 siRNA能抑制A549细胞的存活。干扰PKM2基因在一定程度上提高了A549细胞放射敏感性(t=43.82、28.44、15.60,P<0.01)。
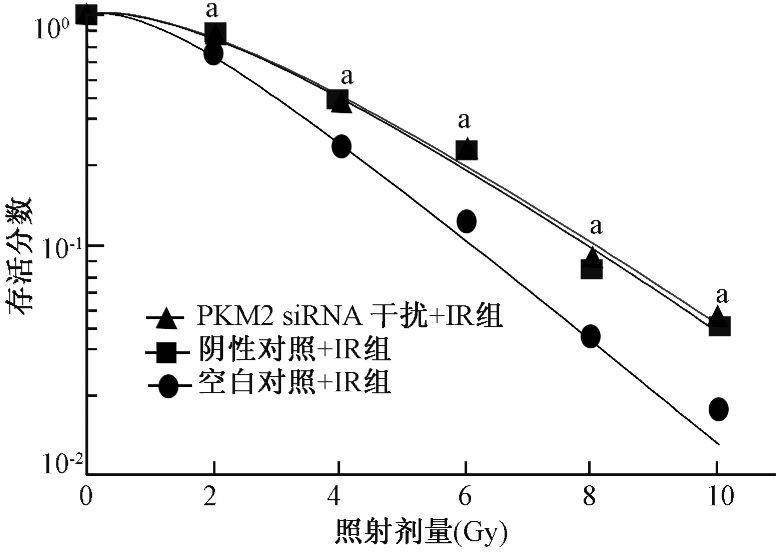 |
图 3 不同剂量照射后PKM2 siRNA A549的细胞存活曲线 注:a与siRNA干扰组比较,t=29.63、116.19、26.59、26.46、21.41,P<0.01 |
|
|
表 1 A549细胞中PKM2 siRNA处理前后的放射生物学参数(x±s) |
3. PI单染法检测细胞周期结果:见表 2。由表 2可知,siRNA干扰组细胞周期被阻滞在G2/M期,明显高于空白对照组(t=8.35,P<0.01);10 Gy X射线照射也可引起细胞周期G2/M期阻滞(t=27.87,P<0.01)。两者联合使用后G2/M期阻滞更加明显(t=43.92,P<0.01)。而阴性对照组和空白对照组差异无统计学意义。
|
|
表 2 10 Gy X射线照射后细胞周期分布和凋亡率比较(%,x±s) |
4. Annexin V-FITC双染法检测细胞凋亡结果:见表 2。由表 2可知,siRNA干扰组与空白对照组细胞凋亡率差异无统计学意义,空白对照+IR组较空白对照组凋亡率明显升高(t=23.99,P<0.01),siRNA干扰+IR组凋亡率最高,与空白对照+IR组和siRNA干扰组相比,差异均有统计学意义(t=9.42、65.21,P<0.01)。无论是否联合X射线照射,阴性对照组和空白对照组之间差异均无统计学意义。由此可见siRNA干扰PKM2表达并不能直接诱导细胞凋亡,但可增强X射线诱导细胞凋亡的作用。
丙酮酸激酶(PK)是细胞糖酵解途径的关键酶,也是肿瘤细胞糖代谢异常的关键酶,有PKL、PKR、PKM1和PKM2 4种同工酶,L型主要表达在肝脏和肾脏;R型在红细胞;M1型于肌肉和脑。M2型丙酮酸激酶表达在核酸合成旺盛的组织,比如胚胎细胞,干细胞和肿瘤细胞[7],并且随着胚胎发育逐渐被其他3种同工酶代替,但肿瘤细胞中PKM2表达再度上升并且取代组织中原表达的同工酶类型,例如肝癌中PKL、脑组织中PKM1消失,而PKM2大量表达[8, 9]。Christofk等[2, 10]证实了肿瘤细胞有氧糖酵解异常代谢正是由于PKM2的高表达而产生。谭莉等[11]研究表明,PKM2在人胃癌的发展中发挥重要作用,并对胃癌BGC-823细胞增殖和迁移有一定的促进作用。目前已有多个研究显示,PKM2可影响到肿瘤细胞的化疗耐药性[12, 13],因此,推测PKM2同样也能影响细胞对放疗的敏感性,通过抑制PKM2基因的表达提高肿瘤细胞放射敏感性。
本研究采用化学合成已知序列的siRNA,通过脂质体包裹瞬时转染人肺癌A549细胞系,成功地在mRNA和蛋白表达水平下调了PKM2的表达。进一步研究发现,集落形成实验分析了PKM2 siRNA转染A549细胞后在不同剂量照射下细胞生长,结果显示,该方法使细胞存活曲线明显下降,放射增敏比为1.27,说明PKM2 siRNA转染A549细胞后通过降低PKM2的表达可以达到一定的放射增敏作用。另外,也可认为高PKM2表达的肿瘤细胞系具有放射抵抗性,PKM2基因与肿瘤放射敏感性有一定的相关性。
为初步了解PKM2影响肿瘤放射敏感性的机制,本研究观察了PKM2对肺癌A549细胞周期和凋亡的影响。现已知肿瘤细胞主要是由于细胞周期破坏而导致了细胞的失控性生长,细胞周期阻滞是肺癌许多化疗药物和放射治疗的重要作用机制之一。而细胞凋亡是肺癌许多化疗药物和放射治疗另外一重要作用机制。本实验结果表明,抑制PKM2的表达或X射线照射都可以诱导A549细胞周期阻滞,G2/M期细胞的数量出现明显增加,即表现为G2/M期细胞阻滞;而siRNA干扰+IR组G2/M较空白对照+IR组和siRNA干扰组均明显升高,表明siRNA干扰PKM2表达与射线联合进一步增强了射线的G2/M期阻滞作用。而放射生物学研究表明,细胞在不同周期时相对放射线的敏感性不同,在G2/M期对放射线最为敏感[14]。此外,细胞的凋亡水平与放射敏感性有关,细胞凋亡水平越高提示细胞放射敏感性越强。本研究结果还显示,X射线处理48 h后,单纯siRNA干扰PKM2表达对细胞凋亡影响不明显。经照射后,细胞的凋亡率明显升高。siRNA干扰PKM2表达与照射联合使用后,细胞凋亡率较空白对照+IR组和siRNA干扰组都有明显升高。结合细胞周期和细胞凋亡的结果推测,尽管抑制的PKM2表达不能直接诱导细胞凋亡,但可以把细胞阻滞于G2/M期这一对射线相对敏感的时相;G2/M期细胞比例的增加,致使放疗后细胞凋亡明显增加。但也不排除另外一种可能,即抑制PKM2的表达或X射线照射诱导A549细胞G2/M期阻滞与siRNA干扰PKM2表达联合照射使细胞凋亡明显增加只是简单的照射后的并列出现事件,两者并不存在因果关系。这种细胞周期改变和细胞凋亡增加的关系仍需进一步探索。
综上所述,用siRNA干扰技术抑制PKM2的表达对肺癌A549细胞具放射增敏作用,其机制可能是改变了肺癌细胞的周期分布,增加了X射线诱导细胞凋亡的作用。本实验表明,PKM2基因是增强肿瘤细胞放射敏感性的一个潜在的分子靶位。但其分子机制及临床使用的最佳时机、最适剂量和使用途径仍需深入研究。
| [1] | Warburg O. On the origin of cancer cells[J]. Science,1956,123(3191):309-314. |
| [2] | Christofk HR,Vander Heiden MG,Harris MH,et al. The M2 splice isoform of Pyruvate kinase is important for cancer metabolism and tumor growth[J]. Nature,2008,452(7184):230-233. |
| [3] | Martinez-Balibrea E,Plasencia C,Gines A,et al. A proteomic approach links decreased pyruvate kinase M2 expression to oxaliplatin resistance in patients with colorectal cancer and in human cell lines[J]. Mol Cancer Ther,2009,8(4):771-778. |
| [4] | Bluemlein K,Gruning NM,Feichtinger RG,et al. No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis[J]. Oncotarget,2011,2(5):393-400. |
| [5] | Liu Z,Feng JG,Tuersun A,et al. Proteomic identification of differentially-expressed proteins in esophageal cancer in three ethnic groups in Xinjiang[J]. Mol Biol Rep,2011,38(5):3261-3269. |
| [6] | Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods,2001,25(4):402-408. |
| [7] | Yeh CS,Wang JY,Chung FY,et al. Significance of the glycolytic pathway and glycolysis related-genes in tumorigenesis of human colorectal cancers[J]. Oncol Rep,2008,19(1):81-91. |
| [8] | Hacker HJ,Steinberg P,Bannasch P. Pyruvate kinase isoenzyme shift from L-type to M2-type is a late event in hepatocarcinogenesis induced in rats by a choline-deficient/DL-ethionine-supplemented diet[J]. Carcinogenesis,1998,19(1):99-107. |
| [9] | Steinberg P,Klingelhoffer A,Schfer A,et al. Expression of pyruvate kinase M2 in preneoplastic hepatic foci of N-nitrosomorpholine-treated rats[J]. Virchows Arch,1999,434(3):213-220. |
| [10] | Christofk HR,Vander Heiden MG,Wu N,et al. Pyruvate kinase M2 is a phosphotyro-sine-binding protein[J]. Nature,2008,452(7184): 181-186. |
| [11] | 谭莉,巴亚斯古楞,任建林. siRNA沉默PKM2对胃癌BGC-823细胞增殖迁移的抑制作用[J]. 胃肠病学,2012,17(6):329-333. |
| [12] | Li SL,Ye F,Cai WJ,et al. Quantitative proteome analysis of multidrug resistance in human ovarian cancer cell line[J]. J Cell Biochem,2010,109(4):625-633. |
| [13] | Martinez-Balibrea E,Plasencia C,Gines A,et al. A proteomic approach links decreased pyruvate kinase M2 expression to oxaliplatin resistance in patients with colorectal cancer and in human cell lines[J]. Mol Cancer Ther,2009,8(4):771-778. |
| [14] | Milanović D,Firat E,Grosu AL,et al. Increased radiosensitivity and radiothermosensitivity of human pancreatic MIA PaCa-2 and U251 glioblastoma cell lines treated with the novel Hsp90 inhibitor NVP-HSP990[J]. Radiat Oncol,2013,8(86): 42-50. |
 2015,Vol. 35
2015,Vol. 35