鼻咽癌(nasopharyngeal carcinoma,NPC)是我国常见的恶性肿瘤,放射治疗是最有效的治疗手段。然而,研究表明,鼻咽癌组织中存在一定比例的放射抗拒细胞,严重制约了鼻咽癌的放射治疗疗效和预后[1]。自噬(autophagy)是细胞内物质代谢的一种方式,维持细胞内环境的稳定,被证实与多种肿瘤的发生发展密切相关[2]。本课题组首次探讨自噬与鼻咽癌的关系,并经过前期实验证实:射线可以引起鼻咽癌CNE-2细胞发生自噬现象,且利用自噬的化学抑制剂抑制自噬后,可以增加鼻咽癌CNE-2细胞的放射敏感性[3, 4, 5]。基于前期基础,本研究采用慢病毒介导的RNA干扰方式沉默自噬相关基因ATG5,以此降低鼻咽癌CNE-2细胞的自噬活性,进一步探讨自噬在射线所致鼻咽癌CNE-2细胞死亡过程中的作用,为提高鼻咽癌放射敏感性提供新的思路和理论基础。
1. 材料与试剂:人鼻咽癌CNE-2细胞购自中国科学院上海生命科学研究院细胞资源中心;以PGCSIL-GFP为载体,针对ATG5基因(Gene ID:NM_004849.2)构建shRNA干扰的慢病毒重组质粒,并包装成ATG5 shRNA和阴性对照shRNA(negative control shRNA,NC-shRNA)慢病毒。病毒载体的构建及包装交由上海吉凯基因化学技术有限公司负责。引物的设计与合成、RT-PCR试剂盒均由日本TaKaRa公司提供;Odyssey凝胶成像系统购自美国LI-COR公司;CCK-8试剂盒购自日本同仁化学研究所;Annexin V-PE凋亡检测试剂盒购自美国eBioscience公司;兔抗人ATG5单克隆抗体、兔抗人GAPDH及抗兔红外荧光二抗均购自美国CST公司;兔抗人微MAPlLC3单克隆抗体(L7543)购自美国Sigma公司;Precise LINAC高能直线加速器,购自瑞典Elekta公司。
2.细胞培养与照射条件:鼻咽癌CNE-2细胞接种于含10% 胎牛血清的RPMI 1640培养基中,在37℃、5%CO2饱和湿度培养箱中培养;采用6 MV X射线进行体外照射,源靶距SSD=100 cm,剂量率200 cGy/min。
3.RNA提取及RT-PCR:按说明提取细胞总RNA,根据RT-PCR试剂盒说明,反转录成cDNA,进行PCR扩增。ATG5上游引物:5'GCTGCACTTTATTACCAAGCCTCTG3',下游引物:5' AGCGTACTCAAATGGGTCAACATTC3',产物大小119 bp;内参β-肌动蛋白上游引物:5'ACCGAGCGCGGCTACAGC3',下游引物:5'CTCATTGCCAATGGTGAT3',产物大小180 bp。PCR反应条件为95℃ 30 s,1个循环;95℃ 5 s、62℃ 30 s,40个循环;95℃ 5 s、60℃ 1 min,1个循环;50℃ 30 s,1个循环。
4.慢病毒感染与分组:感染前1 d,将CNE-2细胞以105个/孔接种于6孔板中,每孔分别加入20 μl病毒液、200 μl的Polybrene、780 μl无血清的RPMI1640,充分混匀后放入细胞培养箱培养。病毒感染8 h后,吸去病毒液并加入2 ml完全培养基继续培养,48 h后荧光显微镜下观察。流式细胞仪分选出GFP(+)细胞扩大培养。实验分为未转染的CNE-2细胞组(对照组)、 转染NC-shRNA的CNE-2细胞组(NC组)、转染ATG5-shRNA的CNE-2细胞组(ATG5组),每处理组设3个平行组。
5.Western blot实验:提取各实验组CNE-2细胞总蛋白,BCA法测定总蛋白浓度。蛋白10%SDS-PAGE凝胶电泳分离蛋白,目的蛋白湿转至0.22 μm PVDF膜,5%脱脂奶粉室温封闭2 h后加入1∶1 000稀释的ATG5一抗、MAPlLC3一抗及GAPDH一抗,4℃孵育过夜,TBST漂洗后二抗(1∶5 000)室温孵育1 h,Odyssey凝胶成像系统扫描成像,进行灰度分析。每个独立实验重复3次。
6.CCK-8实验:取对数生长期的待测细胞,以 3.0×103/孔密度接种于96孔板内,每组设5个复孔。培养24 h后接受X射线照射(0、2、4、6、8 Gy),照射后48 h吸去孔内培养液,用PBS溶液清洗细胞3次,然后每孔缓慢加入100 μl RPMI 1640和10 μl CCK-8,置于细胞培养箱中培养1 h,用酶标仪测定在450 nm处的吸光度(A)值,计算出细胞存活率。细胞存活率(%)=(实验组A值/对照组A值)×100%。
7.细胞凋亡检测:取0、6 Gy照射处理后的各实验组细胞,用PBS洗1次,加入胰酶(不含EDTA)消化、重悬、计数,2 000 r/min,1 800×g离心5 min,收集1.0×106个细胞,用PBS洗一遍后用1×结合缓冲液再洗1次,100 μl细胞悬液加入5 μl ANNEXIN V,室温孵育10~15 min后用1×结合缓冲液清洗细胞,再用200 μl×结合缓冲液重悬细胞,加入5 μl 7-AAD,4 h内流式细胞仪检测,避光保存于2~8℃。
8.克隆形成实验:取对数生长期待测细胞,胰酶消化后计数,将不同数目的细胞种植于6孔细胞培养板,每孔2 ml单细胞悬液。根据不同细胞数目给予不同的吸收剂量(种植的细胞数分别为200、200、400、600、1 000、5 000,吸收剂量分别对应为 0、1、2、4、6、8 Gy),照射后培养14 d。14 d后弃去培养液,蒸馏水冲洗2次,甲醇固定30 min,姬姆萨溶液染色30 min,计数所形成的集落数(≥50个细胞数的集落为有效的集落),计算存活分数SF和集落形成率PE。SF(%)=实验组集落形成率/对照组集落形成率,PE(%)=形成集落数/种植细胞数。在GraphPad Prism 5.0 软件中,使用线性二次模型y=exp[-(αx+βx2)]计算放射生物学参数并拟合剂量存活曲线。
9.统计学处理:采用SPSS 13.0软件进行分析,计量资料以x±s表示,组间比较采用方差分析,P<0.05为差异有统计学意义。
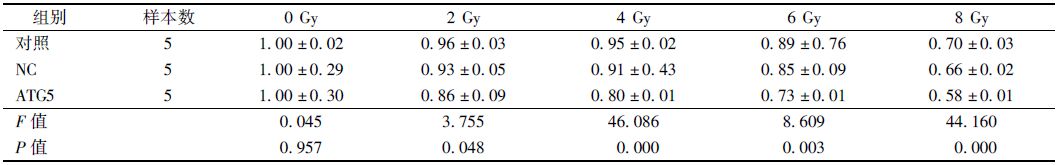
1.慢病毒感染对ATG5mRNA和蛋白表达的影响:RT-PCR结果见图 1。ATG5组与对照组、NC组相比,ATG5mRNA的表达受到了明显的抑制,抑制率为72.5%(F=37.501,P<0.05),而NC组和对照组间差异无统计学意义。ATG5蛋白的表达情况如图 2所示,ATG5组细胞中ATG5蛋白表达量上较对照组、NC组细胞组亦明显下降(F=23 097.179,P<0.05)。由此可见,自噬相关基因ATG5被明显抑制,慢病毒表达载体构建成功。
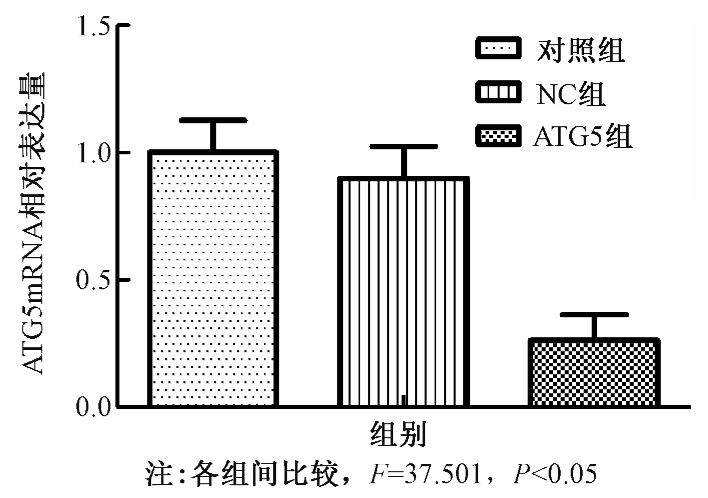 |
图 1 RT-PCR检测各组ATG5mRNA相对表达量 |
 |
图 2 各组ATG5蛋白的表达情况 |
2.自噬活性的降低对鼻咽癌CNE-2细胞增殖的影响:对照组、NC组及ATG5组分别接受0、2、4、6、8 Gy的X射线照射,应用CCK-8实验检测细胞射线照射前后的增殖与存活情况。结果发现,随着照射剂量的增加,CNE-2细胞的存活率是随之下降的,比较各个剂量点3组细胞的存活率可发现,与未转染的对照组和阴性对照NC组相比,射线照射后ATG5组的细胞存活率明显降低(F=3.755、46.086、8.609、44.160,P<0.05,表 1),以细胞在不同剂量的存活率绘制细胞生存曲线(图 3),可见下调ATG5的表达后可以增加鼻咽癌CNE-2细胞的放射敏感性。
|
|
表 1 CCK-8法检测不同射线照射后各实验组细胞的存活率(x±s) |
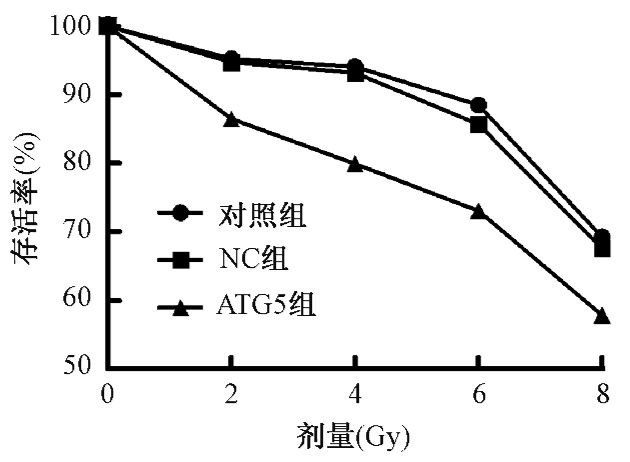 |
图 3 不同剂量照射后各实验组细胞的生存曲线 注解 |
3.流式细胞术检测ATG5沉默后鼻咽癌CNE-2细胞的凋亡变化情况:对照组、NC组及ATG5组分别接受0、6 Gy的X射线照射,应用流式细胞仪检测各组细胞凋亡情况。结果显示,未照射时,对照组、NC组、ATG5组细胞凋亡率分别是7.60%±1.23%、8.63%±0.68%、9.67%±1.50%,各实验组间比较,差异无统计学意义。而经6 Gy射线照射后,对照组、NC组、ATG5组细胞凋亡率分别是:12.13%±0.67%、11.07%±1.46%、30.1%±0.20%,可见与NC组及对照组相比,ATG5组凋亡率明显升高(F=394.876,P<0.05),提示射线照射时抑制自噬相关基因ATG5的表达可以促进鼻咽癌CNE-2细胞发生凋亡(图 4)。
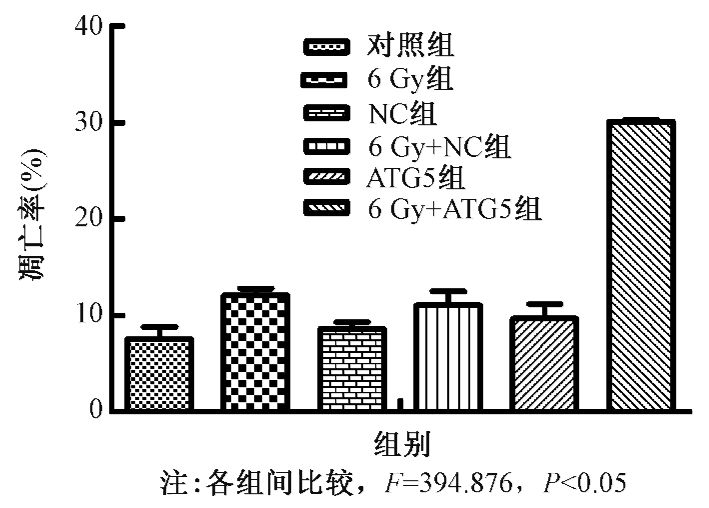 |
图 4 X射线照射前后各实验组细胞凋亡率 |
4.克隆形成实验检测转染前后CNE-2细胞的放射敏感性:各组细胞分别接受0、1、2、4、6、8 Gy的X射线照射,培养14 d后观察细胞克隆形成情况,在GraphPad Prism 5.0软件中,使用线性二次模型计算放射生物学参数并拟合剂量存活曲线,分别求出放射生物学参数α、β、α/β和SF2值。通常应用SF2和α/β比值来衡量放射敏感性和照射细胞生物学效应的指标。SF2值越小,细胞对射线越敏感。α/β比值越大,细胞修复能力越弱,对射线越敏感。结果显示,对照组、NC组及ATG5组的SF2值分别是0.606、0.595、0.386;α/β比值分别是4.038、4.175、18.107。与对照组和NC组相比,ATG5组SF2值明显降低(F=51.244,P<0.05)、α/β比值增高(F=17.184,P<0.05)。拟合剂量存活曲线如图 5所示,抑制自噬相关基因ATG5的表达,降低了自噬活性,可以提高鼻咽癌CNE-2细胞的放射敏感性。
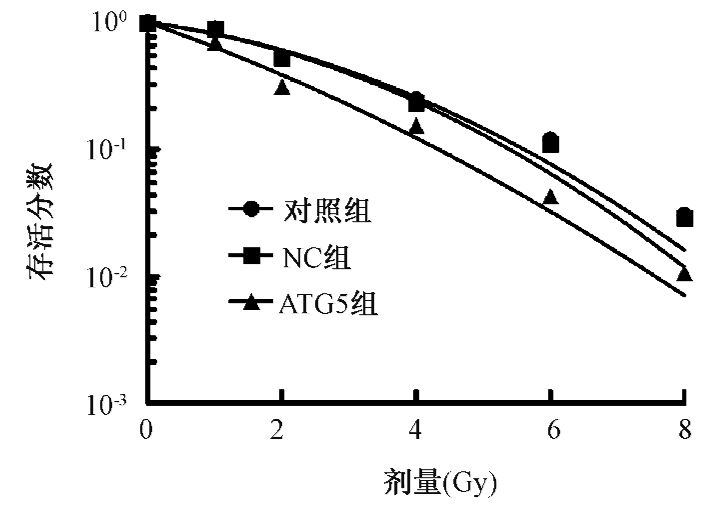 |
图 5 各组细胞的剂量存活曲线 |
鼻咽癌是来源于鼻咽上皮细胞的恶性肿瘤,病理类型多为低分化鳞状细胞癌,放射治疗是目前最有效的治疗手段。然而,单纯放射治疗局部晚期鼻咽癌的5年生存率只有32%~52%[6, 7]。研究发现,放射抗拒是鼻咽癌残留及局部复发的主要原因之一[8]。因此,有关放射抗拒的研究即成为众多肿瘤放射治疗学者研究的重点。自噬是细胞内初级溶酶体降解内源性底物的生理过程,是近年来研究的热点,其被认为不仅可以通过清除细胞内的废物、维持细胞内环境的稳定而影响细胞的生长发育,而且参与了多种疾病及肿瘤的发生、发展过程[9]。研究证实,在多种人类肿瘤中均存在自噬活性的改变[10]。然而,目前对于自噬与肿瘤发生、发展之间的关系尚无统一结论。部分学者认为,自噬的降解作用可以清除肿瘤细胞因代谢应激,如饥饿、电离辐射、药物等应激条件刺激下引起的基因组异常、受损的线粒体或大分子,从而减缓基因突变的速率,阻断线粒体的凋亡信号传导,保证癌细胞的生长[11]。而另一部分学者则认为,自噬可清除受损的细胞器,或者通过抑制细胞生长,诱发凋亡性细胞死亡来抑制肿瘤的发生。
本课题组预探讨自噬在鼻咽癌放射治疗过程中的作用,并经过前期实验证实,电离辐射可以诱导鼻咽癌CNE-2细胞发生自噬现象,并且通过自噬化学抑制剂CDP降低自噬活性后,可以增加鼻咽癌CNE-2细胞的放射敏感性[3, 4, 5]。本研究基于前期基础,从基因水平进一步验证自噬与鼻咽癌CNE-2细胞放射敏感性之间的关系。目前为止,科学家们已发现不少于34个自噬相关基因(autophagy-ralated gene,ATG),它们广泛地参与了自噬的各个不同阶段,在自噬这一现象中扮演着非常重要的角色,调控着自噬的发生发展过程。在众多的自噬相关基因中,ATG5被证实是一个非常重要的角色。研究发现,ATG5与ATG12在自噬体形成前期共同形成了自噬共轭连接体ATG12-ATG5,进而促进了自噬体膜结构的延伸和自噬体的形成[12, 13]。本研究选取自噬相关基因ATG5为切入点,通过慢病毒介导的RNA干扰技术沉默ATG5基因,并通过实验证明了ATG5基因沉默可以降低自噬标志物LC3Ⅱ蛋白的表达,降低自噬活性[14],从而进一步研究自噬对鼻咽癌CNE-2细胞放射敏感性的影响。其中,应用CCK-8实验检测细胞经不同剂量射线照射前后的增殖与存活情况,结果显示,抑制自噬相关基因ATG5的表达后,与未转染的对照组和阴性对照NC组相比,CNE-2细胞的存活率明显降低,以细胞在不同剂量的存活率绘制细胞生存曲线,也可见下调ATG5的表达后可以增加鼻咽癌CNE-2细胞的放射敏感性。另外,流式细胞术检测各实验组细胞照射前后的凋亡情况,可知经6 Gy射线照射后,与NC组及对照组相比,ATG5组凋亡率明显升高,提示6 Gy照射时抑制ATG5表达促进了CNE-2细胞凋亡,即降低ATG5的表达可以增加射线所致的细胞凋亡。克隆形成实验结果也提示,在各照射剂量点,沉默自噬相关基因ATG5可以增加鼻咽癌CNE-2细胞的放射敏感性。这一结果与课题组前期结果相符,从而可初步推断,自噬在射线所致的鼻咽癌CNE-2细胞死亡过程中起保护性作用。
目前,有关自噬在肿瘤放射治疗中作用的研究受到关注,自噬的作用也被认为具有双向性。一方面,干扰自噬现象可以提高肿瘤细胞的放射敏感性[15, 16]。Chen等[17]发现,应用自噬抑制剂3-MA联合放疗可以增加食管癌细胞的凋亡,抑制自噬可以增加放疗引起的食管癌细胞毒性作用,并且使细胞周期停滞在G2/M期,进而增加了食管癌的放射敏感性;另一方面,研究显示,自噬表现更多的是具有杀伤细胞的潜能[18]。Cao等[19]发现,通过mTOR抑制剂雷帕霉素和RAD001可以提高乳腺癌细胞的放疗疗效。本研究的实验结果与Chen等[17]的结果一致,但仍需后期的体内实验、临床实验等反复论证。期待通过系统严谨的研究,可以揭示自噬与鼻咽癌放射治疗间的关系,使其成为提高临床鼻咽癌放射治疗疗效的方法之一。
| [1] | 高云生,应红梅,熊小鹏,等. 局部晚期鼻咽癌放疗与化疗综合治疗的生存分析[J]. 中华放射肿瘤学杂志, 2007, 16(4):241-244. |
| [2] | Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1): 27-42. |
| [3] | 潘闻燕, 朱小东, 赵伟, 等. 不同浓度二磷酸氯喹和雷帕霉素对CNE-2细胞自噬的影响[J]. 中国癌症防治杂志, 2011, 3(4):280-283. |
| [4] | 周支瑞, 朱小东, 赵伟,等. 自噬抑制剂磷酸氯喹增加鼻咽癌CNE-2细胞株的放射敏感性[J]. 中华放射医学与防护杂志, 2012, 32(5): 449-454 |
| [5] | 朱小东, 潘闻燕, 赵伟, 等. 细胞自噬在照射所致 CNE-2细胞凋亡过程中的作用[J]. 中华放射肿瘤学杂志, 2012, 21(3):221-222. |
| [6] | Al-Sarraf M, Leblanc M, Giri PG, et al. Chemoradiotherapy versus radiotherapy in patients with advanced nasopharyngeal cancer: phase Ⅲ randomized Intergroup study 0099[J]. J Clin Oncol, 1998, 16(4): 1310-1317. |
| [7] | Baujat B, Audry W, Bourhis J, et al. Chemotherapy in locally advanced nasopharyngeal carcinoma: An individual patient data meta-analysis of eight randomized trials and 1753 patients[J]. Int J Radiat Oncol Biol Phys, 2006, 64(1): 47-56. |
| [8] | Wu P, Zhang H, Qi L, et al. Identification of Erp29 as a biomarker for predicting nasopharyngeal carcinoma response to radiotherapy[J]. Oncol Rep, 2012, 27(4): 987-994. |
| [9] | Yang Z, Klionsky DJ. Mammalian autophagy: Core molecular machinery and signaling regulation[J]. Curr Opin Cell Biol, 2010, 22(2):124-131. |
| [10] | Ogier-Denis E, Codogno P. Autophagy:a barrier or an adaptive response to cancer[J]. Biochim Biophys Acta, 2003, 1603(2):113-128. |
| [11] | Ashford TP, Porter KR. Cytoplasmic components in hepatic cell lysosomes[J]. J Cell Biol, 1962, 12(1):198-202 |
| [12] | Noda NN, Ohsumi Y, Inagaki F. ATG systems from the protein structural point of view[J]. Chem Rev, 2009, 109(4):1587-1598. |
| [13] | Levine B, Klionsky DJ.Development by self-digestion:molecular mechanisms and biological functions of antophagy[J]. Dev Cell, 2004, 6(4):463-477. |
| [14] | 卢小迪, 朱小东, 赵伟, 等. 自噬相关基因ATG5沉默增加鼻咽癌裸鼠移植瘤的放射敏感性[J]. 上海医学, 2015, 38(2):151-154. |
| [15] | Apel A, Herr I.Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy[J]. Cancer Res, 2008, 68(5):1485-1494. |
| [16] | Lomonaco SL, Finniss S, Xiang C, et al.The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells[J].Int J Cancer, 2009, 125(3):717-722. |
| [17] | Chen YS, Song HX, Lu Y, et al.Autophagy inhibition contributes to radiation sensitization of esophageal squamous carcinoma cells[J]. Dis Esophagus, 2011, 24(6):437-443. |
| [18] | Eisenberg-Lemer A, Kimchi A.The paradox of autophagy and its implication in cancer etiology and therapy [J].Apoptosis, 2009, 14(4):376-391. |
| [19] | Cao C, Subhawong T, Albert JM, et al. Inhibition of mammalian target of rapamycin or apoptotic pathway induces autophagy and radiosensitizes PTEN null prostate cancer cells[J]. Cancer Res, 2006, 66(20): 10040-10047. |
 2015,Vol. 35
2015,Vol. 35