2. 江苏大学医学院细胞生物学实验室
肝细胞癌(hepatocellular carcinoma,HCC)是一种临床常见的恶性肿瘤,临床数据表明放射治疗改善肝癌患者3年生存率最高可达30%[1],提示放射治疗有望成为肝癌治疗的有效手段。但肝脏的放射耐受性差,有效的肝癌放射治疗的增敏剂将改善肝癌治疗现状。
信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是一种存在于细胞质与酪氨酸磷酸化信号通道偶联的双功能蛋白。STAT3的过度激活能够上调部分与肿瘤细胞增殖、存活和侵袭相关的基因,参与包括肝癌在内的多种肿瘤的发生和发展[2]。目前研究表明,阻断STAT3的持续激活可以明显降低肿瘤细胞的存活、增殖、侵袭能力[3, 4]。Stattic是STAT3的特异性抑制剂,通过阻止STAT3的SH2结构域Tyr705磷酸化,从而抑制STAT3二聚体化和核内转移。本研究以高表达p-STAT3的肝癌细胞系Bel-7402为研究对象,探讨Stattic对肝癌细胞生长、迁移、侵袭和放射增敏作用及潜在机制。
1. 细胞及主要试剂:肝癌细胞系Bel-7402由江苏大学医学院分子生物学实验室传代保存。DMEM高糖培养基(含L-谷氨酰胺和丙酮酸钠)、胎牛血清、0.25%胰酶、磷酸盐缓冲液(PBS)购于美国Hyclone公司,青霉素/链霉素溶液(10 000 U/ml青霉素,10 000 μg/ml链霉素,溶于0.85%NaCl)购于美国Thermo公司。STAT3抑制剂(Stattic)、二甲基亚砜(DMSO)购于美国Sigma公司。活细胞计数试剂盒(CCK8 cell counting kit)购于南京Vazyme公司。Transwell小室购于美国Corning公司,Matrigel胶购于美国BD公司。蛋白Marker购于美国Thermo公司,STAT3、p-STAT3、Caspase-3、MMP-2、MMP-9、肌动蛋白抗体购于美国Cell Signaling公司。
2. 细胞培养:Bel-7402培养于含10%的胎牛血清、100 万U/L青霉素和链霉素的DMEM培养基中。细胞置于5%CO2、37℃细胞培养箱(美国Thermo公司)内培养,每2~3天传代1次,取对数生长期细胞用于实验。
3. 药物配制及照射方法:将25 mg的STAT3特异性抑制剂Stattic溶于2 ml的DMSO中,配成6×104 μmol/L浓度的母液储存在-20℃冰箱中,每次使用时用DMEM培养基稀释至目标浓度。使用ONCOR直线加速器(德国Siemens公司),应用6 MV X射线进行不同剂量照射,剂量率为300 cGy/min,源皮距100 cm,照射野为20 cm×20 cm,照射时机架角转至180°,细胞培养皿下垫2.0 cm厚的剂量补偿板,在CT(美国GE公司)下定位,并用Pinnacle 3计算机治疗计划系统(荷兰Philips公司)对剂量进行调整。
4. CCK8法检测细胞增殖:将对数生长期的细胞用胰酶消化传代,显微镜下细胞计数,调整细胞密度约3×104/ml,100 μl/孔,接种于96孔板,每组设6个复孔。细胞种板24 h后,每孔更换不同浓度Stattic(0、0.25、0.5、1、2、4、8、16、32 μmol/L)的含5%胎牛血清的DMEM培养基;对照组加入等量5%培养基100 μl,分别继续培养48 h后弃去原培养基,每孔内加入100 μl DMEM培养基和10 μl的CCK8试剂,将96孔板置于细胞培养箱内培养1 h,在450 nm波长处用酶标仪(美国BD公司)测定各孔吸光度(A)值。各药物浓度重复3次,计算细胞存活率。根据细胞增殖抑制率和药物浓度,细胞存活率(%)=(加药组A值-空白孔A值)/(对照组A值-空白孔A值)×100%。利用GraphPad Prism 5软件计算半数抑制浓度(IC50),并用20%的IC50作为后续放射增敏实验浓度。实验重复3次。
5. CCK8实验检测Stattic联合X射线照射对Bel-7402细胞的增殖抑制作用:实验分为空白对照组(仅更换5%血清培养基),Stattic组(1 μmol/L),单纯照射组(8 Gy)和Stattic联合照射组(联合组,照射8 Gy前4 h加入Stattic 1 μmol/L)。以上各组细胞在照射72 h后进行CCK8实验。每个剂量点设置3个复孔,计算各组细胞存活率。
6. 克隆形成实验:取对数生长期细胞,1 000 r/min消化离心5 min,离心半径12 cm,制成1×104/ml单细胞悬液,将不同细胞数种于6孔板中,分为单纯照射组和联合组。种板后24 h,单照射组更换5%血清培养基,联合组更换含0.5 μmol/L Stattic的5%血清培养基,两组共同在细胞培养箱中孵育4 h后分别接受0、2、4、6、8 Gy的6 MV的X射线照射,继续培养14 d,-20℃冰甲醇固定10 min,0.05%结晶紫在室温下染色30 min后双蒸水洗涤3次,空气干燥。倒置显微镜下进行细胞计数,≥50个细胞集落作为1个克隆。实验重复3次,计算克隆形成率(PE,%)=(克隆数/接种细胞数)×100%,存活分数(CF,%)=照射各剂量点PE/0 Gy PE。按多靶单击模型SF=1-(1-e-D/D\-0)N使用Graphpad 5 软件拟合细胞存活曲线,得出k和N值,计算单纯照射组和联合组的SF2、D0和Dq值,并计算放射增敏比(SER)。
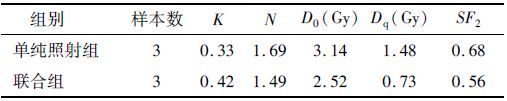
7. 细胞划痕实验:参照周菊英等[5]的方法,取对数生长期细胞,制成单细胞悬液,以2×106/孔接种于6孔板中,分为空白对照组、Stattic组、单纯照射组和联合组,待细胞覆盖孔90%密度时,在细胞表面划1条直线,用无菌PBS漂洗2次去除划下的悬浮细胞,Stattic组和联合组每孔加入含2%血清的培养基配成的浓度达1.0 μmol/L的Stattic,空白对照组和单纯照射组加入含2%血清的培养基,换液后4 h单纯照射组和联合组给予4 Gy剂量照射,而后置于培养箱继续培养0、24、48 h后,倒置显微镜100倍镜下观察细胞迁移情况。
8. Transwell侵袭实验:参照闫洪亮等[6]方法,取对数生长期细胞,制成单细胞悬液,以2×106/孔接种于6孔板中,分为空白对照组,Stattic组、单纯照射组和联合组,设0和4 Gy 2个剂量点,设0和1 μmol/L两个药物浓度,处理48 h后收集各组细胞,在Transwell小室上室加入用DMEM培养基稀释后的Matrigel基质胶(1 mg/ml)60 μl,置于细胞培养箱孵育4 h。上室内加入5×105个细胞,稀释于100 μl不含血清的培养基中,下室加入650 μl含10%血清的培养液,置于培养箱中培养18 h,取出膜,用棉签拭净基质胶及上室面细胞,甲醛固定,0.05%结晶紫染色后,倒置显微镜100倍镜下观察穿透膜的细胞数,随机选择4个不同视野在400倍下计数,计算平均数。
9. Western blot分析蛋白表达变化:分为空白对照组、Stattic组、单纯照射组和联合组。照射后48 h提取蛋白,裂解细胞时加入2×loading蛋白上样缓冲液,95℃加热5 min,用10%SDS-PAGE蛋白电泳分离样品,湿转法转至PVDF膜。5%脱脂奶粉室温封闭2 h,加入STAT3(1∶1 000)、p-STAT3(1∶2 000)、Caspase-3(1∶1 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)和β-肌动蛋白(1∶5 000)抗体,4℃孵育过夜,加入辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,ECL化学发光检测显影,在凝胶成像系统上拍照并分析。
10. 统计学处理:计量数据以x±s表示,采用SPSS 17.0软件进行分析,IC50的CCK8数据应用单因素方差分析,4组之间比较的CCK8数据应用双因素方差的协因分析,Transwell数据及细胞存活分数进行配对t检验。P<0.05为差异有统计学意义。
1. Stattic对Bel-7402细胞增殖抑制的影响:CCK8结果表明不同浓度的Stattic对Bel-7402细胞的增殖有不同程度的抑制作用,并且其增殖抑制作用随Stattic浓度的增加而增强,各浓度组总体上比较,差异有统计学意义(F=1 861.74,P<0.05)。与空白对照组比较,Bel-7402细胞1、2、4、8、16、32 μmol/L Stattic组细胞生存率降低,差异均有统计学意义(t=6.82、8.23、65.38、48.17、105.54、69.51,P<0.05),而0.5 μmol/L Stattic组细胞生存率差异均无统计学意义。为排除Stattic本身对细胞生长的抑制作用,选用1 μmol/L进行联合组CCK8实验[7]。根据浓度和细胞存活率利用Graphpad Prism 5.0软件计算Stattic作用48 h的IC50为(2.54±0.20)μmol/L。
2. Stattic联合X射线照射对Bel-7402细胞增殖抑制的影响:在Bel-7402中,8 Gy X射线照射组细胞存活率为59%±1%,1.0 μmol/L Stattic组细胞存活率为91%±2%,联合组细胞存活率为48%±2%,与空白对照组相比,单纯照射组(8 Gy)和Stattic组(1 μmol/L)差异有统计学意义(F=2 401.45、282.83,P<0.05),且X射线照射和Stattic存在协同作用(F=63.30,P<0.05)。
3. Stattic联合照射对Bel-7402细胞迁移的抑制作用:采用划痕实验观察低细胞毒性剂量(1 μmol/L)Stattic及低剂量照射(4 Gy)对Bel-7402细胞的迁移影响,发现Stattic组划痕宽度有所变窄,而单纯照射组细胞划痕宽度小于空白对照组,接近愈合;而Stattic联合照射组划痕宽度最大,超过Stattic组,见图 1。提示低剂量照射在划痕48 h后细胞的迁移能力反而有所提升,单用1 μmol/L的Stattic,即可抑制肝癌细胞Bel-7402的迁移能力,但联合组与Stattic组相比,迁移能力抑制更为明显。
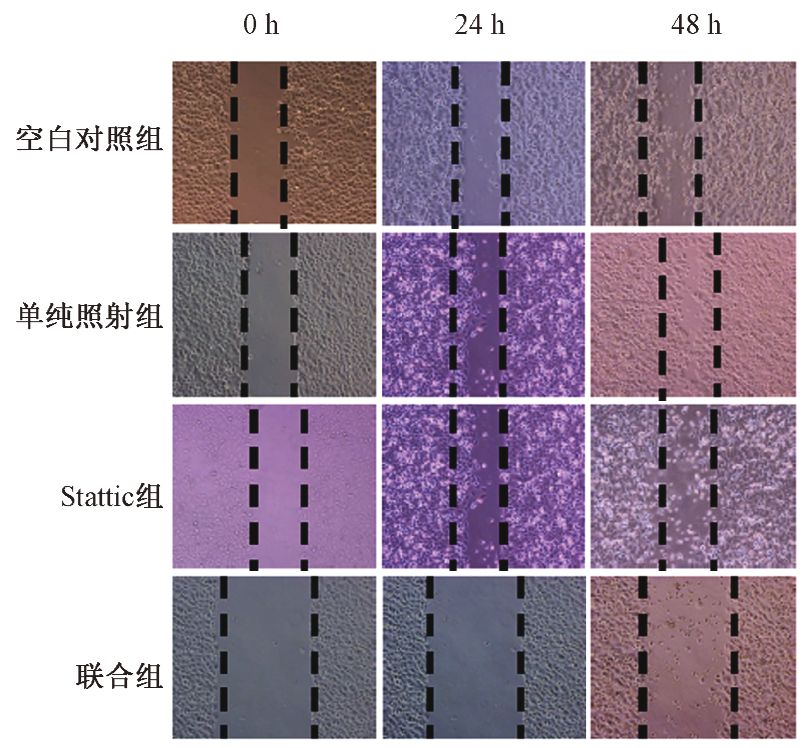 |
图 1 Bel-7402细胞的迁移变化×100 |
4. Stattic联合照射对Bel-7402细胞侵袭的抑制作用:4组之间Bel-7402细胞侵袭能力在倒置显微镜100倍镜下如图 2所示,1 μmol/L的Stattic及4 Gy的X射线照射对Bel-7402细胞的侵袭能力均有影响,发现Stattic组细胞侵袭能力减弱,而单纯照射组细胞侵袭能力超过空白对照组;而Stattic联合照射组细胞侵袭能力最弱,超过Stattic组,提示4 Gy照射后细胞的侵袭能力反而有所提升,单用1 μmol/L 的Stattic即可抑制肝癌细胞Bel-7402的侵袭能力,但联合组与Stattic组相比,侵袭能力抑制更为明显。倒置显微镜观察各处理组细胞透膜细胞数,与空白对照组相比,单纯照射组透膜细胞数增多(t=-4.80,P<0.05),Stattic组透膜细胞数降低(t=8.72,P<0.05),联合组与单纯照射组比较,透膜细胞数降低,差异有统计学意义(t=-14.06,P<0.05)。
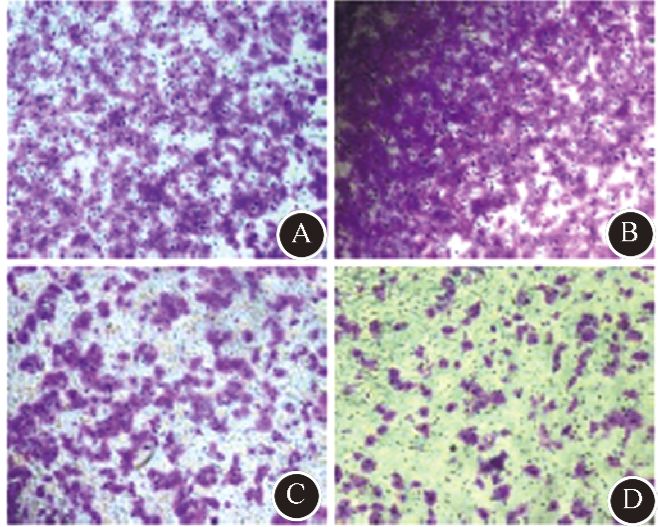 |
图 2 各处理组Bel-7402细胞的侵袭情况 结晶紫染色 ×100 A.空白对照组;B.单纯照射线;C.Stattic组;D.联合组 |
5. Stattic对Bel-7402细胞放射敏感性的影响:0 Gy的PE为(74±7)%,适合克隆形成实验。为扣除Stattic本身对实验结果的影响,本实验以联合组0 Gy的SF为基准,对联合组的SF进行校正,从而得到Stattic的放射增敏作用的相关生物学参数[8]。根据克隆形成实验的结果,拟合生存曲线见图 3,所得放射生物学参数见表 1,相应的放射增敏比SERD0为1.65,SERDq为1.08,SERSF2为1.22,说明Stattic对Bel-7402细胞有放射增敏作用。
 |
图 3 Stattic对Bel-7402剂量生存曲线的影响 |
|
|
表 1 Bel-7402细胞单纯照射组和联合组的放射生物学参数 |
6. Stattic联合照射对Bel-7402细胞中STAT3,p-STAT3、MMP-2及MMP-9蛋白表达的影响:如图 3所示,与空白对照组相比,4 Gy照射可提高 p-STAT3及MMP-2,MMP-9蛋白的表达水平(t=-4.03、-5.12、-6.86,P<0.05),给予1 μmol/L的Stattic可使蛋白表达不同程度降低。而X射线联合Stattic可显著降低p-STAT3、MMP-2及MMP-9蛋白的表达水平,其表达明显低于单纯照射组(t=5.32、6.02、13.26,P<0.05)。各组Bel-7402细胞的STAT3蛋白表达水平无明显差异。
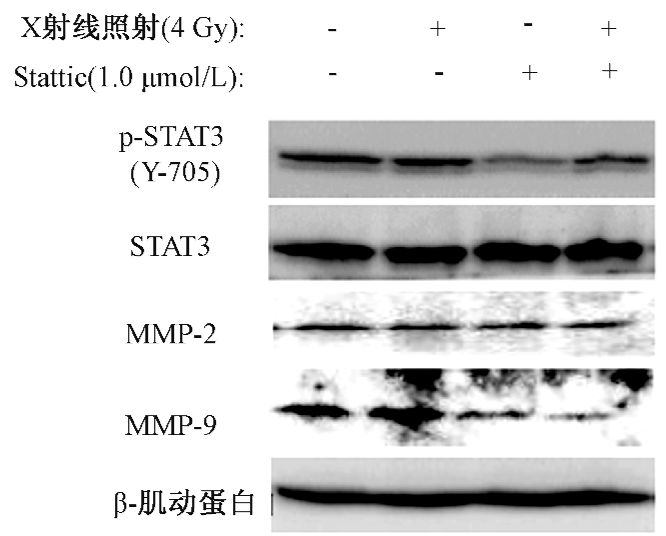 |
图 4 Stattic联合X射线照射对Bel-7402细胞中侵袭相关蛋白的影响 |
7. Stattic联合照射对Bel-7402细胞中STAT3,p-STAT3及凋亡相关蛋白表达水平的影响:如图 5所示,接近IC50剂量的Stattic 2.5 μmol/L和8 Gy的X射线照射对Bel-7402细胞中的STAT3蛋白表达影响不明显。X射线照射可上调p-STAT3蛋白表达,同时Stattic可显著下调p-STAT3蛋白(t=-9.95、12.35,P<0.05),联合组p-STAT3蛋白表达较单照射组相比有所降低(t=5.34,P<0.05)。与空白对照组相比,单纯照射组和Stattic组均可增加Bax和Cleaved Caspase-3蛋白的表达,下调Bcl-2蛋白表达(t=-20.32、-16.78、4.13,P<0.05),但与单纯照射组相比,联合组Bax、Cleaved Caspase-3蛋白表达上升(t=-7.82、-14.09,P<0.05),Bcl-2蛋白表达下降(t=18.43,P<0.05)。各组Bel-7402细胞的β-肌动蛋白表达水平无明显差异。
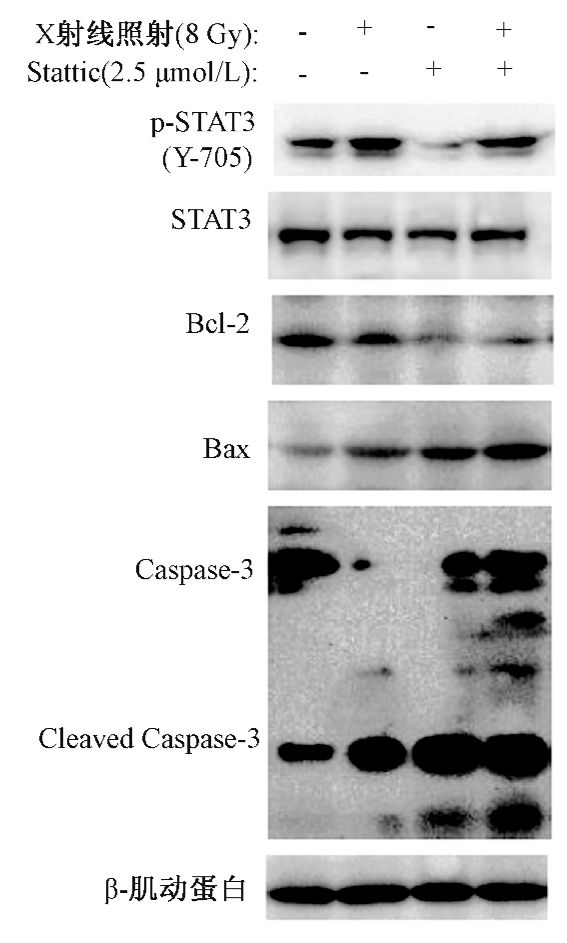 |
图 5 Stattic联合X射线照射对Bel-7402细胞中凋亡相关蛋白表达水平的影响 |
在人体正常细胞和组织中,STAT3可以短暂激活和失活,调控正常的生理功能,但是在许多恶性肿瘤中STAT3却是持续激活的[9]。这种持续激活的STAT3可以诱导相关基因的活化,促进肿瘤细胞的增殖和抑制凋亡,从而促进肿瘤发生。在肝脏中,Calvisi等[10]发现,在肝癌组织中STAT3蛋白的磷酸化表达比癌旁组织和正常肝脏组织明显升高。He等[11]第1次分离出最终导致肝细胞癌的祖细胞,发现由于它们可以自分泌IL-6,激活IL-6/STAT3信号通路,导致最终发展成为肝癌细胞,这一研究表明STAT3在肝癌的发生发展中占有重要地位。本研究首次在肝癌细胞中应用STAT3抑制剂 Stattic,发现Stattic降低了肝癌Bel-7402细胞中p-STAT3表达水平,并通过CCK8实验证明了Stattic可以抑制肝癌细胞的生长。其机制可能与Stattic诱导凋亡有关,Pan等[12]在鼻咽癌的研究中发现Stattic能够上调Cleaved Caspase-3的水平,并抑制增殖蛋白CyclinD1蛋白的表达。而本研究在肝癌细胞中应用Stattic同样上调了凋亡蛋白Cleaved Caspase-3的水平,同时还发现,Stattic可以下调抗凋亡蛋白Bcl-2水平,上调促凋亡蛋白Bax水平。所以,Stattic可能通过抑制STAT3的磷酸化激活,上调CyclinD1、Bax、Cleaved Caspase-3蛋白表达,下调Bcl-2蛋白表达,从而减少增殖和增强凋亡,最终抑制了肝癌细胞的生长。
异常激活的STAT3信号不仅能够通过抑制凋亡和诱导细胞增殖促进肿瘤的产生和增殖,还能够促进肿瘤的血管形成、侵袭和转移[9]。Cheng等[13]发现在乳腺癌细胞中激活的STAT3蛋白可以连接到Twist启动子上,从而诱导Twist转录和过表达。同时,Zhao等[14]发现在肝癌细胞中Twist通过激活MMP-2,MMP-9促进肿瘤的侵袭。本研究中,发现4 Gy照射组侵袭能力增强,而且随着照射p-STAT3的活化及MMP-2、MMP-9蛋白的表达也随之升高,尤其是MMP-9蛋白表达上调明显,这与Cheng等[15]发现辐射能够促进肝癌细胞中MMP-9表达从而促进肝癌的侵袭结果一致。Cheng等[13]应用STAT3-shRNA抑制了STAT3的表达,降低了乳腺癌细胞的迁移和侵袭。在本研究中,不仅首次发现Stattic可以降低肝癌Bel-7402的迁移和侵袭,而且发现Stattic可以降低放疗后增加的侵袭。这可能与Stattic能够有效抑制放疗后激活的STAT3,阻止Twist的转录,从而下调MMP-2和MMP-9表达相关。
最新研究表明,在恶性肿瘤中STAT3通路还能够介导放疗抵抗。Gao等[16]发现X射线可以激活肺腺癌A549细胞中的STAT3,并且呈现出时间和剂量的依赖性。本研究中,发现X射线照射同样可以上调肝癌细胞中p-STAT3的蛋白表达,Stattic能够下调照射后激活的p-STAT3蛋白表达。同时,通过剂量存活曲线和放射敏感性相关参数分析发现,与单纯照射组细胞相比,应用Stattic后细胞的存活曲线下移明显,在小剂量时,肩区变小,随着剂量增加存活曲线下降趋势更加明显,D0、Dq和SF2值均降低,这代表STAT3抑制后可以抑制细胞照射后的亚致死性损伤修复,说明Stattic增加了肝癌细胞的放射敏感性。本研究结果显示,Stattic能够降低STAT3引起的照射抵抗。但是其下游机制仍不明确。
凋亡相关Bcl-2家族蛋白和Caspase-3蛋白不仅与恶性肿瘤的发生发展密切相关,而且参与了放疗诱导的细胞凋亡[17]。本研究中发现 Stattic和放射治疗分别能诱导凋亡蛋白的改变,与单纯照射组和单独用药组相比,联合组凋亡蛋白的改变更加显著,说明Stattic有可能是通过诱导凋亡增加而实现放疗增敏的。在其他研究中亦有类似报道,如Pan等[12]和Adachi等[18]研究发现,与单纯照射组相比,Stattic联合照射组分别明显增加了鼻咽癌细胞和头颈部鳞癌的凋亡。因此,诱导细胞凋亡增加可能是Stattic增强细胞放射敏感的机制之一。
综上所述,本实验研究了Stattic对肝癌细胞生长的抑制及联合放射治疗对肝癌细胞迁移和侵袭的影响,并对其放射增敏机制进行了初步探索,希望能够为肝癌放射增敏的应用提供实验依据和理论基础。
| [1] | Ren ZG, Zhao JD, Gu K, et al. Three-dimensional conformal radiation therapy and intensity-modulated radiation therapy combined with transcatheter arterial chemoembolization for locally advanced hepatocellular carcinoma: an irradiation dose escalation study[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2):496-502. |
| [2] | Gao B, Wang H, Lafdil F, et al. STAT proteins-key regulators of anti-viral responses, inflammation, and tumorigenesis in the liver[J]. J Hepatol, 2012, 57(2):430-441. |
| [3] | Frank DA. STAT3 as a central mediator of neoplastic cellular transformation[J]. Cancer Lett, 2007, 51(2):199-210. |
| [4] | Yu H, Jove R. The STATs of cancer—new molecular targets come of age[J]. Nat Rev Cancer, 2004, 4(2):97-105. |
| [5] | 周菊英,徐晓婷,李晓庆,等. 塞来昔布对人肺腺癌细胞株A549的放射增敏效应及细胞迁移力的影响[J]. 中华放射医学与防护杂志, 2010,30(5):564-567. |
| [6] | 闫洪亮,吴维光,王筝,等. 组蛋白去乙酰化酶抑制剂MS-275对人宫颈癌SiHa细胞迁移和侵袭的影响[J]. 国际妇产科学杂志, 2014,21(2):191-193. |
| [7] | 张兰兰,彭苹,吴炳义. 阿司匹林对人胶质母细胞瘤U87细胞系放射敏感性的影响[J]. 中华神经医学杂志, 2011, 10(11):1110-1114. |
| [8] | 姚建新,姚志峰,刘永彪. 西妥昔单抗对乳腺癌MDA-MB-231细胞放射敏感性影响的研究[J]. 中华肿瘤防治杂志, 2013, 20(12):898-903. |
| [9] | Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2):136-154. |
| [10] | Calvisi DF, Ladu S, Gorden A, et al. Ubiquitous activation of Ras and Jak/Stat pathways in human HCC[J]. Gastroenterology, 2006, 130(4):1117-1128. |
| [11] | He G, Dhar D, Nakagawa H, et al. Identification of liver cancer progenitors whose malignant progression depends on autocrine IL-6 signaling[J]. Cell, 2013, 155(2):384-396. |
| [12] | Pan Y, Zhou F, Zhang R, et al. Stat3 inhibitor Stattic exhibits potent antitumor activity and induces chemo-and radio-sensitivity in nasopharyngeal carcinoma[J]. PLoS One, 2013, 8(1):e54565. |
| [13] | Cheng GZ, Zhang WZ, Sun M, et al. Twist is transcriptionally induced by activation of STAT3 and mediates STAT3 oncogenic function[J]. J Biol Chem, 2008, 283(21):14665-14673. |
| [14] | Zhao XL, Sun T, Che N, et al. Promotion of hepatocellular carcinoma metastasis through matrix metalloproteinase activation by epithelial-mesenchymal transition regulator twist1[J]. J Cell Mol Med, 2011, 15(3):691-700. |
| [15] | Cheng JC, Chou CH, Kuo ML, et al. Radiation-enhanced hepatocellular carcinoma cell invasion with MMP-9 expression through PI3K/Akt/NF-kappaB signal transduction pathway[J]. Oncogene, 2006, 25(53):7009-7018. |
| [16] | Gao L, Li FS, Chen XH, et al. Radiation induces phosphorylation of STAT3 in a dose-and time-dependent manner[J]. Asian Pac J Cancer Prev, 2014, 15(15):6161-6164. |
| [17] | 王凤玮,梁克,沈瑜,等. 凋亡与放射治疗[J]. 中华放射肿瘤学杂志, 1997, 6(3):192-194. |
| [18] | Adachi M, Cui C, Dodge CT, et al. Targeting STAT3 inhibits growth and enhances radiosensitivity in head and neck squamous cell carcinoma[J]. Oral Oncol, 2012, 48(12):1220-1226. |
 2015,Vol. 35
2015,Vol. 35