2. 美国纪念斯隆凯特琳癌症中心
肠道是人体快速更新的器官之一,隐窝是肠道细胞增殖的能量库。肠道干细胞位于隐窝基底部,对于维持肠道的动态平衡以及受损后的修复再生起至关重要的作用。肠道具有很高的辐射敏感性,因其蜿蜒的结构及其与腹腔、盆腔内各器官相毗邻,在放射治疗腹腔与盆腔部位肿瘤,以及骨髓移植前全身辐射过程中,对肠道的损伤是首要考虑因素,其不良反应往往是临床提高放射剂量的限制因素。以往对于胃肠型急性放射病的研究和防治,绝大多数均着重于小肠的观察[1],然而有关大肠在全身或腹部受电离辐射后的损伤、修复和再生规律,尚缺乏系统的报道。本研究探讨高剂量辐射下大肠和小肠放射敏感性的差异,并探讨干细胞在大肠和小肠放射敏感性差异中的作用。
1. 动物与主要试剂:清洁级雄性C57BL/6小鼠,体重(28±5)g,由美国纪念斯隆凯特琳癌症研究中心动物中心提供。一抗兔抗小鼠活性Caspase-3抗体购自美国Cell Signaling公司,兔抗小鼠Ki67抗体购自美国BD公司,二抗山羊抗兔抗体购自美国Santa Cruze公司,3-3'-二氨基联苯胺及苏木精染液均购自美国Vector公司,干细胞标志物Lgr5检测试剂盒购自美国Affymetrix公司。
2. 动物分组、照射与样品处理:选取成年6~8周小鼠,完全随机法分为照射组和健康对照组,每组4~5只小鼠,照射组接受全身19 Gy照射,实验共重复4次。照射源为美国纪念斯隆凯特琳癌症研究中心137Cs γ源,吸收剂量率为1.76 Gy/min。
3. 病理学检测:小鼠全身辐射后 6、12、24、48、72和96 h以CO2处死,剖取空肠组织,大肠部分截取从肛门以上至2.5 cm处,小肠部分截取距离胃3 cm后的部分,长度约为2 cm,PBS冲洗干净,置于4%中性多聚甲醛内固定18~24 h,常规方法石蜡包埋,制作5 μm切片,HE染色进行病理学检测。
4. 小鼠肠黏膜上皮细胞凋亡检测:采用活性Caspase-3免疫组织化学染色法进行细胞凋亡的检测。石蜡切片常规脱蜡水合后,置于0.01 mol/L枸橼酸缓冲液中进行抗原热修复20 min,室温冷却后用3%过氧化氢去除内源性过氧化物酶,按常规方法室温封闭后滴加1[DK]∶100的兔抗小鼠Caspase-3抗体,于湿盒中4℃孵育过夜后,PBS冲洗,辣根过氧化物酶标记的羊抗兔二抗孵育,3-3'-二氨基联苯胺显色,苏木精复染,二甲苯透明,脱水、封片后镜检。在显微镜下凋亡细胞为棕褐色,计数整个标本所有肠隐窝的阳性细胞,计算单个隐窝凋亡细胞数,同时计数含有凋亡细胞的隐窝数占整个肠横截面周长总隐窝数的比例即隐窝凋亡指数。
5. 小鼠肠黏膜隐窝干细胞标记物检测:按照试剂盒说明书提供的步骤,用原位杂交的方法检测大小肠干细胞标记物Lgr5。红色点状物为Lgr5的mRNA拷贝,1个阳性点代表 1个Lgr5 mRNA拷贝,判断含3个及以上拷贝数的阳性细胞为干细胞。同时,采用连续切片结合Caspase-3组织化学法和原位杂交的方法,以Lgr5作为干细胞的标志,检测受照后不同时间点大肠和小肠隐窝内干细胞数目以及干细胞凋亡的动力学变化。
6. 小鼠肠黏膜上皮细胞增殖检测:采用Ki67免疫组织化学染色法。具体染色步骤同前,光镜下见到细胞核着深褐色者为阳性细胞。含≥5个连续Ki67阳性细胞的隐窝为具有增殖活性的隐窝,具有增殖活性隐窝占整周(circumference)隐窝数的比例即隐窝增殖指数。
7. 统计学处理:数据用x±s表示。采用Origin 7.5软件进行统计和作图,不同处理组间采用t检验进行分析。P< 0.05为差异有统计学意义。
1. 高剂量辐射后大肠和小肠组织病理变化:如图 1所示,对照组中,小肠黏膜面绒毛覆盖完整,大肠和小肠隐窝内细胞均排列紧密有序。照后6~12 h,大肠和小肠整体结构与对照组相比无明显差异,照后24 h小肠内可见绒毛萎缩、脱落,隐窝变浅并开始出现大量细胞死亡,48 h小肠绒毛进一步萎缩,黏膜下剩余个别透明样残存隐窝,至72、96 h已无法观察到存活的隐窝结构;与之相反的是,大肠内照后6~48 h隐窝结构无显著性变化,至照后72~96 h,隐窝长度变短,但结构仍相对完整,表明大肠比小肠更为辐射耐受。
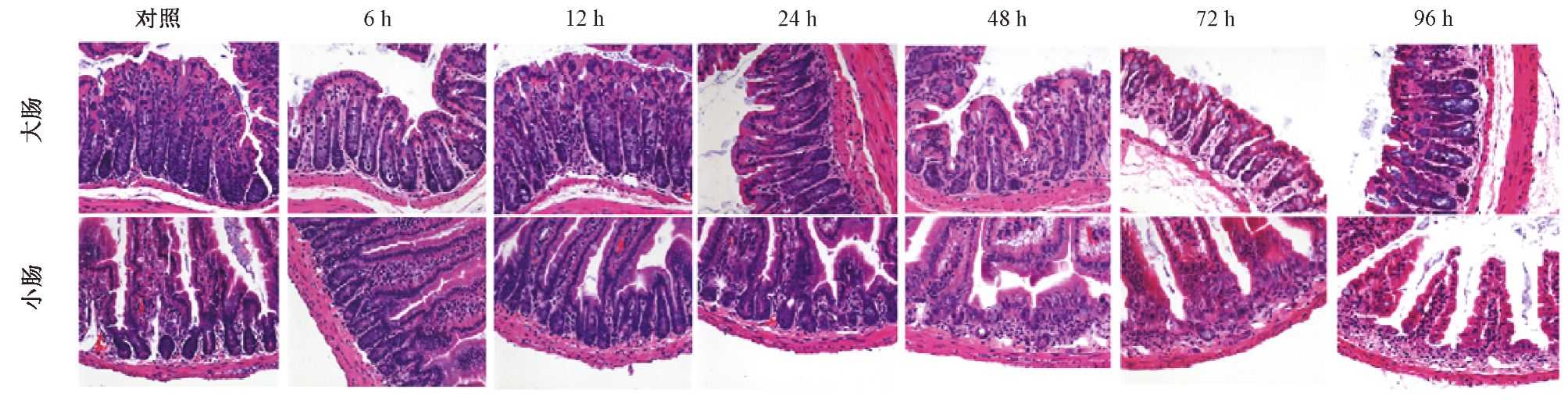 |
图 1 小鼠全身受照后不同时间大肠与小肠的镜下表现 HE染色 ×200 |
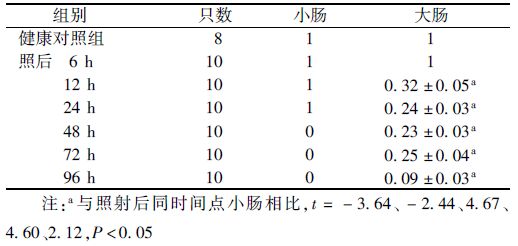
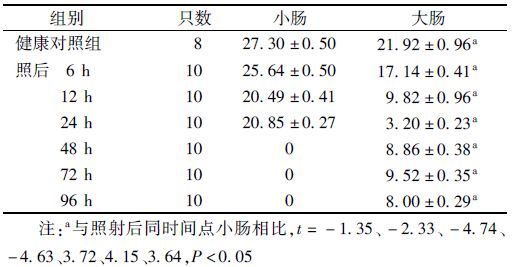
2. 高剂量辐射后小鼠大小肠隐窝细胞Ki67的表达:图 2结果显示,Ki67染色显示大小肠的对照样本均呈强阳性,证明在大小肠隐窝底部的细胞增殖活跃。由表 1可知,受照后6 h,大小肠隐窝与未受照的对照样本增殖指数水平相当。受照后12 h大肠增殖指数下降至0.32,24 h继续降至0.02,均显著低于同时间点小肠 (t=-3.21、-2.17,P<0.05);受照后48 h小肠隐窝增殖指数急剧下降至0,至照后72、96 h仍未见恢复;而大肠隐窝增殖指数在照后48~72 h则开始恢复升至0.23和0.24,说明大肠隐窝开始再生,但96 h又下降至0.09。计算Ki67阳性细胞数则显示,辐射后6、12、24 h大小肠隐窝内Ki67阳性细胞数均持续下降,但各时间点大肠内Ki67阳性细胞数低于小肠,且差异具有统计学意义(t=-2.33、-4.74、-4.63,P<0.05);照后48、72、96 h大肠隐窝内Ki67阳性细胞数则显著高于小肠(t=3.72、4.15、3.64,P<0.05,表 2)。
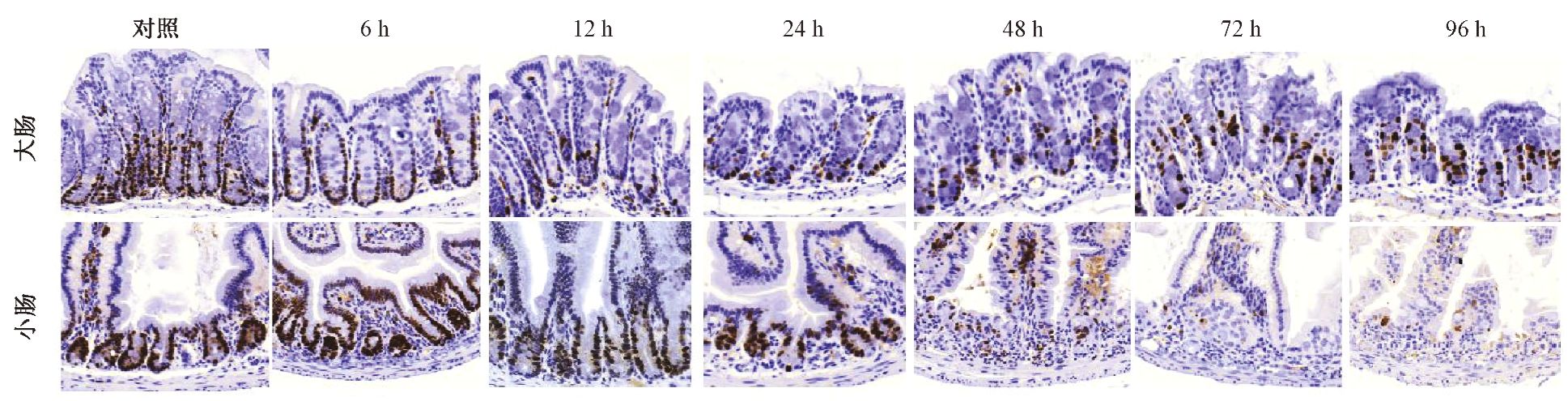 |
图 2 小鼠全身受照后不同时间大肠和小肠隐窝细胞增殖活性变化 Ki67免疫组织化学染色 ×200 |
|
|
表 1 γ射线照射后不同时间小鼠大肠和小肠隐窝增殖指数(x±s) |
|
|
表 2 照射后不同时间小鼠大肠和小肠单个隐窝Ki67阳性细胞数(x±s) |
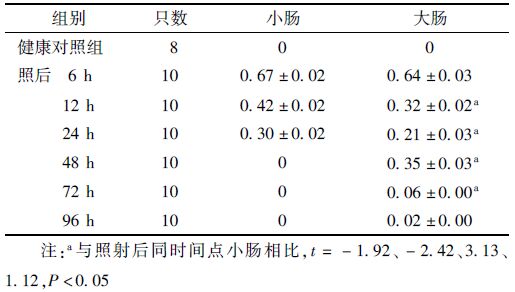
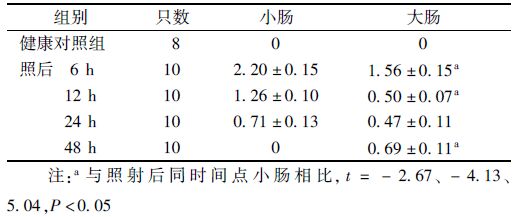
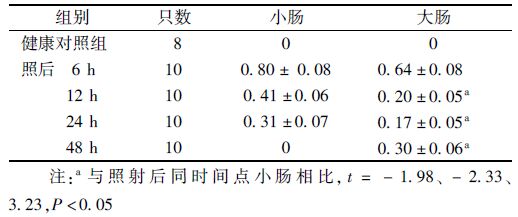
3. 高剂量照后小鼠肠隐窝上皮细胞凋亡变化:表 3显示,照后6 h小肠内隐窝凋亡指数达到峰值0.66,随后其隐窝凋亡指数随辐射后时间的延长逐步下降,至照后48 h,由于隐窝结构崩解已无法观察到凋亡的隐窝;大肠的隐窝凋亡指数在照后0~24 h与小肠的动力学变化趋势相似,同样在照后6 h达到高峰,与小肠相比无显著差异性,随后在照后12、24 h分别降至0.32和0.21,均显著低于同样时间点小肠的隐窝凋亡指数(t=-1.92、-2.42,P<0.05)。与小肠明显不同的是,照后48 h大肠内出现第2个凋亡峰,即发生二次凋亡(second apoptosis),其隐窝凋亡指数为0.35,受照后72、96 h则分别降至0.06和0.02。隐窝内凋亡细胞数如表 4所示,照后6、12 h大肠的凋亡细胞数显著低于小肠 (t=-2.67、-4.13, P<0.05),表明小肠隐窝细胞较大肠的放射敏感性更高。
|
|
表 3 照射后不同时间小鼠大肠和小肠隐窝凋亡指数(x±s) |
|
|
表 4 照射后不同时间小鼠大肠和小肠单个隐窝凋亡细胞数(x±s) |
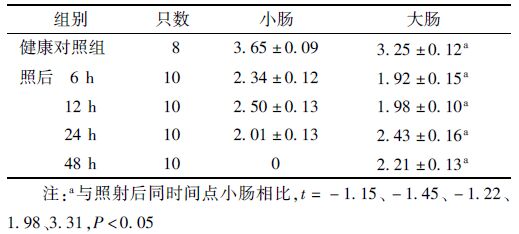
4. 高剂量辐射小鼠隐窝干细胞动力学变化:图 3结果显示对照大肠小肠的干细胞均集中于隐窝基底部。受照前小肠单个隐窝内的平均干细胞个数为3.65,大肠为3.25,二者差异具有统计学意义(t=-1.15,P <0.05),提示常态下小肠细胞更新较大肠活跃。受照后6和12 h大小肠单个隐窝内的平均干细胞数均急剧下降,小肠中分别为2.34和2.50,仍显著高于同时间点大肠(1.92和1.98)。但受照后24 h大肠干细胞数上升至2.43,为受照后的峰值,并显著高于同时间点小肠(t=1.98,P<0.05)。至照后48 h小肠内干细胞数降至0;而大肠单个隐窝内的平均干细胞数则维持于2.21,同样显著高于该时间点小肠(t=3.31,P<0.05,表 5)。
 |
图 3 小鼠全身受照后不同时间大小肠隐窝干细胞动力学变化 Lgr5原位杂交染色 ×200 |
|
|
表 5 照射后不同时间小鼠大肠小肠单个隐窝干细胞数(x±s) |
小鼠全身受照后大小肠干细胞凋亡高峰均出现在照后6 h,但该时间点单个隐窝内的干细胞平均凋亡数差异无统计学意义,随后小肠内的干细胞凋亡数持续下降,但凋亡数显著高于同时间点大肠(12 h:t=-1.98,P<0.05;24 h:t=-2.33,P<0.05,表 6);大肠则在照后48 h出现了第2个凋亡峰,提示大肠内部分干细胞在照射后发生2次凋亡。
|
|
表 6 照射后不同时间小鼠大肠小肠单个隐窝凋亡干细胞数(x±s) |
肠上皮细胞对辐射敏感,是腹腔恶性肿瘤进行放疗的主要效应细胞之一。小肠和大肠具有相似的组织结构,但二者的辐射敏感性却存在显著差异。Yeoh等[2]发现,给予总剂量为45 Gy(2.5 Gy/次)6周的分割照射,大鼠小肠的受损程度远高于大肠;同样,本实验HE结果也表明小肠的放射敏感性远高于大肠。
Ki67是一种核抗原,细胞各期(G1-S-G2-M)均有表达[3],但细胞处于静息期(G0)时Ki67染色则为阴性[4],因此,被认为是细胞增殖的经典标志。本实验中,照后48 h小肠内已无法检测到具有Ki67阳性的隐窝及隐窝内细胞,表明该剂量可导致小肠失去有再生能力的细胞,隐窝无法恢复;而相同时间点大肠内Ki67阳性的隐窝比例仍高达25%,表明该时间点大肠仍具有部分增殖活性,由于受照2 d后肠隐窝基底细胞的存活情况可以预测整个隐窝的再生能力[5],该结果同样证明大肠较小肠具有更高的辐射耐受性。值得注意的是,Ki67抗原在照后小肠大肠内的表达方式和位置存有显著差异,小肠内隐窝Ki67表达在照后6~24 h与对照相比无差异,且集中于隐窝底部,48 h表达急剧下降,而大肠隐窝内Ki67的表达在照后6~24 h即急剧下降,且表达位置也随照后时间的延长逐步上移,即照后48~72 h大肠隐窝底部Ki67阴性细胞明显增多,提示高剂量辐射可诱导大肠隐窝底部细胞由增殖期向静息期转变,这种转变可能与大肠隐窝细胞辐射损伤后干细胞区进行修复有关,有研究发现,肠道隐窝底部静息细胞对高剂量辐射十分耐受[6],这也可能是大肠较小肠辐射耐受的原因之一。
凋亡是细胞受辐射后主要的损伤效应之一[7],辐射可诱导肠上皮细胞发生凋亡,这已是公认的事实,有研究表明小肠受低至0.05 Gy的 辐射即可检测到上皮细胞的损伤效应[8]。而当剂量升至8 Gy时,隐窝细胞凋亡率在照后3~4 h出现第一个峰值,随后下降,但在照后24 h出现二次凋亡峰,且凋亡率远高于照后3~4 h水平[9, 10]。Castedo等[11]认为,二次凋亡来自于细胞有丝分裂死亡,其产生的机制与辐射引起的一过性凋亡不同,即发生二次凋亡的细胞在受照后的第一个细胞周期虽然存活下来,但由于携带有未完全修复的DNA损伤无法通过M期,产生有丝分裂死亡 (mitotic death)。与上述辐射剂量诱导的隐窝细胞凋亡动力学变化不同的是,19 Gy辐射后小鼠小肠隐窝细胞仅在照后6 h达到凋亡高峰,随后隐窝凋亡率随照后时间下降,但隐窝无法重建。而大肠内,除在照后6 h出现细胞凋亡率峰值外,在照后48 h也再度达到凋亡峰值,这提示高剂量电离辐射下,除细胞凋亡外,有丝分裂死亡也是辐射诱导大肠隐窝细胞死亡的机制之一。与之前的报道相同,本实验发现高剂量辐射下小肠隐窝上皮细胞的凋亡显著高于大肠,这可能与抑凋亡基因bcl-2在大肠内正常表达而在小肠内缺失有关。
干细胞对于辐射后肠道的修复和重建十分重要,然而对于辐射后肠道干细胞的生物学反应的相关数据仍十分有限[12]。Lgr5(富含亮氨酸重复序列G蛋白偶联受体5),又名GPR49,是G蛋白偶联受体家族的成员之一,是Wnt通路的下游蛋白[13],其生理配体是R-spondins家族蛋白,二者结合可强化Wnt/β联蛋白信号通路,在胚胎发育中起重要作用[14]。最近,Lgr5被证明是肠道干细胞的标志物,在大小肠隐窝基地柱状细胞上高表达,且Lgr5阳性CBC细胞及其后代能够形成整个肠道的隐窝-绒毛单元,并可维持自我更新达70 d之久,其后代可分化为各类黏膜细胞[15, 16, 17],满足人们对于干细胞的定义。本实验采用原位杂交技术检测Lgr5,使得精确定位干细胞成为可能,结合连续切片和Caspase免疫组织化学染色,即可获知高剂量辐射对大肠小肠内干细胞的损伤效应。本研究发现小肠内干细胞凋亡数显著高于大肠,表明小肠干细胞较大肠更为辐射敏感。同本研究的结果类似,有研究报道,当小肠受12 Gy照射后,Lgr5阳性细胞在短时间内迅速凋亡[6]。比较二者干细胞数变化发现,小肠隐窝内干细胞数在辐射后6~48 h持续下降,而大肠隐窝内在辐射后12~48 h干细胞数高于辐射后6 h干细胞数,这提示照后12~48 h大肠干细胞进行了更新和修复,且修复能力高于小肠,推测干细胞的修复能力差异可能是大肠更为耐受辐射的主要原因。但是,大肠的修复作用仍有一定限度,在24 h有一定幅度的增加,但随即又趋减少,提示小鼠大肠干细胞受高剂量辐射后的修复存在上限。
综上所述,本实验证明高剂量辐射条件下,大肠小肠存在明显的辐射敏感差异性,而二者干细胞辐射敏感性的差异可能是决定大肠较小肠更为辐射耐受的原因之一,但其中的具体机制尚需进一步深入研究。
| [1] | 常鹏宇,崔爽,曲雅勤. 间充质干细胞修复放射性肠损伤的机制探讨[J]. 中华放射医学与防护杂志, 2013, 33(5): 565-568. |
| [2] | Yeoh AS, Gibson RJ, Yeoh EE, et al. A novel animal model to investigate fractionated radiotherapy-induced alimentary mucositis: the role of apoptosis, p53, nuclear factor-kappaB, COX-1, and COX-2[J]. Mol Cancer Ther, 2007, 6(8): 2319-2327. |
| [3] | Falato C, Lorent J, Tani E, et al. Ki67 measured in metastatic tissue and prognosis in patients with advanced breast cancer[J]. Breast Cancer Res Treat, 2014, 147(2): 407-414. |
| [4] | Hutchins JR, Toyoda Y, Hegemann B, et al. Systematic analysis of human protein complexes identifies chromosome segregation proteins[J]. Science, 2010,328(5978): 593-599. |
| [5] | Hua G, Thin TH, Feldman R, et al. Crypt base columnar stem cells in small intestines of mice are radioresistant[J]. Gastroenterology, 2012, 143(5): 1266-1276. |
| [6] | Yan KS, Chia LA, Li X, et al. The intestinal stem cell markers Bmi1 and Lgr5 identify two functionally distinct populations[J]. Proc Natl Acad Sci USA, 2012, 109(2): 466-471. |
| [7] | Jung E, Perrone EE, Brahmamdan P, et al. Inhibition of intestinal epithelial apoptosis improves survival in a murine model of radiation combined injury[J]. PLoS One, 2013, 8(10): e77203. |
| [8] | Potten CS. A comprehensive study of the radiobiological response of the murine (BDF1) small intestine[J]. Int J Radiat Biol, 1990, 58(6): 925-973. |
| [9] | Merritt AJ, Potten CS, Kemp CJ, et al. The role of p53 in spontaneous and radiation-induced apoptosis in the gastrointestinal tract of normal and p53-deficient mice[J]. Cancer Res, 1994, 54(3): 614-617. |
| [10] | Potten CS. Radiation, the ideal cytotoxic agent for studying the cell biology of tissues such as the small intestine[J]. Radiat Res, 2004, 161(2): 123-136. |
| [11] | Castedo M, Perfettini JL, Roumier T, et al. Cell death by mitotic catastrophe: a molecular definition[J]. Oncogene, 2004, 23(16): 2825-2837. |
| [12] | Sokolov M, Neumann R. Lessons learned about human stem cell responses to ionizing radiation exposures: a long road still ahead of us[J]. Int J Mol Sci, 2013,14(8): 15695-15723. |
| [13] | Van der Flier LG, Sabates-Bellver J, Oving I, et al. The Intestinal Wnt/TCF Signature[J]. Gastroenterology, 2007, 132(2): 628-632. |
| [14] | Carmon KS, Gong X, Lin Q, et al. R-spondins function as ligands of the orphan receptors LGR4 and LGR5 to regulate Wnt/beta-catenin signaling[J]. Proc Natl Acad Sci USA, 2011, 108(28): 11452-11457. |
| [15] | Muñoz J, Stange DE, Schepers AG, et al. The Lgr5 intestinal stem cell signature: robust expression of proposed quiescent'+4' cell markers[J]. EMBO J, 31(14): 3079-3091. |
| [16] | Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449(7165): 1003-1007. |
| [17] | Sato T, Vries RG, Snippert HJ, et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche[J]. Nature, 2009, 459(7244): 262-265. |
 2015,Vol. 35
2015,Vol. 35