放射性肺纤维化属于临床常见的难治性疾病。目前,针对该疾病主要以大剂量皮质类固醇激素冲击治疗和肺移植。后者虽然被认为是治疗放射性肺纤维化的有效手段,但肺源不足仍是限制肺移植应用的主要因素。
近来,利用间充质干细胞(mesenchymal stem cells,MSC)修复特发性肺纤维化的基础研究在国内外开展较为普遍。相关结果表明,MSC通过发挥抗炎及促上皮细胞再生的作用来抑制肺纤维化的进展[1]。针对MSC对放射性肺损伤的临床前研究也取得了一定的进展。相关动物实验研究结果表明,MSC对急性放射性肺损伤具有一定的治疗作用[2]。放射性肺炎病理生理进展的最终结果为间质性肺纤维化,是一种不可逆的损伤[3]。基于此,本研究将利用人脂肪来源的间充质干细胞(adipose-derived MSC,Ad-MSC)来治疗辐射引起的肺纤维化,评价Ad-MSC是否对放射性肺纤维化的进展起到抑制作用。相关研究结果将为临床治疗放射性肺纤维化提供新思路。
1. 实验动物及分组:雄性SD大鼠,SPF级别,体重150~180 g,共48只。购于军事医学科学院实验动物中心(许可证号:SCXK-2007-004)。用随机数字表法将大鼠分为4组:健康对照组,12只;PBS对照组,12只;成纤维细胞治疗组,12只;干细胞治疗组,12只。
2. Ad-MSC的分离培养:健康青年女性皮下脂肪,由本院整形外科提供。将脂肪组织的用途告知供者并取得其知情同意。将脂肪组织表面以PBS洗净(pH 7.4)并剔除表面结缔组织。将组织剪至大小1~2 mm3的碎片,置于5 ml 0.2% Ⅳ型胶原酶(美国GIBCO公司)中,37℃恒温摇床上孵育40 min。等体积小牛血清(美国GIBCO公司)终止消化,200目细胞滤网过滤细胞悬液。收集到的滤液以233×g,离心5 min,离心半径为30 cm。弃掉上清,加入预先配置好的含10%胎牛血清、1%青链霉素的DMEM/F12(均为美国GIBCO公司产品)完全培养基重悬。将细胞悬液接种于T-75培养瓶中(美国Corning公司)。37℃、5%CO2条件下培养。每3天更换一次培养基,细胞融合至70%~80%时进行传代培养。P3代细胞用于实验。
3. Ad-MSC的表型分析:P3代细胞表型分析包括CD11b、CD19、CD34、CD45、CD73、CD90、CD105及HLA-DR。以上流式抗体均购于美国BD公司。
4. Ad-MSC的诱导分化:P3代细胞的诱导分化包括成脂肪细胞及成骨细胞诱导。诱导培养基购于美国Invitrogen公司。按照说明书步骤将细胞接种于6孔板中,现以DMEM/F12培养基促进细胞贴壁。24 h后,弃掉培养基,加入2 ml/孔诱导培养基,每3天更换一次诱导培养基。21 d后,分别以油红"O"及茜素红S染液(美国Sigma-Aldrich公司)分别对诱导细胞进行染色。成脂分化细胞中的脂滴可被油红"O"标记成红色;成骨分化细胞形成的钙结节可被茜素红S标记成红色。
5. 大鼠放射性肺损伤模型制作:以10%水合氯醛腹腔注射麻醉大鼠(0.8 ml/只),麻醉生效后将大鼠固定并开始照射。造模仪器采用RS-Pro 2000 Irradiator(美国Rad-Source公司)。照射范围为右胸廓,吸收剂量率为1.5 Gy/min,总剂量为15 Gy。
6. 细胞注射:Ad-MSC的注射量为5×106/只;人皮肤成纤维细胞(美国ATCC细胞库)注射量为5×106/只;PBS注射量为1.5 ml。其中,Ad-MSC和成纤维细胞均混悬于1.5 ml PBS中。注射途径为尾静脉。注射时间为造模后2 h。
7. 大鼠胸部影像学检查:造模后第24周,以10%水合氯醛腹腔注射麻醉大鼠(1.6 ml/只),每组6只。将大鼠固定并进行胸部X射线成像。成像仪器为德国西门子DR数字成像机(型号:6DR5010)。
8. 大鼠胸部影像学-条索样改变百分比:采用美国Media Cybernetics公司出品的Image-Pro Plus 6.0图像分析软件。将大鼠受照右肺圈定后,分析被圈定面积中白色面积百分比。以健康对照组为阴性对照(排除右肺门、右侧心房及心室造成的误差),将其余各组所得的白色影面积百分比减去健康对照组白色影面积百分比,即代表条索样阴性面积百分比。
9. 肺组织免疫-病理学检测:胸部X射线成像检查后,取受照大鼠右肺下叶进行石蜡包埋及切片。切片进行HE染色、Masson染色及免疫组织化学染色。免疫组织化学染色中所用的一抗为:小鼠抗大鼠α-SMA抗体(英国Abcam公司)和小鼠抗大鼠TGF-β1抗体(英国Abcam公司)。采用英国Abcam公司的免疫组织化学试剂盒对阳性细胞进行检测。
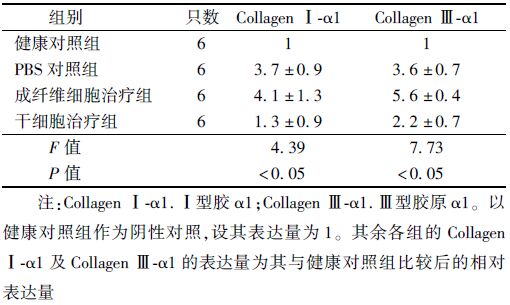
10. 反转录及实时荧光定量PCR检测受照肺组织内Ⅰ型胶原-α1(Collagen Ⅰ-α1)和 Ⅲ型胶原-α1(Collagen Ⅲ-α1)的表达量:将麻醉状态的大鼠右侧肺取出,每组6只。PBS(pH 7.4)洗去肺表面血渍后,将肺组织剪至1~2 mm3大小并混匀。称取50 mg组织碎片,置于液氮中进行研磨。加入1 ml TRIzol试剂(美国Invitrogen公司)提取组织总RNA。从每个样本中吸取1 μg总RNA用于合成第一链 cDNA,cDNA合成试剂购于日本TaKaRa公司。cDNA合成完毕后,加入预先合成的引物及SYBR Green I Probe Mix试剂(美国Roche公司)在ABI 7500 Fast实时荧光定量PCR仪上进行35个循环扩增。引物设计采用NCBI网站的BLAST引物设计软件,并交由美国Invitrogen北京分公司合成。Collagen Ⅰ-α1引物序列:上游5' GCCTCTGCAACAAATCCCCA 3';下游5' CATGTGTGGCCGATGTTTCC 3'。Collagen Ⅲ-α1引物序列:上游5' AATGGAGCAAAGGGAGAGCC 3';下游5' ACCCCTTTCTCCTGGGTTTC 3'。
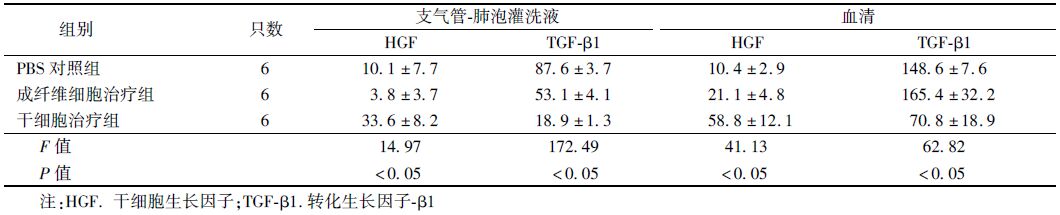
11. 肝细胞生长因子(HGF)及转化生长因子-β1(TGF-β1)的含量检测:在造模后第24周,获取受照大鼠血清和支气管-肺泡灌洗液(BALF)样本,每组6只。小鼠/大鼠HGF ELISA试剂盒(美国R&D公司)和大鼠TGF-β1 ELISA试剂盒(美国eBioscience公司)用于血清和BALF样本中HGF和TGF-β1浓度的检测。
12. 统计学处理:数据用x±s形式表示。采用SPSS 17.0软件进行分析,组间数据比较采用单因素方差分析。P<0.05为差异有统计学意义。
1. Ad-MSC的鉴定:如图 1,Ad-MSC具有贴壁生长的特点。细胞阳性表达CD73(99.93%)、CD90(99.95%)和CD105(99.93%);阴性表达CD11b(0.19%)、CD19(0.14%)、CD34(0.14%)、CD45(0.38%)和HLA-DR(0.1%)。另外,经诱导培养21 d,Ad-MSC胞质中存在可被油红"O"标记的脂滴以及被茜素红S标记的钙结节(图 1)。以上结果符合2006年制定的MSC鉴定标准[4]。
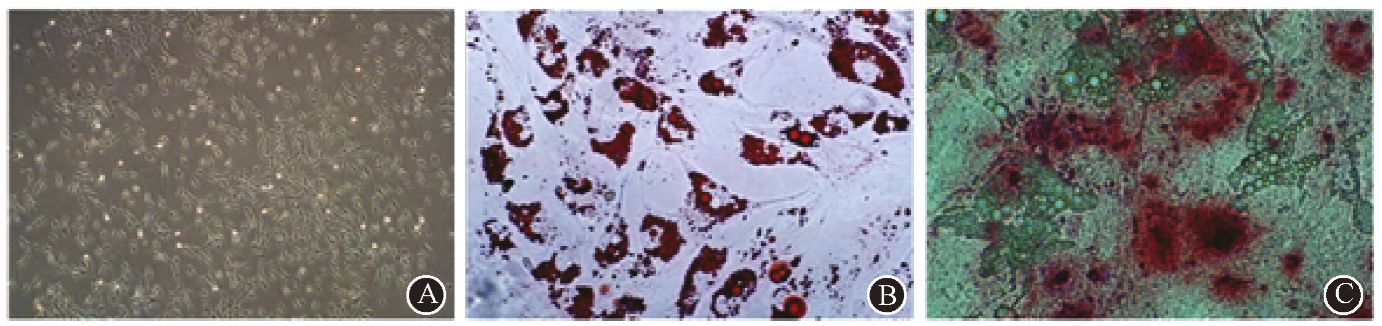 |
图 1 Ad-MSC的离体生长形态及体外诱导分化鉴定 A.纺锤形贴壁生长 ×100;B.成脂肪细胞分化 油红"O"染色 ×400;C.成骨细胞分化 茜素红S染色 ×400 |
2. 大鼠胸部影像学分析:与健康对照组相比,PBS对照组及成纤维细胞治疗组大鼠右肺下叶出现条索样高密度影,干细胞治疗组的大鼠右肺下叶条索样改变不明显(图 2)。经图像分析软件处理后,结果显示PBS对照组和成纤维细胞治疗组条索样病变影占右肺野面积分别约为50%和70%;而干细胞治疗组条索样病变影约为20%。这一结果表明,在造模后的24周内,Ad-MSC能够延缓受照肺部病变的进展。
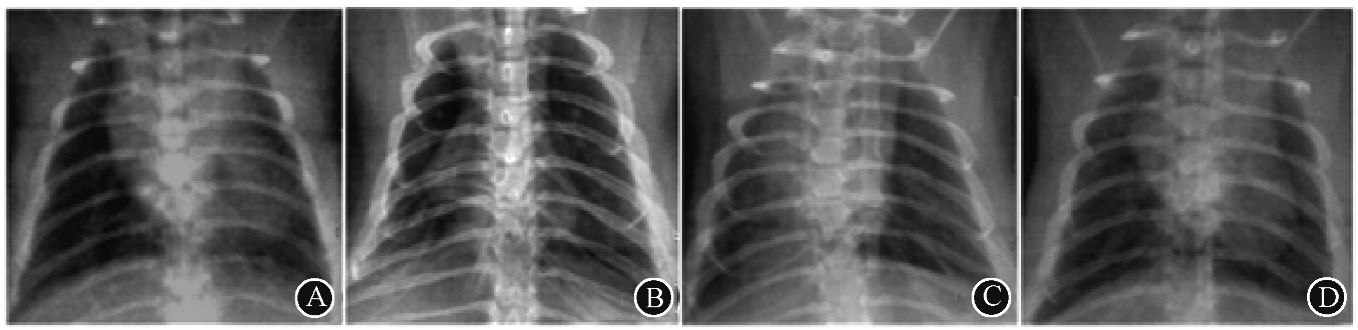 |
图 2 造模后第24周受照大鼠的肺影像学改变 A.健康对照组;B.PBS对照组;C.成纤维细胞治疗组;D.干细胞治疗组 |
3. 大鼠肺组织形态学分析:与健康对照组相比,PBS对照组及成纤维细胞治疗组的大鼠右肺镜下结构被破坏。表现为肺泡塌陷,结构不清,肺泡间隔增宽。干细胞治疗组大鼠右肺的肺泡形态较为规整(图 3)。Masson染色结果提示,PBS对照组及成纤维细胞治疗组大鼠的右肺组织内胶原沉积程度较干细胞治疗组明显增加(图 4)。另外,本实验对未受照的左肺组织进行了组织学分析。结果发现,PBS对照组及成纤维细胞治疗组的大鼠左肺同样存在肺泡塌陷等改变,胶原沉积程度较干细胞治疗组重。以上结果表明,在造模后的24周内,Ad-MSC的输注能够使大鼠的受照肺组织的结构得到保护,胶原沉积程度减轻。
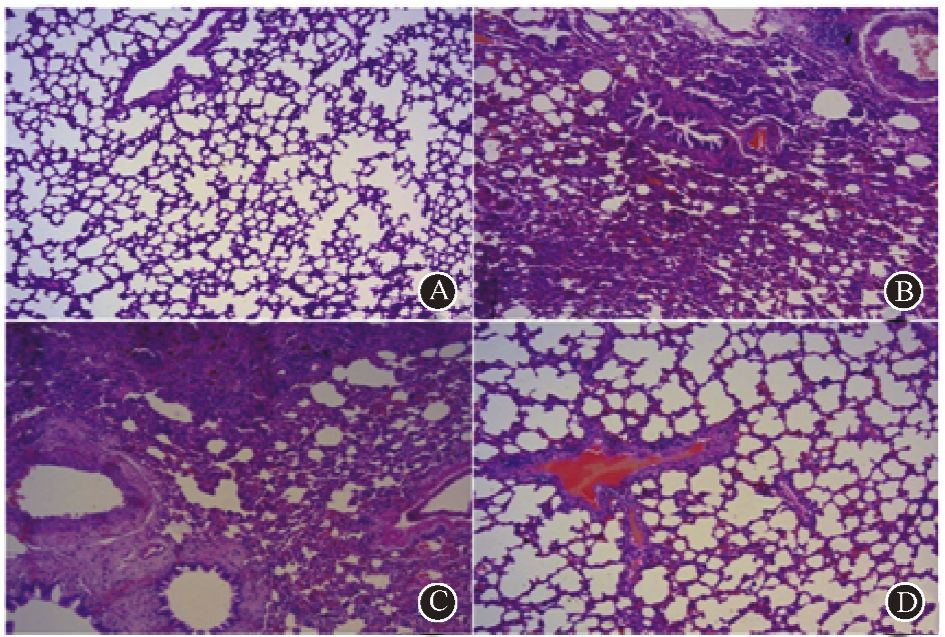 |
图 3 造模后第24周受照大鼠右肺形态的镜下改变 HE染色 ×100 A.健康对照组;B.PBS对照组;C.成纤维细胞治疗组;D.干细胞治疗组 |
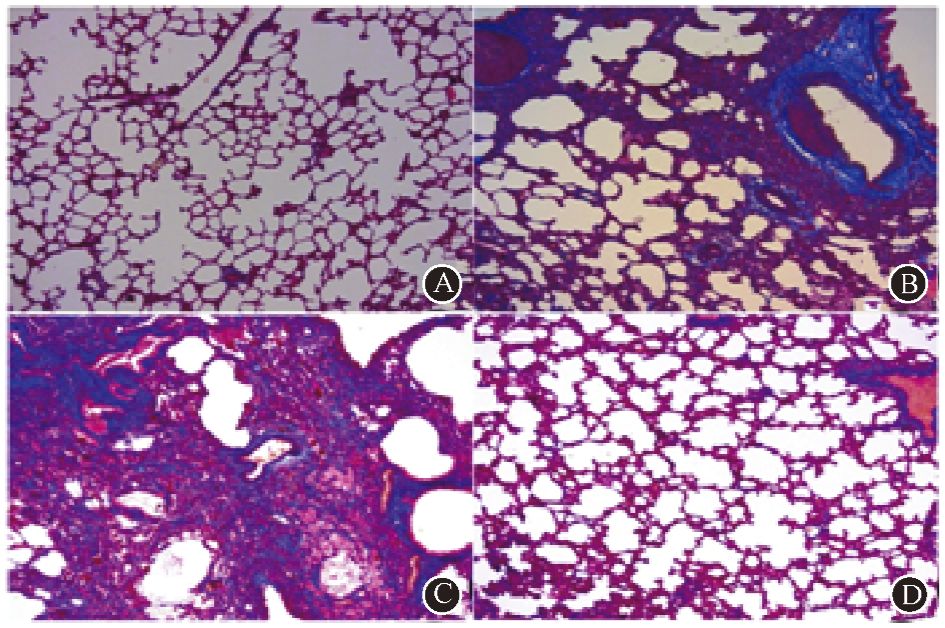 |
图 4 造模后第24周受照大鼠右肺的胶原沉积程度 Masson染色 ×100 A.健康对照组;B.PBS对照组;C.成纤维细胞治疗组;D.干细胞治疗组 |
4. 大鼠肺组织内TGF-β1及α-平滑肌肌动蛋白免疫组织化学染色:在造模后第24周,PBS对照组及成纤维细胞治疗组大鼠的肺间质内TGF-β1(图 5)和肺内α-SMA(图 6)的表达较干细胞治疗组明显。从图 6中可以发现,受照的大鼠肺内α-SMA的表达部位多位于肺泡壁。肺泡壁的纤维化将不利于气-血的交换。
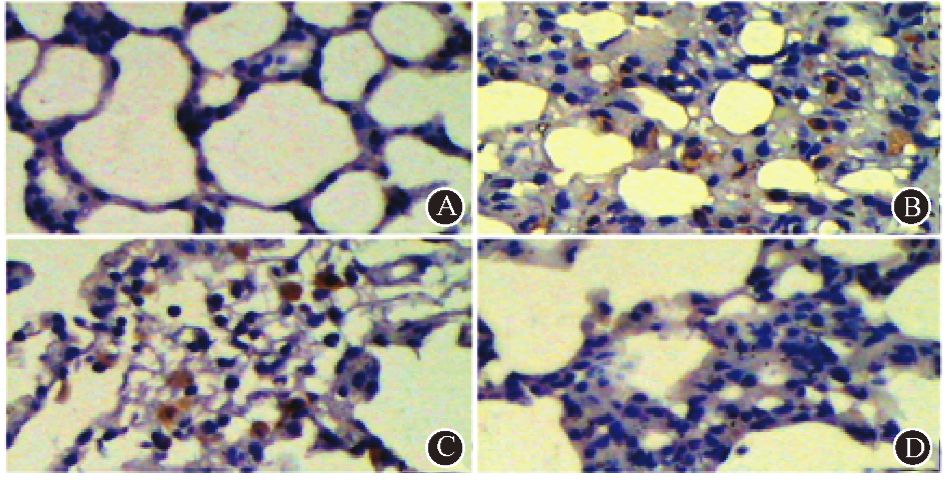 |
图 5 造模后第24周受照大鼠肺内TGF-β1的表达 免疫组织化学染色 ×400 A.健康对照组;B.PBS对照组;C.成纤维细胞治疗组;D.干细胞治疗组 |
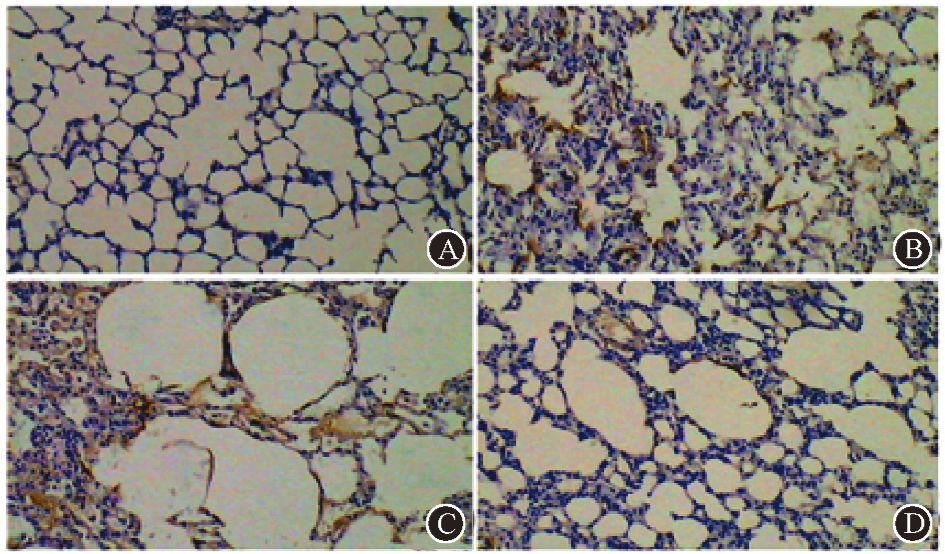 |
图 6 造模后第24周受照大鼠肺内α-平滑肌肌动蛋白的表达 免疫组织化学染色 ×100 A.健康对照组;B.PBS对照组;C.成纤维细胞治疗组;D.干细胞治疗组 |
5. 大鼠肺组织中HGF及TGF-β1含量变化:如表 1示,在造模后第24周,干细胞治疗组的大鼠血清及支气管-肺泡灌洗液中HGF的浓度明显高于PBS对照组及成纤维细胞治疗组(F=14.97、41.13,P<0.05)。而干细胞治疗组大鼠血清及支气管-肺泡灌洗液中TGF-β1的浓度明显低于其余两组(F=172.49、62.82,P<0.05)。表明Ad-MSC能够上调受照大鼠血清及肺内HGF的含量,下调TGF-β1的含量。
|
|
表 1 造模后第24周受照大鼠血清及支气管-肺泡灌洗液中HGF及TGF-β1浓度(ng/ml,x±s) |
6. 受照肺组织 Collagen Ⅰ-α1和Collagen Ⅲ-α1的表达水平:为明确Ad-MSC的注射能够降低受照肺内细胞外基质(extra-cellular matrix,ECM)的合成,本研究对受照肺内Collagen Ⅰ-α1及Collagen Ⅲ-α1的表达量进行了检测。结果发现,Collagen Ⅰ-α1及Collagen Ⅲ-α1基因在受照大鼠肺内的表达较健康对照组有所提高,但干细胞治疗组大鼠肺内Collagen Ⅰ-α1及Collagen Ⅲ-α1基因的表达上调倍数最低(F=4.39、7.73,P<0.05,表 2)。这表明,Ad-MSC能够减少大鼠的受照肺内Collagen Ⅰ-α1及Collagen Ⅲ-α1的表达,有益于延缓受损肺组织纤维化的进展。
|
|
表 2 造模后第24周受照大鼠肺内Collagen Ⅰ-α1及Collagen Ⅲ-α1的表达量(倍,x±s) |
胸部恶性肿瘤放疗后的患者时常出现肺损伤,其发生率约为10%[5]。该损伤早期以间质性肺炎为主要表现,常出现于放疗后1个月左右;晚期则主要以不可逆的纤维化为主要特征,常出现在放疗后的2~6个月[5]。其中,纤维化进展所伴随的肺泡数量减少及其结构的破坏,常可引起有效呼吸面积减少和气-血交换障碍。典型的症状为进行性呼吸困难直至呼吸衰竭。因此,放射性肺纤维化严重影响患者的生存质量。
临床针对放射性肺损伤的治疗以大剂量皮质类固醇激素冲击治疗为主,但疗效并不确切[6]。另外,肺移植被认为是治疗放射性肺损伤最有效的治疗方式[6],但由于健康肺源的缺乏、移植费用高及相关并发症严重等因素限制了该治疗方式的广泛开展[6]。近年来,随着干细胞生物学及再生医学的不断发展,学者们逐步开展了应用MSC来治疗放射性肺损伤的动物实验研究。相关结果表明,MSC能够在损伤部位分化为血管内皮细胞及肺泡上皮细胞[7]。此外,MSC能够抑制肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)和白介素-6(IL-6)等炎症因子在损伤肺内的表达,从而使肺间质炎症得以减轻,进而阻止了肺纤维化的发生及发展[8, 9]。
目前,放射性肺纤维化的发生机制仍不十分清楚。但得到公认的是,辐射后引起的促纤维化细胞因子异常释放是促进肺纤维化进展的主要因素。其中,TGF-β1为激活成纤维细胞并诱导其表达α-平滑肌肌动蛋白(α-SMA)的主要细胞因子。被激活的成纤维细胞通过自身的收缩以及分泌细胞外基质成分来破坏组织的原有形态,导致组织重塑。研究证实,TGF-β基因在C57BL/6小鼠受照肺内的表达具有辐射剂量依赖性,12 Gy的胸部照射可引起该基因在受照肺内呈持续表达状态[10]。作为TGF-β蛋白家族一员的TGF-β1,它可通过Smad依赖途径来激活肺固有成纤维细胞以及诱导II型肺泡上皮发生上皮-间质转分化,使这些细胞重获α-SMA的表型,转化为具有增殖能力并能够分泌细胞外基质的肌样成纤维细胞[11]。
本研究发现,在接受PBS和成纤维细胞治疗后第24周,大鼠的支气管-肺泡灌洗液及血清样本中TGF-β1的含量显著高于接受Ad-MSC治疗组。在高浓度的TGF-β1作用下,受损组织中的成纤维细胞被激活。激活的成纤维细胞将上调自身细胞外基质成分的表达,如Collagen Ⅰ-α1和Collagen Ⅲ-α1。胶原成分的过度沉积将破坏肺组织的镜下形态,表现为肺泡数量减少和肺泡塌陷。另外,胶原沉积所引起的组织重塑在影像学上表现为不同程度的高密度影改变。
相比之下,干细胞治疗组的大鼠的肺形态保持较为完整,肺泡结构较为均匀,无明显的胶原沉积;影像学检查未见明显的高密度影改变。这在一定程度上得益于HGF的高表达。本研究发现,在造模后第24周,干细胞治疗组大鼠血清和支气管-肺泡灌洗液样本中HGF的含量显著高于PBS对照组和成纤维细胞治疗组,其数值分别为另两组的3倍和10倍左右。HGF除可以促血管生成之外,它的另一重要作用在于抗纤维化。研究表明,HGF可抑制TGF-β1诱导的Ⅱ型肺上皮细胞上皮-间质转分化过程。它通过上调Ⅱ型肺泡上皮细胞内Smad7基因的表达。Smad7通过与Smad2/3竞争性结合细胞内的结合位点,阻断了Smad2/3的磷酸化过程及后续与Smad4形成复合物而进行跨膜转位[12, 13]。这一作用拮抗了TGF-β1/Smads信号通路下游基因的激活,从而抑制了Ⅱ型肺上皮细胞的上皮-间质转分化过程。另有报道称,HGF因子还具有促进激活的成纤维细胞凋亡的能力,这一作用主要与HGF与其受体c-Met结合后上调表达损伤肺内基质金属蛋白酶(matrix metalloproteinases,MMPs)的合成及增强MMPs的活性有关,主要包括MMP-1、MMP-3和MMP-9[14, 15]。通过这一作用,损伤部位的细胞外基质得以被降解,从而延缓了肺组织的重塑,使得肺功能得以保护。
总之,本研究结果表明,注射Ad-MSC对放射性肺纤维化的进展起到一定的保护作用。这一作用主要通过上调宿主内源性抗纤维化作用因子HGF和下调宿主促纤维化作用因子TGF-β1的表达来实现的。
| [1] | Toonkel RL, Hare JM, Matthay MA, et al. Mesenchymal stem cells and idiopathic pulmonary fibrosis. Potential for clinical testing[J]. Am J Respir Crit Care Med, 2013, 188(2): 133-140. |
| [2] | 申戈, 王芳, 张伟京, 等. 间充质干细胞治疗小鼠放射性肺 损伤的病理学研究[J]. 中华放射医学与防护杂志, 2010, 30(6): 670-673. |
| [3] | 夏诚诚, 宋宇哲, 丁丽娟, 等. 肺泡上皮间质转分化的信号转导研究进展[J]. 中华放射医学与防护杂志, 2014, 34(7): 555-558. |
| [4] | Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement [J]. Cytotherapy, 2006, 8(4):315-317. |
| [5] | Vogelius IR, Bentzen SM. A literature-based meta-analysis of clinical risk factors for development of radiation induced pneumonitis[J]. Acta Oncol, 2012, 51(8):975-983. |
| [6] | Ghafoori P, Marks LB, Vujaskovic Z, et al. Radiation-induced lung injury. Assessment, management, and prevention[J]. Oncology (Willston Park), 2008, 22(1):37-47. |
| [7] | Yan X, Liu Y, Han Q, et al. Injured microenvironment directly guides the differentiation of engrafted Flk-1(+) mesenchymal stem cell in lung[J]. Exp Hematol, 2007, 35(9):1466-1475. |
| [8] | Wang H, Yang YF, Zhao L, et al. Hepatocyte growth factor gene-modified mesenchymal stem cells reduce radiation-induced lung injury[J]. Hum Gene Ther, 2013, 24(3): 343-353. |
| [9] | Xue J, Li X, Lu Y, et al. Gene-modified mesenchymal stem cells protect against radiation-induced lung injury[J]. Mol Ther, 2013, 21(2): 456-465. |
| [10] | Rube CE, Uthe D, Schmid KW, et al. Dose-dependent induction of transforming growth factor beta (TGF-beta) in the lung tissue of fibrosis-prone mice after thoracic irradiation[J]. Int J Radiat Oncol Biol Phys, 2000, 47(4): 1033-1042. |
| [11] | Derynck R, Zhang YE. Smad-dependent and smad-independent pathways in TGF-beta family signaling[J]. Nature, 2003, 425(6958): 577-584. |
| [12] | Shukla MN, Rose JL, Ray R, et al. Hepatocyte growth factor inhibits epithelial to myofibroblast transition in lung cells via Smad7[J]. Am J Respir Cell Mol Biol, 2009, 40(6):643-653. |
| [13] | Hayashi H, Abdollah S, Qiu Y, et al. The MAD-related protein Smad7 associates with the TGFbeta receptor and functions as an antagonist of TGFbeta signaling[J]. Cell, 1997, 89(7):1165-1173. |
| [14] | Mizuno S, Matsumoto K, Li MY, et al. HGF reduces advancing lung fibrosis in mice: a potential role for MMP-dependent myofibroblast apoptosis [J]. FASEB J, 2005, 19(6):580-582. |
| [15] | Singh S, Saraiva L, Elkington PT, et al. Regulation of matrix metalloproteinase-1,-3 and -9 in Mycobacterium tuberculosis-dependent respiratory networks by the rapamycin-sensitive PI3K/p70(S6K) cascade[J]. FASEB J, 2014, 28(1): 85-93. |
 2015,Vol. 35
2015,Vol. 35