2. 湖北文理学院附属医院襄阳市中心医院麻醉科;
3. 华中科技大学同济医学院附属协和医院麻醉科
肺组织是多种胸部肿瘤放疗中的重要危及器官,放射治疗可使正常肺组织受到损伤而引起炎症反应,严重者可使肺脏发生广泛纤维化,临床上称为放射性肺损伤(radiation-induced lung toxicity,RILT)[1,2]。对于放射性肺纤维化,机械通气是一种必不可少的治疗手段,但是近来研究发现:机械通气在提供了一种有效的呼吸支持的同时,还可能导致肺部严重的损伤,即机械通气肺损伤(ventilator-induced lung injury,VILI)[3,4]。目前,尚鲜见机械通气对放射性肺损伤患者影响的研究报道。因此,本研究拟应用放射性肺损伤大鼠模型,观察机械通气对放射性肺损伤大鼠肺组织急性炎症、氧化应激及细胞凋亡的影响,期望能够对放射性肺损伤患者进行机械通气治疗提供一定的理论依据。
1. 主要仪器及试剂:小动物呼吸机(哈佛683,美国哈佛仪器公司),DU650型紫外可见光光度计(美国Beckman 公司),总蛋白(TP)、丙二醛(MDA)、超氧化物歧化酶(SOD)和髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所),电泳迁移率(EMSA)试剂盒(美国Promega 公司),NF-κB亚基P65抗体(美国Santa Cruz公司),DNA断端末端标记(TUNEL)试剂盒(武汉博士德生物公司)。
2. 动物与分组: 雄性清洁级Spragul\|Dawley(SD)大鼠40只,由华中科技大学同济医学院实验动物学部提供,实验动物生产许可证号:SCXX(鄂)2004\|2007,10周龄,体重为300~350 g。采用随机数字表法,参考Ricard等[5]和Karzai等[6] 的方法分为健康对照组、照射组、通气组(大潮气量通气4 h)、照射后通气组(照射后大潮气量通气4 h)。通气组和照射后通气组潮气量(VT)均为40 ml/kg,通气频率均为40次/min。
3. 机械通气肺损伤动物模型制备:大鼠仰卧固定在照射台上,于照射前用2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉。参照文献[7]方法,用德国西门子公司生产的型号Primus\|M直线加速器6 MV X射线进行全胸单次照射,源皮距100 cm 300 cGy/min,2次/周,2次照射时间分别为1 min和40 s,共照射4周,总剂量20 Gy。构建放射性肺损伤大鼠模型成功后,插管接小动物呼吸机行机械通气,机械通气参数统一设置,VT=40 ml/kg,呼吸频率(RR)40次/min,吸/呼比(I[DK]∶E)为1[DK]∶1,呼气末正压(PEEP)为0,吸入气体为室内空气,泮库溴铵肌注维持肌肉松弛。股静脉和颈内动脉穿刺置管,监测生命体征及补液等。
4. 肺病理标本留置:大鼠机械通气4 h后放血处死,部分右侧肺组织用多聚甲醛溶液固定后行病理切片检查,另一部分右侧肺组织液氮保存待检。左侧肺组织用生理盐水行肺灌洗,回收的肺灌洗液立即以转速2 500 r/min,离心半径10 cm,离心10 min,沉淀物用磷酸缓冲盐溶液(PBS)稀释后行白细胞计数(WBC),上清液于-70℃保存待检。
5. 肺组织病理学观察:将大鼠肺组织石蜡包埋、切片、苏木精-伊红(HE)染色,光学显微镜下观察肺组织结构、肺内细胞浸润及分类等特征改变。按急性肺损伤指标(acute lung injury,ALI)评分。根据肺毛细血管充血、肺内出血、中性粒细胞在血管壁肺间隙集聚或浸润、肺泡壁增厚或透明膜形成,按5分制来判断,0为最轻微损害,1为轻微损害,2为中度损害,3为重度损害,4为最严重损害。
6. 肺湿干重比值(W/D)测定:取大鼠一叶右肺组织,称湿重后置于烤箱中,70℃烘烤至恒重后称干重,计算肺W/D比值。
7. 总蛋白和MPO活性测定:肺灌洗液中总蛋白的测定采用考马斯亮蓝染色法;肺组织MPO活性测定采用MPO试剂盒,0.1 g大鼠肺组织,按重量体积比1[DK]∶19加匀浆缓冲液制备成5%组织匀浆,按照试剂盒说明书步骤,采用UV-2000型分光光度计测量吸光度(A)值,计算出MPO活性(活力单位·g-1·湿片-1)。
8. EMSA检测肺组织细胞核转录因子-κB(NF-κB)的活性:少量肺组织与液氮混合后研碎,提取核蛋白;用Tris-EDTA缓冲液稀释后取1 μl探针(具有与NF-κB转录因子结合位点的双链寡核苷酸,末端用γ32P-ATP标记)加入反应液中与核蛋白孵育30 min,电泳3 h,真空加热干燥后,置于-70℃放射自显影48 h,采用Bio-Rad成像系统对曝光底片进行灰度扫描,测定各条带积分光密度值(IOD)。
9. Western blot法检测NF-κB亚基P65蛋白表达水平:细胞核蛋白的提取同上,以考马斯亮蓝法测定提取液中的蛋白浓度,SDS-聚丙烯酰胺凝胶恒压电泳;蛋白转膜后一抗孵育,4℃过夜;室温下二抗摇床杂交1 h;ECL化学发光法检测阳性信号。
10. 肺组织中MDA和SOD的检测:准确称取肺组织重量并匀浆,所有步骤均严格按照试剂盒说明书进行,化学比色法检测MDA的含量和SOD的活性。
11. TUNEL法检测肺组织中凋亡细胞:用脱氧核糖核苷酸末端转移酶介导的末端标记法分析肺组织中细胞凋亡的情况,通过原位测定肺组织切片中的DNA 片段对损伤的肺组织中细胞凋亡的程度进行评价。细胞核呈棕黄色染色为阳性细胞,在400倍光镜下每张切片随机观察10个视野,计算每100个细胞中阳性细胞的数量,然后取平均数,即凋亡指数(AI)。
12. 统计学处理:实验数据用x±s表示。用SPSS 12.0统计软件进行单因素方差分析(One-way ANOVA);两组之间比较采用q检验。P<0.05为差异有统计学意义。
1. 大鼠肺组织病理形态改变:健康对照组大鼠肺组织结构清晰,支气管、肺泡及肺泡间隔组织结构正常,肺泡间隔无充血及水肿,肺泡腔内无渗出物及中性粒细胞浸润等改变;照射组肺组织肺泡间隔增厚,肺泡腔内可见少量的炎性细胞以及巨噬细胞;通气组肺组织病理改变明显,肺泡间隔充血、水肿,肺泡腔内可见较多的炎性细胞,部分肺泡腔内有血性渗出液; 照射后通气组肺组织病理改变明显加重,肺泡间隔明显增厚,部分有透明膜形成,肺泡腔中炎性细胞显著增多,可见明显的血性渗出液。与健康对照组相比,其他3组ALI评分均显著增高(q=0.000 32、0.000 56、0.000 61,P<0.05);与照射组和通气组比较,照射后通气组ALI评分明显增高(q=0.004 3、0.011 2,P<0.05),见表 1。
| 表 1 各组大鼠肺组织急性肺损伤评分、湿/干重比值、髓过氧化物酶活性、总蛋白及白细胞计数比较 (x±s) |
2.大鼠肺组织W/D比值和MPO活性改变:与健康对照组比较,其他3组W/D和MPO值显著升高(q=0.000 39~0.000 95,P<0.05);与照射组和通气组比较,照射后通气组W/D和MPO值明显升高(q=0.006 1~0.010 3,P<0.05),见表 1。
3. 大鼠肺灌洗液总蛋白和白细胞测定:与健康对照组比较,其他3组肺灌洗液总蛋白、总细胞值显著升高(q=0.000 35~0.000 83,P<0.05);与照射组和通气组比较,照射后通气组肺灌洗液总蛋白、总细胞值明显升高(q=0.005 7~0.009 0,P<0.05),见表 1。
4. 大鼠肺组织SOD和MDA的含量改变:与健康对照组比较,其他3组肺组织SOD值显著降低(q=0.000 18~0.002 53,P<0.05)、MDA含量显著升高(q=0.000 40~0.004 81,P<0.05);与照射组和通气组比较,照射后通气组肺组织SOD值明显降低(q=0.002 9~0.008 3,P<0.05)、MDA含量明显升高(q=0.005 9~0.013 8,P<0.05),见表 2。
| 表 2 各组大鼠肺组织丙二醛和超氧化物歧化酶含量、NF-κB活性、P65表达和凋亡指数比较(x±s) |
5. 大鼠肺组织NF-κB的活性改变:与健康对照组比较,其他3组肺组织NF-κB的活性显著升高(q=0.000 62、0.000 71、0.000 40,P<0.01);与照射组和通气组比较,照射后通气组肺组织NF-κB的活性明显升高(q=0.010 3、0.013 8,P<0.05),见表 2。
6. 大鼠肺组织NF-κB亚基P65蛋白的表达改变:与健康对照组比较,其他3组肺组织P65蛋白的表达显著升高(q=0.000 64、0.000 79、0.000 55,P<0.01);与照射组和通气组比较,照射后通气组肺组织P65蛋白表达明显升高(q=0.009 8、0.012 7,P<0.05)。
7.大鼠肺组织中细胞凋亡改变:如图 1和表 2所示,健康对照组仅见极少数细胞出现凋亡,其他3组肺组织细胞凋亡数量显著增多、凋亡指数显著增加(q=0.000 91、0.001 06、0.000 49,P<0.01);与照射组和通气组相比,照射后通气组肺组织细胞凋亡数量明显增多、凋亡指数明显增加(q=0.011 3、0.022 6,P<0.05)。
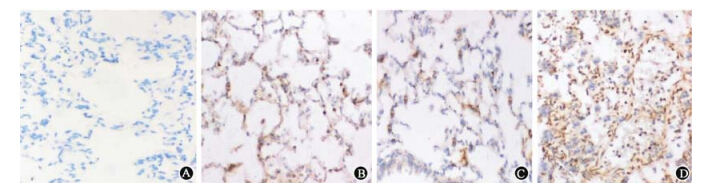 | 图 1 各组大鼠肺组织细胞凋亡镜下变化 TUNEL染色 ×200 A.健康对照组;B.照射组;C.通气组; D.照射后通气组 |
通常将发生于放射治疗结束后3个月内的肺损伤称为放射性肺炎,而将放射治疗结束3个月后肺组织的放射性损伤称为放射性肺纤维化。放射性肺损伤发病机制尚不十分清楚,传统观点认为,放射性肺损伤的发生与电离辐射对Ⅱ型肺泡上皮细胞及毛细血管内皮细胞的直接损伤关系密切。但近来越来越多的研究认为,放射性肺损伤的发生并非完全是电离辐射所导致的直接损伤,而是与损伤后产生的炎症介质所介导的急性免疫反应密切相关。研究显示,肺组织中细胞的损伤在接受照射后即可产生,并引起一系列的细胞因子的合成增加,通过细胞内及细胞间的信息传递和信号放大,导致了临床上可见的放射性肺损伤[8]。电离辐射导致放射性肺损伤的靶细胞包括Ⅱ型肺泡细胞、血管内皮细胞、成纤维细胞以及肺泡巨噬细胞等[9]。本研究成功地复制了实验用大鼠放射性肺损伤模型。
在临床麻醉及重症监护工作中,机械通气是一种必不可少的治疗手段,但是近来研究发现,机械通气在提供了一种有效的呼吸支持的同时,还可能导致肺部严重的损伤,即VILI,这是机械通气最严重的并发症之一,其病理特征包括渗透性肺水肿、透明膜形成及炎性细胞浸润等[3,4]。通常认为只有大潮气量机械通气才可能导致VILI,而临床上实施机械通气时往往多选择正常甚至略低的潮气量,因此,一般不会导致VILI。但实际上即使选择正常甚至略低的潮气量行机械通气,也会导致VILI,因为VILI主要发生在肺部已有损伤而需机械通气支持的患者,如各种原因所致严重的急、慢性肺损伤、急性呼吸窘迫综合征、呼吸功能衰竭等患者。对于这部分患者,由于支气管炎症(分泌物堵塞)和肺不张等因素的作用,大部分肺组织已失去通气功能,能正常通气的肺组织还不到总数的1/3;即使以正常甚至略低的潮气量(6~8 ml/kg)给这些患者实施机械通气,那些残余的正常肺组织所承受的实际通气量也将达到20 ml/kg以上,极易造成肺组织的损伤[10]。在本研究中,健康对照组大鼠肺组织病理切片结构清晰,支气管、肺泡及肺泡间隔组织结构正常,肺泡间隔无充血及水肿,肺泡腔内无渗出物及中性粒细胞浸润等改变,W/D比值和肺灌洗液总蛋白均处于较低水平。而照射组、通气组及照射后通气组大鼠肺组织病理切片出现了明显的损伤性改变,具体表现为肺间隔明显增厚、炎性细胞的浸润以及肺泡腔中出现渗出物等。本研究同时检测了肺灌洗液白细胞计数和肺组织MPO的水平,以研究大潮气量机械通气后不同大鼠肺组织炎症反应的水平[11]。本研究结果显示,健康对照组肺灌洗液中性粒细胞计数和肺组织MPO的水平较低,而通气组及照射后通气组肺灌洗液中性粒细胞计数和肺组织MPO的水平显著增加;而且和照射组相比,照射后通气组肺灌洗液中性粒细胞计数和肺组织MPO的水平增加趋势表现得更加明显,提示放射性肺损伤后再行大潮气量通气更容易发生VILI。
研究发现,VILI时机械通气产生的过度牵张、剪切力等机械刺激作用于肺细胞,能显著激活NF-κB系统[12]。本研究结果表明,和健康对照组相比,照射组、通气组及照射后通气组大鼠肺组织NF-κB的活性、MDA的含量及凋亡指数均显著升高,而SOD的含量显著减少。提示急性放射性肺损伤和大潮气量机械通气时均使大鼠肺组织产生了明显的急性炎症反应,表现为NF-κB激活中性粒细胞的浸润,肺组织中氧化/抗氧化能力严重失衡。由此说明,NF-κB的激活可能也在RILP的致病机制中起着重要作用,和照射组相比,照射后通气组大鼠肺组织NF-κB的活性显著升高趋势表现得更加明显,再次证明放射性肺损伤后再行大潮气量通气更容易发生VILI。
本研究通过建立大鼠机械通气及放射性肺损伤动物模型,研究机械通气对放射性肺损伤大鼠肺组织急性炎症、氧化应激及细胞凋亡的影响,证明了放射性肺损伤后行大潮气量机械通气比单纯大潮气量机械通气产生了更加明显的机械通气肺损伤,表现为渗透性肺水肿、急性炎症反应、氧化应激反应的激活以及广泛的肺组织细胞凋亡,说明机械通气对放射性肺损伤患者更容易造成机械通气肺损伤。
| [1] | Zhao L, Sheldon K, Chen M, et al. The predictive role of plasma TGF-beta1 during radiation therapy for radiation-induced lung toxicity deserves further study in patients with non-small cell lung cancer[J]. Lung Cancer, 2008, 59(2):232-239. |
| [2] | Jenkins P, Watts J. An improved model for predicting radiation pneumonitis incorporating clinical and dosimetric variables[J]. Int J Radiat Oncol Biol Phys, 2011,80(4):1023-1029. |
| [3] | Gattinoni L, Protti A, Caironi P, et al. Ventilator-induced lung injury: the anatomical and physiological framework[J]. Crit Care Med, 2010,38(10 Suppl):S539-548. |
| [4] | Plataki M, Hubmayr RD. The physical basis of ventilator-induced lung injury[J]. Expert Rev Respir Med, 2010,4(3):373-385. |
| [5] | Ricard JD, Dreyfuss D, Saumon G. Production of inflammatory cytokines in ventilator-induced lung injury: a reappraisal[J]. Am J Respir Crit Care Med, 2001, 163 (5): 1176-1180. |
| [6] | Karzai W, Cui XZ, Heinicke N, et al. Neutrophil stimulation with granulocyte colony-stimulating factor worsens ventilator-induced lung injury and mortality in rats[J]. Anesthesiology, 2005, 103(5):996-1005. |
| [7] | 周燕萍,胡作为,杨航,等. 沙参麦冬汤对放射性肺炎大鼠肺组织超氧化物歧化酶活性、丙二醛含量的影响[J]. 湖北中医药大学学报, 2011, 3(4): 9-11. |
| [8] | Wang S, Liao Z, Wei X, et al. Association between systemic chemotherapy before chemoradiation and increased risk of treatment-related pneumonitis in esophageal cancer patients treated with definitive chemoradiotherapy[J]. J Thorac Oncol, 2008,3(3):277-282. |
| [9] | Das SK, Zhou S, Zhang J, et al. Predicting lung radiotherapy-induced pneumonitis using a model combining parametric Lyman probit with nonparametric decision trees[J]. Int J Radiat Oncol Biol Phys, 2007,68 (4):1212-1221. |
| [10] | Wolthuis EK, Vlaar AP, Choi G, et al. Mechanical ventilation using non-injurious ventilation settings causes lung injury in the absence of pre-existing lung injury in healthy mice[J]. Crit Care, 2009,13(1):R1-11. |
| [11] | Kilpatrick B, Slinger P. Lung protective strategies in anaesthesia[J]. Br J Anaesth, 2010,105 (Suppl 1):i108-116. |
| [12] | 朱宏飞, 冯丹, 姚尚龙,等. 机械通气肺损伤时肾素-血管紧张素系统激活的实验研究[J]. 华中科技大学学报(医学版), 2010,39(2):147-152. |
 2015, Vol. 35
2015, Vol. 35