核与辐射资源应用日益广泛的同时,核电、工业探伤、医疗等领域难免会发生辐射暴露事件,导致放射损伤、癌症或致死[1,2]。因此,如何减轻辐射损伤是辐射防护领域研究的热点,开发缓解药物与辐射防护药物是目前的主要措施[3,4,5],在许多辐射生物效应研究中将细胞置于冰上进行照射,而发现了低温具有辐射防护作用,影响细胞辐射敏感性[6,7],可减少因辐射引起的细胞DNA损伤和微核发生率[3]。但在动物整体水平探讨低温对辐射防护作用的研究还较少。本研究通过将小鼠受照后即刻给予亚低温干预,探讨亚低温对急性辐射损伤小鼠的辐射防护作用及其机制,以期为辐射事故应急提供一种易于实施而有效的方法。
1. 实验动物:清洁级健康雄性BALB/c小鼠105只,16~18 g, 6~8周, 购于中国食品药品检定研究院,实验动物生产许可证号:SCXK(京)2009-0017。饲养环境安静舒适,温度20~24℃,湿度40%~60%,自由饮水,标准饲料喂养。
2. 照射条件:中国辐射防护研究院附属医院60Co放疗机(中国核动力研究设计院GWGT80型),由中国疾病预防控制中心辐射防护与核安全医学所标定刻度,在有效期内。
3. 主要仪器与试剂:SN25776型酶标仪(美国Biotek公司);Coulter Cytomics FC500流式细胞仪(美国Beckman公司);HEMAVET950型动物血液分析仪(美国DREW scientific公司),所用稀释液、溶血剂均由美国DREW Scientific公司生产,批号6505MB、6505X11B。
4. 实验动物分组及照射: 小鼠检疫后按随机数字表法分为3组,即单纯照射组、亚低温干预组和健康对照组,每组35只。单纯照射组经6 Gy照射后腹腔注射生理盐水(0.1 ml/10 g);亚低温干预组经6 Gy照射后腹腔注射0.05%氯丙嗪(0.1 ml/10 g)后放入冰箱使其肛温降低至30~33℃,维持4~6 h。健康对照组给予假照射后再给予等体积生理盐水。照射条件:照射小鼠置于带孔的单层盘盒内,放置在医用60Co放疗机照射台上单次全身照射,吸收剂量均为6 Gy,剂量率0.872 Gy/min,源皮距80 cm。照射完毕将小鼠送至实验室自由饮食饮水,照射当日计为第0天。
5.观察指标
(1)外周血白细胞数:受照前1 d和受照后1、3、7、14、21和28 d,小鼠拔眼球采全血,用自动血球计数仪检测。
(2)骨髓有核细胞计数:受照后6 h和1、3、7、14、21和28 d,取一侧股骨,用白细胞稀释液冲出骨髓,打匀,在显微镜下计数骨髓有核细胞数。
(3)[JP2]骨髓病理组织学检查:受照后6 h和1、3、7、14、21和28 d,取小鼠胸骨经10%甲醛固定石蜡包埋,切片,苏木精-伊红(HE)染色后普通光镜观察。
(4)抗氧化能力检测:受照后6和24 h,取血分离血清,依据南京建成生物科技有限公司试剂盒说明书测定小鼠血清丙二醛(MDA)含量、超氧化物歧化酶(SOD)活力和谷胱甘肽过氧化物酶(GSH-px)活力。
(5)骨髓细胞周期:取小鼠股骨,用磷酸盐缓冲液(PBS)冲出骨髓,离心半径10 cm,转速2 000 r/min,离心10 min,弃上清,加入PBS再洗涤1次,离心弃上清,加入70%冷乙醇500 μl 4℃过夜,次日用PBS洗涤1次,离心弃上清,加入100 μl RNaseA、300 μl 碘化丙啶混匀,室温避光反应30 min后,流式细胞仪检测骨髓细胞周期。
6. 统计学处理:数据以x±s表示,采用SPSS 17.0软件进行ANOVA方差分析,方差齐则用LSD法;若方差不齐,则用Games-Howell法。P<0.05为差异有统计学意义。
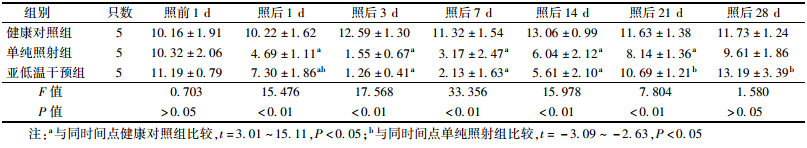
1. 辐照后亚低温干预对小鼠外周血白细胞的影响:结果列于表 1。由表 1可知,受照前1 d各组小鼠外周血白细胞数差异无统计学意义;在受照后1~21 d,各组小鼠外周血白细胞数差异有统计学意义(F=15.476、17.568、33.356、15.978、7.804,P<0.01);单纯照射组和亚低温干预组小鼠外周血白细胞数在受照后1 d即开始下降,但亚低温干预组下降幅度小于单纯照射组(t=-2.63,P<0.05);单纯照射组和亚低温干预组外周血白细胞数均在受照后7 d降至最低,亚低温干预组小鼠外周血白细胞在受照后21 d恢复,高于单纯照射组(t=-3.03,P<0.05),而单纯照射组在受照后28 d才恢复。提示亚低温干预急性辐射损伤小鼠可使其外周血白细胞数降低速度减慢,恢复提前。
| 表 1 辐照后不同时间亚低温干预对小鼠外周血白细胞的影响(×109/L,x±s) |
2. 辐照后亚低温干预对小鼠股骨骨髓有核细胞数的影响:结果列于表 2。由表 2可知,在受照后6 h至7d,各组小鼠股骨骨髓有核细胞数差异有统计学意义(F=4.292、13.247、75.341、24.665,P<0.01);受照后6 h,单纯照射组骨髓有核细胞数即低于健康对照组(t=2.55,P<0.05),亚低温干预组未降低且高于单纯照射组(t=-3.41,P<0.05);受照后3 d两组骨髓有核细胞数均降至最低,但受照后7 d 亚低温干预组开始回升,高于单纯照射组(t=-4.92,P<0.05)。提示亚低温干预急性辐射损伤小鼠可使其骨髓有核细胞数降低速度减慢,恢复提前。
| 表 2 辐照后不同时间亚低温干预对小鼠股骨骨髓有核细胞数的影响(×107/L,x±s) |
3. 辐照后亚低温干预对小鼠骨髓病理组织学的影响:图 1显示,健康对照组小鼠各时间点骨髓充盈;单纯照射组照后6 h开始出现严重髓内出血,三系细胞衰减,14 d出血及细胞衰减达最严重程度,28 d恢复较好;亚低温干预组受照后3 d开始显著的髓内出血及三系细胞衰减,14 d已开始恢复,28 d恢复良好。
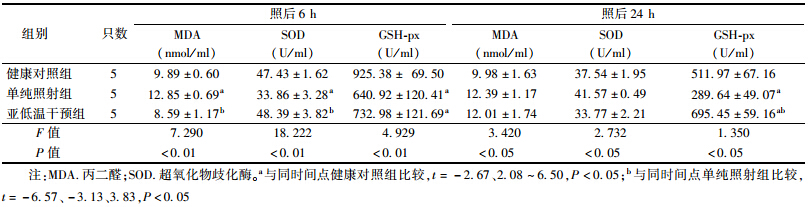
4. 辐照后亚低温干预对小鼠抗氧化能力的影响:结果列于表 3。受照后6和24 h,各组的MDA、SOD和GSH-px活力比较差异有统计学意义(F==7.290、18.222、4.929,3.420、2.732、1.350,P<0.05);受照后6 h,单纯照射组MDA含量高于健康对照组(t=-2.67,P<0.05),SOD和GSH-px活力低于健康对照组(t=6.50、3.07,P<0.05),亚低温干预组MDA含量低于单纯照射组(t=3.83,P<0.05),SOD活力高于单纯照射组(t=-6.57,P<0.05);受照后24 h,单纯照射组GSH-px活力仍低于健康对照组(t=2.77,P<0.05),亚低温干预组GSH-px活力高于健康对照组和单纯照射组(t=-2.75、-3.13,P<0.05)。提示辐射后亚低温干预对受照小鼠机体抗氧化力有较好的保护作用。
| 表 3 辐照后不同时间亚低温干预对小鼠抗氧化能力的影响(x±s) |
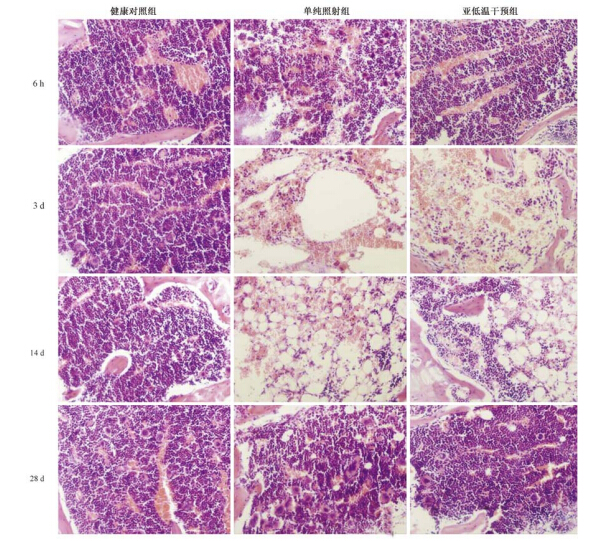 | 图 1 辐照后不同时间亚低温干预对小鼠骨髓的影响 HE染色 ×200 |
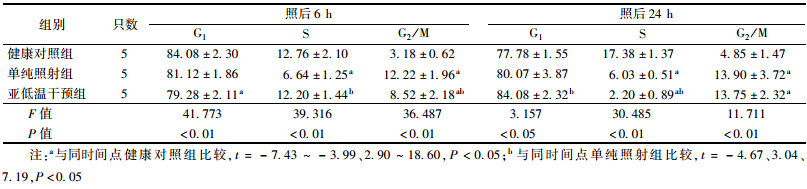
5. 辐照后亚低温干预对小鼠骨髓细胞周期的影响:结果见表 4。受照后6和24 h各组各周期细胞比例比较差异有统计学意义(F==41.773、39.316、36.487,3.157、30.485、11.711,P<0.05);受照后6 h,单纯照射组小鼠骨髓S期细胞较健康对照组减少(t=5.14,P<0.05),G2/M期细胞增加(t=-7.43,P<0.05),即骨髓细胞出现G2/M期阻滞;亚低温干预组小鼠骨髓G1期细胞较健康对照组减少(t=2.90,P<0.05),S期细胞较单纯照射组增加(t=-4.67,P<0.05),G2/M期细胞较健康对照组增加(t=-4.39,P<0.05),较单纯照射组减少(t=3.04,P<0.05),即S期延迟和G2/M期阻滞;受照后24 h,单纯照射组小鼠骨髓细胞周期分布与6 h相近,亚低温干预组小鼠骨髓G1期细胞较健康对照组增加(t=-4.52,P<0.05),[JP2]S期细胞较健康对照组和单纯照射组减少(t=18.60、7.19,P<0.05),G2/M期细胞较健康对照组增加(t=-6.49,P<0.05),即G1期和G2/M期双阻滞。提示照后亚低温干预可影响受照小鼠骨髓细胞周期的调整。
| 表 4 辐照后不同时间亚低温干预对小鼠骨髓细胞周期的影响(%,x±s) |
电离辐射使机体产生大量的自由基进而引发生物膜脂质过氧化反应是辐射所致损伤的重要机制,而亚低温(28~35℃)在心肺复苏、急性脓毒症和缺血再灌注等研究中均有抑制氧自由基过多产生和脂质过氧化产物堆积的作用[8\|9]。本研究通过观察对辐射敏感的外周血白细胞数、骨髓损伤和机体抗氧化力等相关指标,探讨亚低温对急性辐射损伤的作用效果及机制。
外周血白细胞数的变化在辐射防护领域不仅可用于诊断和判定预后,而且在治疗上使机体保持较高水平的白细胞数,对改善机体抗感染、加强防御适应能力也有很重要的作用[10]。本研究显示在受照后早期亚低温干预可使小鼠外周血白细胞数降低幅度减小,且恢复提前,表明辐照后及时亚低温干预不但对受照小鼠原有外周血白细胞有一定的保护作用,而且促进后期外周血白细胞的生成。本实验骨髓病理组织学及骨髓有核细胞计数均显示,亚低温干预急性辐射损伤小鼠可使其骨髓有核细胞数较晚开始细胞衰减,恢复时间提前且恢复情况良好。此结果与外周血白细胞变化趋势基本一致,但是骨髓有核细胞数较外周血白细胞数恢复较早,表明亚低温干预可促进辐射导致的骨髓及造血功能损伤较快恢复。
生物体自身具有一系列清除自由基的抗氧化酶系,研究中常用MDA、SOD和GSH-px活力等判断机体的抗氧化能力。亚低温干预辐射损伤小鼠,照后早期可抑制其血清中MDA堆积,提高SOD和GSH-px酶活力,表明亚低温干预可提高受照小鼠的抗氧化力,抑制机体脂质过氧化。
辐射通过诱导细胞周期G1阻滞、G2阻滞、S期延迟及S/M解耦联从而影响细胞周期进程[11]。本实验中受照动物骨髓细胞在受照后6和24 h均出现G2/M期严重阻滞,这就为受损伤的骨髓细胞提供修复的时间与条件,与胡锴勋等[11]的研究结果较为一致。亚低温干预动物骨髓细胞在受照后6 h出现S期延迟和G2期阻滞,受照后24 h出现严重的G1期和G2期双阻滞。表明亚低温干预可减弱照后早期骨髓细胞周期紊乱程度,与Lisowska等[7]的体外研究结论一致,可能随着时间延长,可调动更多的周期激酶和蛋白来使DNA损伤修复,这需要进一步的研究证明。
综上所述,亚低温可减缓急性辐射损伤早期骨髓及造血功能损伤,并能促进其较快恢复,机制与亚低温增强照后早期机体抗氧化力、调节骨髓细胞周期等有关。
志谢 本研究得到中国辐射防护研究院放射医学所放射毒理室、放射卫生室和山西医科大学实验动物中心的支持,在此表示衷心的感谢
| [1] | Cucinotta FA, Durante M. Cancer risk from exposure to galactic cosmic rays: implications for space exploration by human beings[J]. Lancet Oncol, 2006, 7:431-435. |
| [2] | Dziegielewski J, Goetz W, Baulch JE. Heavy ions, radioprotectors and genomic instability: implications for human space exploration[J]. Radiat Environ Biophys,2010, 49(3): 303-316. |
| [3] | Baird BJ, Dickey JS, Nakamura AJ, et al. Hypothermia postpones DNA damage repair in irradiated cells and protects against cell killing[J]. Mut Res,2011, 711 (1):142-149. |
| [4] | Citrin D, Cotrim AP, Hyodo F, et al. Radioprotectors and mitigators of radiation-induced normal tissue injury[J]. Oncologist, 2010,15(4):360-371. |
| [5] | Martin RF, Broadhurst S, Reum ME, et al. In vitro studies with methylproamine: a potent new radioprotector[J]. Cancer Res, 2004, 64 (3):1067-1070. |
| [6] | Padjas A, Kedzierawski P, Florek A, et al. Comparative analysis of three functional predictive assays in lymphocytes of patients with breast and gynaecological cancer treated by radiotherapy[J]. J Contemp Brachyther,2012, 4(4): 219-226. |
| [7] | Lisowska H, Brehewens K, Zlzer F, et al. Effect of hypothermia on radiation-induced micronuclei and delay of cell cycle progression in TK6 cells[J]. Int J Radiat Biol, 2014, 90(4):318-324. |
| [8] | Zoerner F, Wiklund L, Miclescu A, et al. Therapeutic hypothermia activates the endothelin and nitric oxide systems after cardiac arrest in a pig model of cardiopulmonary resuscitation[J]. PLoS One,2013, 8(5):e64792. |
| [9] | 张丽, 苏志强, 陈丽霞, 等. 亚低温通过抑制两种凋亡通路对大鼠脑缺血再灌注损伤发挥保护作用[J]. 中风与神经疾病杂志, 2006, 23(3): 318-321. |
| [10] | 刘树铮, 苏旭, 李修义, 等. 医学放射生物学[M]. 北京:原子能出版社,2006. |
| [11] | 胡锴勋, 赵士富, 郭梅, 等. 间充质干细胞对小鼠辐射早期造血组织细胞的细胞周期及凋亡的影响[J]. 中国实验血液学杂志, 2007, 15(6): 1226-1230. |
 2015, Vol. 35
2015, Vol. 35