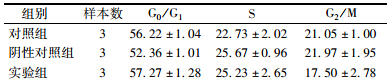2. 530021 南宁, 广西医科大学附属肿瘤医院 物理诊断科
STAT1是信号转导与转录激活因子,其在诱导或抑制肿瘤细胞生成、调节细胞生存和凋亡、增殖等方面发挥着重要的作用[1]。前期研究发现,STAT1在鼻咽癌放射抗拒细胞系CNE-2R中高表达,参与多条信号通路,位于差异基因间相互作用的网络节点上,提示STAT1可能是引起鼻咽癌放射抗拒的关键基因,靶向抑制该基因表达有可能提高鼻咽癌放射敏感性[2]。因此,本研究采用RNAi技术沉默CNE-2R中STAT1表达,检测干扰前后细胞生长、凋亡、周期及放射敏感性变化,初步探讨STAT1与鼻咽癌放射抗拒的关系,预测该基因能否作为逆转鼻咽癌放射抗拒的分子靶点。
1. 实验材料:鼻咽癌放射抗拒细胞系CNE-2R由本实验室诱导建立并保存,293T细胞和DH5α大肠杆菌由上海吉凯基因有限公司提供。慢病毒载体系统购自上海吉凯基因有限公司,该系统由PGCSIL-GFP、pHelper 1.0和pHelper 2.0组成。
2. 主要试剂及设备:RPMI 1640完全培养基、DMEM购自美国GIBCO公司;胎牛血清购于杭州四季青公司;TRIzol试剂购自美国Invitrogen公司;PCR相关试剂由上海吉凯基因技术有限公司合成;Taq酶购于日本TaKaRa公司;质粒提取试剂盒购于上海天根科技有限公司;基因重组所需的酶由美国NEB公司生产;阳性克隆测序由上海美季生物有限公司完成;荧光定量PCR试剂盒购于上海天根科技有限公司;MTT粉购于美国Amresco公司;凋亡试剂盒源于美国罗氏公司。蛋白浓度试剂盒购于上海碧云天生物技术研究所,脱脂奶粉购自上海Mbchem公司,PVDF膜购于北京Solarbio公司(孔径0.22 μm),鼠抗人STAT1一抗购自美国Cell Signaling公司,兔抗人的GAPDH一抗、荧光标记的羊抗鼠及羊抗兔的二抗购自美国KPL公司。
3. 细胞培养:将CNE-2R细胞置于含10%胎牛血清及250 μl青霉素、400 μl链霉素的RPMI 1640的培养液中贴壁生长,在37℃、100%的湿度、5% CO2的条件下培养。
4. 最佳沉默效应siRNA片段筛选及验证:依照siRNA的设计原则,设计并合成4对siRNA、1对阴性对照和1对针对GAPDH 基因的阳性对照。细胞以5×105/孔的密度接种于2个6孔板中,加入不包含抗生素的RPMI 1640培养基,24 h后待细胞的铺至平底80%~85%时进行转染。每孔加入5 μl的siRNA(浓度为100 pmol/L)和6 μl脂质体2000为最佳转染条件。依据上述最佳比例配制脂质体2000,孵育5 min,将其与配制的siRNA轻轻混合,室温下静置20 min。将上述混合液加入含有细胞及培养液的6孔板内,轻轻摇晃6孔板,充分混匀。37℃、CO2培养箱孵育6 h后,更换含血清的RPMI 1640培养基,继续培养24 h,荧光显微镜观察细胞转染情况。采用 RT-PCR检测沉默效果。
5. 慢病毒干扰载体的构建:针对基因STAT1最佳siRNA序列:5′CTGGAAGATTTACAAGATGAA3′,依据慢病毒载体的酶切位点,合成含干扰序列的双链 DNA-Oligo,其两端含酶切位点黏端,直接连入酶切后的含U6启动子载体pGCL-GFP上。重组DNA分子转化感受态细胞,再进行阳性克隆PCR鉴定及测序比对,鉴定出的阳性克隆即为构建成功的目的基因RNA干扰慢病毒载体。再进行慢病毒载体的包装、检测滴度和复感染指数值。
6. 重组病毒感染目的细胞CNE-2R并进行流式分选:选取最佳状态的CNE-2R细胞,以每孔1×105/孔密度接种于6孔板内;孵育过夜,吸弃培养液,PBS洗2次;每孔分别加入10 μl相应的病毒、200 μl的Polybrene、790 μl无血清的RPMI 1640;轻轻摇晃6孔板,使之充分混匀、培养;8 h后弃倒掉液体,加入2 ml完全培养基;48 h荧光显微镜观察荧光。将转染后的细胞,用流式细胞仪分选出GFP(+)细胞,扩大培养。实验分为3组:未转染的对照组、转染阴性对照组及转染目的基因序列的实验组。
7. RT-PCR检测慢病毒介导基因STAT1干扰效果:设计并合成STAT1引物:上游5′CCAAAGGAAGCACCAGAGCC3′,下游5′AGAGCCCACTATCCGAGACACC3′,扩增片段长度171 bp。每组分别设3个复孔、相应的内参孔,每次实验设1个空白对照。反应体系如下:模板2 μl、上游引物0.8 μl、下游引物0.8 μl、PCR混合液9 μl,双蒸水补足体积至20 μl。反应条件:94℃ 预变性3 min,94℃ 30 s、55℃ 30 s、72℃ 45 s,共32个循环,然后,75℃ 5 min。用荧光定量PCR仪进行检测。数据分析采用美国ABI公司的荧光定量PCR仪自带软件进行分析。采用2-ΔΔCt法计算相对表达量,进行统计学分析。
8. MTT法检测基因STAT1干扰前后细胞生长变化:将3组细胞以3.0×103/孔细胞密度接种于96孔板内,培养箱内培养。24 h后弃培养基,每孔加入180 μl新鲜培养基和20 μl(5 mg/ml)MTT。继续培养24 h后吸弃培养液。每孔加入150 μl的DMSO。把酶标板放在振荡器上振荡10 min后,测每组490 nm处的吸光度(A=)值。每组设3个复孔,取均值,绘制生长曲线。
9. 流式细胞仪检测基因STAT1干扰前后细胞凋亡的变化:3组细胞以1.0×105密度接种于6孔板。50 μl的缓冲液加入5 μl的7-AAD(7-amino-actinomycin D)混匀。收集细胞中加入上述混合的7-AAD染液混匀,室温避光反应10 min。反应后加入450 μl的结合缓冲液混匀。加入1 μl的Annexin V-PE混匀,室温避光反应10 min。1 h内用流式细胞仪进行检测。
10. 流式细胞仪检测基因STAT1沉默前后细胞周期的变化:3组细胞经胰酶消化后,PBS洗2次,加入1 ml预冷的70%乙醇,4℃固定过夜;再用PBS洗涤2次,配成1.0×105/ml的细胞悬液,混匀后,以细胞悬液∶PI=1∶1加入适量PI液,4℃下避光孵育30 min;用300目筛网过滤细胞悬液去除粘连的细胞;流式细胞仪分析DNA含量,软件分析G0/G1、S、G2/M各期的细胞数及所占比例。
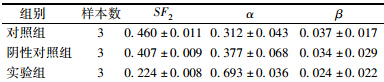
11. 克隆形成实验测基因STAT1沉默前后放射敏感性变化:消化3组细胞,离心半径10 cm,转速1 000 r/min,离心5 min,重悬、计数。根据照射剂量按梯度稀释后接种于6孔板。用6 MV X射线给予剂量分别为0、0.5、1、2、4、6、8、10 Gy照射,每组设置3个复孔。照射后置于37℃、饱和湿度的CO2培养箱中,继续培养10 d。培养过程中,每2~3天换1次培养液;10~14 d后,弃培养液,甲醇固定30 min,姬姆萨溶液染色30 min,计数所形成的集落数(≥50个细胞数为有效的集落);计算不同剂量照射下的细胞存活分数:集落形成率(PE=)=集落数/种植细胞数×100%,存活分数(SF=)=实验组PE=/对照组PE=。应用Graphpad软件进行剂量存活曲线拟合,计算相应的生物学参数α=、β=及SF=2。
12. 统计学处理:数据用x±s形式表示,采用SPSS 17.0软件进行分析。放射生物学参数和细胞生存曲线使用GraphPad Prism 5拟合,计量资料组间差异比较采用单因素方差分析。P为差异有统计学意义。
1. 最佳siRNA干扰片段筛选:采用RT-PCR检测不同siRNA干扰片段沉默效果发现,靶点位于875的siRNA沉默效果最佳。与其对应的靶向干扰序列为5′CTGGAAGATTTACAAGATGAA3′。阴性对照及阳性对照间差异不明显。因此,选择其对应的序列进行后续研究(图 1)。
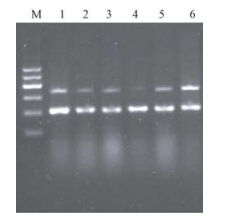 | 注:M.分子标志物;1~4分别为靶点486、647、 1601、875;5.阴性对照;6.阳性对照图 1 RT-PCR方法筛选最佳siRNA |
2. 重组慢病毒感染CNE-2R细胞及阳性细胞的流式分选:LV-shRNA-STAT1慢病毒感染48 h后,阳性的细胞CNE-2R因为能够表达绿色荧光蛋白而在荧光显微镜下呈现出绿色荧光。经流式细胞仪对GFP(+)细胞进行分选,获得了稳定抑制STAT1表达的亚克隆细胞系(图 2)。
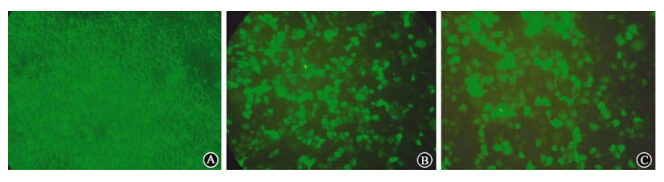 | 图 2 流式细胞分选出的阳性细胞 A. 对照组; B.阴性对照组;C.实验组 |
3. 荧光定量PCR检测STAT1沉默效果:对照组、阴性对照组和实验组的mRNA水平相对表达量分别为1.226±0.046、1.060±0.038和0.235±0.023,实验组低于对照组和阴性对照组(F=429.87,P<0.05),对基因STAT1表达抑制率约为81%。提示慢病毒介导的STAT1能够有效抑制基因STAT1表达。
4. 基因STAT1沉默前后细胞生长变化:结果示于图 3。由图 3可见,对照组和阴性对照组的细胞生长差异无统计学意义,而实验组明显降低(F=3.88~4.63,P>0.05),表明慢病毒介导的STAT1基因沉默使CNE-2R细胞生长受到抑制。
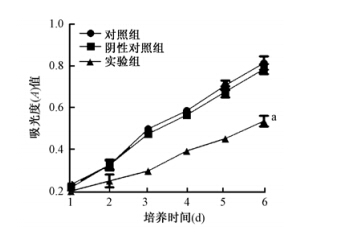 | 注:a与对照组、阴性对照组相比,F=3.88~4.63,P<0.05图 3 基因STAT1干扰前后细胞生长变化 |
5. 基因STAT1沉默前后细胞凋亡变化:与对照组的凋亡细胞(10.95±3.75)%和阴性对照组的(8.11±2.38)%相比,实验组细胞凋亡率明显增加,达(28.97±1.48)%(F=38.13,P),而对照组与阴性对照组相比,差异无统计学意义。结果表明,抑制STAT1表达可以促进CNE-2R细胞凋亡。
6. 基因STAT1沉默前后细胞周期变化:结果列于表 1。由表 1可知,各组之间细胞周期的变化不明显,差异无统计学意义(P=>0.05)。
| 表 1 基因STAT1干扰前后细胞周期变化(%,x±s) |
7. 基因STAT1沉默前后放射敏感性变化:对照组和阴性对照组间的SF=2值及α=/β=比值差异无统计学意义,表明这两组细胞放射敏感性差异无统计学意义;与这两组相比,实验组SF=2值降低、α=/β=比值增高,提示抑制基因STAT1表达可以提高CNE-2R细胞放射敏感性(F==252.80,P),见表 2和图 4。
| 表 2 基因STAT1干扰前后放射敏感性变化(x±s) |
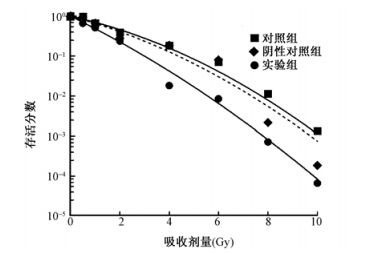 | 图 4 克隆形成实验检测基因STAT1沉默前后放射敏感性 |
STAT1位于IFN通路下游,与头颈部肿瘤的放射抗拒密切相关[3]。肾癌细胞中高表达的STAT1基因具有抗辐射效应[4]。STAT1与乳腺癌细胞放射敏感性密切相关,抑制基因STAT1表达可以显著提高乳腺癌细胞放射敏感性[5]。前期研究发现,STAT1在鼻咽癌放射抗拒细胞CNE-2R中高表达,参与多个生物学过程和多条通路,同时与多个基因存在密切关系,因此,STAT1表达可能与鼻咽癌放射抗拒发生存在一定相关性[2]。基于以上原因,本研究采用慢病毒介导RNAi特异性地沉默CNE-2R中STAT1表达,检测放射敏感性、细胞生长、凋亡及周期变化,初步探索STAT1与鼻咽癌放射抗拒的关系。
邓昊[6]发现,高活性的STAT1是肿瘤细胞存活的必要因素。Amorino等[7]报道,射线诱导STAT1表达与表皮生长因子受体(EGFR)有关,STAT1可能通过调节生长相关的通路在特定条件下促进经射线照射后的肿瘤细胞生长。还有研究发现,基因STAT1与头颈部肿瘤放射抗拒相关,可在核内与DNA结合使相关基因活化,对细胞生长、分化进行调控[8]。下调基因STAT1表达使肾癌细胞生长缓慢、增强放射敏感性[9]。本研究结果显示,抑制STAT1基因表达使放射抗拒细胞CNE-2R生长受到抑制,同时放射敏感性增加。因此,推测基因STAT1可能通过调节细胞生长而影响肿瘤细胞放射敏感性,在鼻咽癌细胞中,STAT1上调表达有可能通过促进放射抗拒细胞生长,从而发挥抗辐射作用。
STAT1被磷酸化后可与P1、Capase-1结合,可以调节细胞分化和凋亡[10]。Zhan等[11]在研究STAT1与乳腺癌放射抗拒关系中发现,在照射后的细胞内加STAT1抑制剂时,凋亡增加。STAT1上调表达可以通过调控相应基因引起受照射后细胞具有抗凋亡作用[12]。以上研究表明,STAT1可以通过调节细胞凋亡而影响细胞放射敏感性。本研究采用流式细胞技术检测STAT1沉默前后细胞凋亡改变,发现实验组细胞凋亡较对照组和阴性对照组明显增加,凋亡率达(28.97±1.48)%,提示干扰STAT1表达可以促进细胞凋亡,增加放射敏感性,支持以往的研究结果。
研究表明,STAT1可以调控DNA损伤后细胞周期[13]。基因沉默后,STAT1可以消除G2/M阻滞,减少细胞修复时间,从而引起放射敏感。STAT1对DNA损伤后细胞周期检测点有调控作用,沉默STAT1基因的细胞在电离辐射诱导的DNA损伤后S期和G2/M期检测点的调节作用失活[14]。研究发现,通过RNA干扰技术降低食管癌细胞中基因STAT1的蛋白表达后,在一定程度上消除了细胞照射后出现的G2/M期阻滞,减少了肿瘤细胞DNA损伤的修复机会,使细胞凋亡比例增大,从而提高细胞的放射敏感性[13]。本研究采用流式细胞技术检测基因STAT1干扰前后细胞周期变化,发现沉默STAT1表达,CNE-2R细胞S期和G2/M期所占的比例差异无统计学意义,与上述研究结果不一致。因此,具体的内在机制有待于进一步研究。
抑制STAT1基因表达而能够使照射后肾癌细胞生长缓慢,凋亡增加[15]。本研究发现,慢病毒介导的RNAi抑制STAT1在放射抗拒细胞系CNE-2R中表达后,可以促进细胞凋亡、抑制生长、提高放射敏感性。STAT1可能通过抑制凋亡和促进细胞生长而使抗拒细胞CNE-2R对射线产生耐受,这与以往研究相符。但其具体机制仍需进一步深入研究。
综上所述,本研究成功构建了慢病毒载体,该载体介导的RNAi能够有效沉默STAT1表达。抑制STAT1在放射抗拒细胞系中表达可以促进细胞凋亡、抑制生长、提高放射敏感性。研究结果显示,STAT1可能通过抑制凋亡和促进细胞生长而使放射抗拒细胞CNE-2R对射线产生耐受,STAT1可能成为鼻咽癌放射增敏分子标志。
| [1] | Efimova EV, Liang H, Pitroda SP, et al. Radioresistance of Stat1 over-expressing tumour cells is associated with suppressed apoptotic response to cytotoxic agents and increased IL6-IL8 signalling[J]. Int J Radiat Biol, 2009, 85 (5): 421-431. |
| [2] | Guo Y, Zhu XD, Qu S, et al. Identification of genes involved in radio-resistance of nasopharyngeal carcinoma by integrating gene ontology and protein-protein interaction networks[J]. Int J Oncol, 2012, 4(1):85-92. |
| [3] | Khodarev NN, Roach P, Pitroda SP, et al. STAT1 pathway mediates amplification of metastatic potential and resistance to therapy[J].PLoS One, 2009,4(6):e5821. |
| [4] | Hui Z, Betten M, Huang D, et al. Radiosensitization by inhibiting STAT1 in renal cell carcinoma [J]. Int J Radiat Biol, 2009, 73 (1): 288-295. |
| [5] | Zhang JF, Chen LH, Wei YY, et al. STAT1 promotes radioresistance of CD44+/CD24- cells in breast[J]. Exp Biol Med, 2011,236 (4): 418-422. |
| [6] | 邓昊. Stat1和survivin及相关蛋白在胃癌中相关性及其临床病理学意义的研究[D]. 武汉:华中科技大学, 2006. |
| [7] | Amorino GP, Hamilton VM, Valerie K, et al. Epidermal growth factor receptor dependence of radiation-induced transcription factor activation in human breast carcinoma cells[J]. Mol Biol Cell, 2002, 13 (7): 2233-2244. |
| [8] | Khodarev NN, Beckett M,Labay E, et al. Stat1 is overexpressed in tumor selected for radioresistance and confers protection from radiation in transduced sensitive cells[J]. Proc Natl Acad Sci USA, 2004, 101 (6): 1714-1719. |
| [9] | Zhu H, Wang Z, Xu X, et al. Inhibition of STAT1 sensitizes renal cell carcinoma cells to radiotherapy and chemotherapy[J]. Cancer Biol Ther, 2012, 13 (6): 401-407. |
| [10] | Yu H, Jove R. The Status of cancer-new molecular targets come of age[J]. Nat Rev Cancer, 2004, 4 (2): 97-105. |
| [11] | Zhan JF, Chen LH, Yuan YW, et al. Stat1 promotes radioresistance of Cd44+/Cd24-/low cells in breast cancer[J]. Exp Biol Med, 2011, 236 (4): 418-422. |
| [12] | Kaganoi J, Watanabe J, Okabe M, et al. STAT1 activation induced apoptosis of esophageal squamous cell carcinoma cells in vivo[J]. Ann Surg Oncol, 2007, 14 (4): 1405-1415. |
| [13] | 李曙光. H2ax、Stat1 RNAi对体外食管癌细胞放射敏感性和细胞周期的影响[D]. 石家庄:河北医科大学, 2011. |
| [14] | Townsend PA, Craqq MS, Davidson SM, et al. STAT1 facilitates the ATM activated checkpoint pathway following DNA damage[J]. J Cell Sci, 2005, 118 (8): 1629-1639. |
| [15] | 王巍. 电离辐射对食管癌细胞中H2ax、Stat1表达的影响[D]. 石家庄:河北医科大学, 2011. |
 2015, Vol. 35
2015, Vol. 35