2. 苏州大学放射医学与防护学院 放射医学与防护重点实验室
将壳聚糖纳米微粒(chitosan-nanoparticles,CS-NP)作为125I-脱氧尿嘧啶核苷酸(125I-UdR)的载体,可阻止125I-UdR在体内被过早降解,同时实现肿瘤靶向运送、细胞内持久缓释的功能,有望以较低的给药剂量实现更大的肿瘤杀伤效果[1]。目前,国内外尚未有这方面的尝试。前期研究已经制备了平均粒径175.8 nm的125I-UdR壳聚糖载药纳米微粒(125I-UdR-chitosan-drug loading nanoparticles,125I-UdR-CS-DLN),其载体材料具有良好的生物相容性与较高的载药量和包封率,其释药特性符合长效制剂特征,具有明显的缓释作用[2,3,4]。结合肝动脉介入给药技术,可实现较好的肝癌被动靶向性,在瘤体内的缓释时间可达48 h以上,并且明显降低了125I-UdR对骨髓造血细胞的抑制和对胃肠道黏膜的不良反应。本研究通过模拟体内的药物作用条件,检测125I-UdR-CS-DLN对肝癌细胞的抑制增殖能力,探讨其对肝癌细胞的内照射生物学效应。
1. 试剂:125I-UdR-CS-DLN和异硫氰酸荧光素标记的壳聚糖纳米微粒(FITC-CS-NP):参照Wang等[3]和Nasti等[5]的方法制备。壳聚糖由浙江金壳生物化学有限公司提供,经进一步脱乙酰化和辐射降解,产物的相对分子质量3×103,脱乙酰度(93.06±2.38)%。TUNEL染色试剂盒为美国罗氏(Roche)公司生产。锥虫蓝、异硫氰酸荧光素(FITC)、月桂酰肌氨酸钠、二甲基亚砜(DMSO)、琼脂糖购自上海生工生物工程有限公司。按说明书配置中性裂解液,制备电泳胶板。
2. 细胞:肝癌细胞系HepG2、人正常肝细胞系HL-7702购自中国科学院上海生命科学研究院细胞资源中心。
3. 动物模型:雄性新西兰兔20只,体重(4.1±0.5)kg,由苏州大学实验动物中心提供。兔源性VX2肿瘤组织块由苏州大学第一附属医院金泳海和南京医科大学附属苏州医院周大勇博士惠赠。兔肝原位VX2肿瘤模型的制备参见文献[6]方法。
4. 仪器和设备:放射性活度仪(CRC-15R,美国Capintec公司),激光共聚焦显微镜(SP2,德国Leica公司),彩色超声仪(Logiq Book XP,美国GE公司),数字减影血管造影仪DSA(AXIOM ARTIS,德国西门子公司),单光子发射计算机断层成像系统SPECT(Forte,荷兰飞利浦公司)。
5. FITC-CS-NP在细胞中的分布: 将1 cm2的盖玻片消毒,置于6孔细胞培养板底部,将对数生长期的HepG2和HL-7702细胞接种于上述6孔板中(1×106/孔),每种细胞接种3孔。在37℃、5% CO2条件下培养24 h,待细胞均匀贴壁生长,融合率达60%~80%后,避光条件下将培养液置换成含50 μg/ml FITC-CS-NP的无血清培养基,培养30 min后终止培养,取出盖玻片,用0℃的PBS(pH 5.5)洗涤3次,4%多聚甲醛固定后,用40%甘油封片,置激光共聚焦显微镜下观察细胞内荧光分布情况。
6. MTT法检测细胞存活率:将对数生长期的HepG2和HL-7702细胞接种于96孔板(1×104/孔),培养24 h,实验组将各孔培养基置换成含不同浓度125I-UdR-CS-DLN的无血清培养基100 μl/孔,放射性活度分别为1、10、37、100、200和500 kBq/孔;对照组加含相同放射性活度125I-UdR的无血清培养基;空白组为不含细胞的等体积培养基,培养30 min后,吸去培养液,洗3次,加含血清培养基继续培养24、48 h后,按常规MTT法处理并计算细胞的存活率:细胞存活率(%)=实验组吸光度(A)值/对照组(A)值×100%,分光光度计570 nm测量。
7. 细胞周期分析:将对数生长期的HepG2和HL-7702细胞接种于直径6 cm无菌培养皿内(5×105/皿),每组设3个平行样。实验组为培养24 h后将培养基换成含0、37 kBq/ml 125I-UdR-CS-DLN的无血清培养基;对照组为相同放射性活度的125I-UdR,培养30 min后洗涤,加含血清培养基培养48 h,用4℃的PBS洗涤2次,70%冰乙醇固定过夜,离心力1 800 rpm/min,离心时间5 min,洗2次后,加2.5 ml生理盐水溶液重新悬浮细胞,缓慢加入4℃的70%乙醇5 ml,冰浴30 min;细胞经300目尼龙滤膜过滤,加100 μl 5 mg/ml RNase溶液,37℃温育30 min后冰浴终止酶作用,PI染色。用流式细胞仪分析细胞周期,氩离子激发PI荧光,激发光波长为488 nm,用620 nm波长滤器检测对数红色荧光。用Multicycle分析软件分别计算G1期、S期和G2期的相对比例,观察细胞周期的变化,计算增殖指数(%)=(S+G2M)/(G0G1+S+G2M)×100%。
8. 中性单细胞凝胶电泳:取对数生长期HepG2和HL-7702细胞,接种于直径6 cm的无菌培养皿内,每皿5×105个细胞,每组设3个平行样。培养24 h,将各孔培养基置换成含125I-UdR-CS-DLN浓度为0和37 kBq/ml的无血清培养基。对照组为相同放射性活度125I-UdR的无血清培养基,培养30 min后,洗涤3次并加含血清培养基,分别于0.5、2和24 h后收样,制成单细胞悬液,计数后按说明书进行中性单细胞凝胶电泳,电泳后胶板经PI(5 μg/ml)染色20 min,脱 色后在荧光显微镜下,每组随机拍摄200个细胞,计算拖尾细胞率,拖尾细胞率(%)=200个细胞中有拖尾的细胞数/200×100%。
9. 彗星图像分析:彗星图像采用波兰费罗兹瓦夫(University of Wroclaw)大学提供的CASP 软件[7],随机选择30 个细胞对彗星图像进行分析。选取尾长、Olive尾矩、彗尾DNA%作为分析指标。
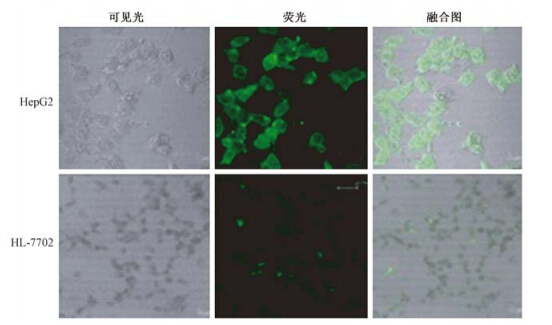 | 图 1 FITC-CS-NP作用于HepG2和HL-7702细胞后的激光共聚焦显微镜观察结果 |
10. 肝动脉介入给药和SPECT显像:取成活后的兔肝原位癌模型15只,采用随机数字表法,分成实验组和对照组,每组6只,另取3只为假手术空白组。实验组为麻醉后使用3F微导管经股动脉插管,超选择至肝固有动脉,灌注125I-UdR-CS-DLN 72 MBq,结扎股动脉;对照组为灌注相同剂量的125I-UdR;空白组为灌注等体积PBS。SPECT显像:从实验组和对照组各选取3只状态良好的实验兔,于用药后24 h作SPECT显像,采用低能高分辨准直器(LEHR),矩阵256×256,采集图像,观察药物分布,勾画感兴趣区(ROI),计算肿瘤组织/非肿瘤组织比值(T/NT)。于48 h后将上述实验兔处死,取肿瘤组织做TUNEL染色。
11. 肿瘤组织TUNEL染色:将实验组和对照组的肿瘤组织经10%中性缓冲甲醛固定4 h以上,石蜡包埋、切片,按试剂盒说明书作TUNEL染色,再用苏木素轻度复染,脱水、透明、封片,显微镜下观察。
12. 统计学处理:数据用x±s表示。 采用SPSS 19.0软件进行分析,组间比较用t检验。P<0.05为差异有统计学意义。
1. FITC-CS-NP在细胞中的分布:利用激光共聚焦显微镜,观察FITC-CS-NP在肿瘤内的靶向聚积能力,图 1是FITC-CS-NP作用于HepG2和HL-7702细胞后30 min的共聚焦图像,可见HL-7702细胞表面荧光强度略高,细胞质内荧光强度明显弱于HepG2细胞;HepG2细胞质内有明显的荧光强度增高,大致呈现出从外向内逐渐递减的趋势,细胞核可见少量荧光物质聚集,部分细胞可见到核仁内荧光强度高而均匀。表明CS-NP进入肝癌细胞的量大于正常肝组织细胞。
2. 细胞存活率:结果列于表 1。由表 1可知,在低剂量范围(1~10 kBq/ml),125I-UdR-CS-DLN作用于HL-7702和HepG2细胞后24和48 h时的存活分数差异无统计学意义(P>0.05),而高剂量范围(37~500 kBq/ml)两种细胞48 h时的存活率显著低于24 h(t=5.45~10.45,P<0.05),表明较高剂量的125I-UdR-CS-DLN对肝癌细胞和正常肝细胞都有一定的杀伤作用。在高剂量范围,HepG2细胞24 h时的存活分数明显低于HL-7702细胞(t=-5.43~-2.32,P<0.05),48 h时的情况与24 h类似(t=-6.31~-4.31,P<0.05),表明较高剂量125I-UdR-CS-DLN对肝癌细胞的杀伤作用更强,损伤效应出现更早。
| 表 1 Parameters used in our simulations. Average durations of cell-cycle phases were empirical and the variations of them were assumed. Two thresholds were assumed based on the experimental data |
3. 细胞周期分析:流式细胞仪检测结果列于表 2。由表 2可知,与空白组相比,经37 kBq/ml 125I-UdR-CS-DLN作用24 h后,HL-7702和HepG2细胞S期细胞的百分比显著下降(t=-10.59、-21.37,P<0.05),G1期比例显著升高(t=8.63、30.01,P<0.05);125I-UdR作用24 h后,HL-7702和HepG2细胞S期细胞的百分比显著下降(t=-12.31、-7.37,P<0.05),G1期细胞的显著升高(t=14.23、21.96,P<0.05)。不同的是,125I-UdR-CS-DLN和125I-UdR作用后,HL-7702细胞G2/M期比例显著增加(t=8.17、2.79,P<0.05),而HepG2细胞G2/M期比例显著下降(t=-4.39、-6.59,P<0.05)。表明125I-UdR-CS-DLN和125I-UdR对增殖期的细胞都有杀伤作用。
| 表 2 125I-UdR-CS-DLN作用24 h后对HL-7702和HepG2细胞增殖周期的影响(%,x±s) |
4. DNA损伤程度检测:单细胞凝胶电泳结果列于表 3和图 2。用CASP软件分析DNA双链断裂(DSB)程度,经125I-UdR-CS-DLN作用2 h后,HL-7702和HepG2细胞的DNA损伤程度都高于同等剂量125I-UdR对照组,表现为实验组细胞荧光图像发生拖尾的长度延长,拖尾率以及DNA迁移到尾部的比例也增高,且差异具有统计学意义(Olive尾矩:t=4.73、7.78,P<0.05;彗尾DNA%:t=6.38、17.47,P<0.05)。125I-UdR-CS-DLN进入正常肝细胞HL-7702的量明显少于HepG2,所造成的DNA损伤也明显较轻。但与125I-UdR 对正常肝细胞的损伤相比,依然略高。
| 表 3相同辐射剂量药物作用不同时间后细胞的DNA损伤情况 |
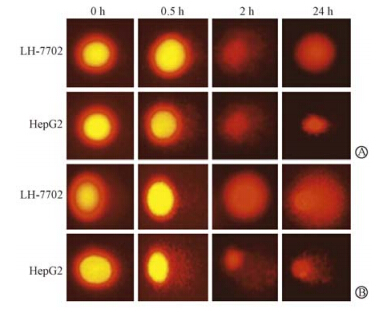 | 图 2 相同辐射剂量药物作用24 h后细胞的DNA损伤彗星现象A.对照组;B.实验组 |
药物作用24 h后的彗星实验结果示于表 3和图 2,表现为实验组DNA尾长、尾矩、拖尾率以及DNA迁移到尾部的比例依旧高于125I-UdR组,且差异具有统计学意义(Olive尾矩:t=4.49、6.11,P<0.05;彗尾DNA%:t=7.37、7.04,P<0.05)。结果表明,实验组细胞的DNA损伤修复能力远低于对照组。实验组中,肝癌细胞系HepG2 的DNA损伤后修复能力 显著低于HL-7702(Olive尾矩:t=2.94,P<0.05;彗尾DNA%:t=10.64,P<0.01)。
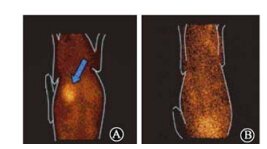 | 注:箭头指示部位为肿瘤图 3 VX2兔肝原位种植肿瘤模型影像A.实验组;B.对照组 |
5. 肝动脉介入灌注125I-UdR-CS-DLN对原位肝癌的致凋亡作用:成功制备兔肝VX2肿瘤原位模型,选取其中肝左叶单发病灶者15只,直径(9.2±1.3)mm,CT引导下采用Seldinger微导管经股动脉超选择至肝动脉处灌注125I-UdR-CS-DLN 72 MBq,可见Seldinger微导管可成功超选择至肝左动脉,灌注的药物主要释放在瘤体内及周围较局限的范围内。由于肿瘤内部新生血管丰富,血管生长混乱且多转折扭曲,血流不畅,使药物得以在肿瘤内部高浓度聚积。
24 h后SPECT影像结果示于图 3。由图 3可见,实验组瘤体放射性强度高于周边组织,值达到4.49±1.22,肿瘤影像清晰;125I-UdR对照组除膀胱有微弱显影外,全身放射性强度极弱,已无法获得完整的影像。可见125I-UdR在灌注后被机体快速清除,而125I-UdR-CS-DLN由于具有缓释特性,可以在瘤体内持续24 h以上缓慢释放。
TUNEL染色结果示于图 4。由图 4可见,用药后48 h,125I-UdR-CS-DLN可使兔肝原位肿瘤细胞产生明显的凋亡,而125I-UdR作用后肿瘤组织与假手术组无明显差别,都为阴性结果。
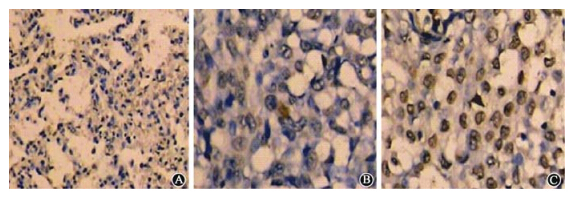 | 注:棕色斑点指示为TUNEL染色阳性,表明存在DNA断裂所致的细胞凋亡图 4 VX2兔肝原位肿瘤经肝动脉介入灌注125I-UdR-CS-DLN和125I-UdR 48 h后的镜下表现 TUNEL染色A.空白组 ×40; B.对照组 ×100; C.实验组 ×100 |
纳米药物载体可实现靶向释放药物,保护药物不被过早降解,增加药物进入细胞的量,增强对肿瘤细胞的杀伤效力[8,9,10,11]。前期研究表明,125I-UdR-CS-DLN进入肿瘤细胞的量远大于正常细胞,且在细胞质中滞留时间较长,其辐射损伤效应也应该有别于以往的研究结果。
以往关于125I-UdR的细胞生物学效应研究中,大多将125I-UdR与细胞作用24 h甚至更长时间[12,13,14,15]。但在实际应用中, 125I-UdR在生物体内的半衰期仅5 min。因此,本研究将药物与细胞的作用时间控制在30 min,模拟体内的药物作用条件,评估125I-UdR-CS-DLN对细胞的辐射损伤效应,并通过体内原位肿瘤模型加以验证。
在30 min内,125I-UdR的入胞量很少,而 125I-UdR-CS-DLN可以快速进入细胞并大量积聚于细胞质内,使得二者的细胞辐射损伤效应有明显的区别。同时,在较高浓度时125I-UdR-CS-DLN对正常肝细胞的损伤也强于125I-UdR,这可能是由于本实验用的正常肝细胞是永生化细胞系,其增殖活力和频率以及胞吞能力都高于生物体内的正常组织细胞,因此摄入的125I-UdR-CS-DLN要比体内正常组织细胞多,并不能代表药物在体内的辐射损伤效应。
DNA损伤修复的研究结果表明, 摄入125I-UdR-CS-DLN的细胞组DNA损伤修复能力低于125I-UdR组,这主要由于125I-UdR-CS-DLN具有一定的细胞内缓释能力,导致125I的俄歇电子能量沉积于DNA链上时间较长,DNA内照射损伤效应时相延长,且持续的内照射延缓阻止了DNA损伤修复;另外,摄入125I-UdR-CS-DLN时,肝癌细胞系HepG2的DNA损伤后修复能力明显低于HL-7702,其原因是125I-UdR掺入DNA的量取决于DNA复制速度,肝癌细胞的增殖能力旺盛,倍增时间短,DNA复制更为活跃。
125I-UdR-CS-DLN进入肝癌细胞的量大于125I-UdR,其内照射引起的DNA辐射损伤效应更强,可明显加剧肝癌细胞的凋亡,并阻止DNA损伤修复。
| [1] | Haley B, Frenkel E. Nanoparticles for drug delivery in cancer treatment [J]. Urol Oncol, 2008, 26(1):57-64. |
| [2] | 杨辰,刘芬菊,宋妙丽,等. 125I-脱氧尿嘧啶核苷-壳聚糖载药纳米微粒的研制和鉴定[J]. 中华放射医学与防护杂志,2010,30(6):650-654. |
| [3] | Wang K, Yin R, Tong Z, et al. Synthesis and characterization of water-soluble glucosyloxyethyl acrylate modified chitosan [J]. Int J Biol Macromol, 2011, 48(5):753-757. |
| [4] | Haley B, Frenkel E. Nanoparticles for drug delivery in cancer treatment[J]. Urol Oncol, 2008, 26(1): 57-64. |
| [5] | Nasti A, Zaki NM, Leonardis P, et al. Chitosan/TPP and chitosan/TPP-hyaluronic acid nanoparticles: systematic optimisation of the preparative process and preliminary biological evaluation[J]. Pharm Res, 2009, 26(8):1918-1930. |
| [6] | Lee KH, Liapi E, Buijs M, et al. Considerations for implantation site of VX2 carcinoma into rabbit liver[J]. J Vasc Interv Radiol, 2009, 20(1):113-117. |
| [7] | Konca K, Lankof A, Banasik A, et al. A cross-platform public domain PC image-analysis program for the comet assay[J]. Mutat Res, 2003, 534(1-2):15-20. |
| [8] | Power S, Slattery MM, Lee MJ, et al. Nanotechnology and its relationship to interventional radiology. Part II: drug delivery, thermotherapy, and vascular intervention[J]. Cardiovasc Intervent Radiol, 2011, 34(4):676-690. |
| [9] | El-Far M, Elshal M, Refaat M, et al. Antitumor activity and antioxidant role of a novel water-soluble carboxymethyl chitosan-based copolymer[J]. Drug Dev Ind Pharm, 2011, 37(12): 1481-1490. |
| [10] | Trapani A, Sitterberg J, Bakowsky U, et al. The potential of glycolchitosan nanoparticles as carrier for low water soluble drugs[J]. Int J Pharm, 2009, 375(1-2):97-106. |
| [11] | Zhang J, Li C, Zhang X, et al. In vivo tumor-targeted dual-modal fluorescence/CT imaging using a nanoprobe co-loaded with an aggregation-induced emission dye and gold nanoparticles[J]. Biomaterials, 2015, 42:103-111. |
| [12] | Elmroth K, Stenerlow B. DNA-incorporated 125I induces more than one double-strand break per decay in mammalian cells [J]. Radiat Res, 2005, 163(4):369-373. |
| [13] | Pomplun E, Sutmann G. Is coulomb explosion a damaging mechanism for 125I-UdR? [J]. Int J Radiat Biol, 2004, 80 (11-12): 855-860. |
| [14] | 杨辰,何扬,申咏梅,等. 125I-脱氧尿嘧啶核苷对胰腺癌细胞Bax-Pc的杀伤作用[J].中华核医学杂志, 2004, 24(3):136-138. |
| [15] | Yang W, Zhao JG, Li XY, et al. Anti-tumor effect of 125I-UdR in combination with Egr-1 promoter-based IFN γ gene therapy in vivo[J]. Radiat Environ Biophys, 2010, 49 (4): 705-714. |
 2015, Vol. 35
2015, Vol. 35