粒子植入后患者靶区及危及器官的实际受照剂量是影响疗效和并发症的关键,术后的验证计划是评价前列腺癌粒子植入质量及肿瘤实际受照剂量的金标准[1]。应用治疗计划系统(TPS)计算剂量时,受靶区范围,125I粒子位置、活度等多种因素影响。粒子植入术后,肿瘤由于射线的杀伤作用,靶体积逐渐变小,粒子也因肿瘤的缩小发生移位,理论上会影响肿瘤靶区的周边剂量及靶区内剂量分布的均匀度,肿瘤的实际受照剂量也相应发生变化。本研究选取肺恶性肿瘤粒子植入患者,探讨术后1月靶区变化对剂量学的影响。
1. 临床资料:选取2011—2013年期间本院收治的14例肺恶性肿瘤患者,年龄29~89岁,中位年龄71岁,男性12例,女性2例,其中,右肺腺癌Ⅳ期3例,左肺低分化鳞癌Ⅲb期1例,右肺小细胞肺癌Ⅳ期2例,左肺腺棘细胞癌Ⅳ期1例,右肺低分化鳞癌2例,右肺高分化腺癌Ⅱ期术后1例,直肠高分化腺癌肺转移1例,右肾透明细胞癌肺转移1例,胃腺癌肺转移1例,脊索瘤肺转移1例,肿瘤大小1.5~7.2 cm;所有患者接受125I粒子植入及支持治疗,设定处方剂量>60 Gy,粒子活度1.11×107~2.22×107 Bq。所有病灶均在CT引导下采用非模板方式植入粒子,粒子分布为非均匀性,术后即刻行验证计划,周边剂量D90(64±18)Gy,正常肺组织及脊髓剂量均在耐受剂量以下。术后随访未见相关不良反应发生,术后1月复查CT应用WHO实体瘤缓解标准[2],评价肿瘤病灶客观缓解情况并再次行验证计划。
2. 材料和设备: 6711-99型放射性125I粒子,粒子外壳用钛合金密封,直径0.8 mm,长度4.5 mm;γ射线能量27~35 keV,放射性活度1.11×107~2.22×107 Bq,半衰期59.6 d(上海欣科医药公司);3D-TPS(Prowess 3D Version 3.02,美国SSGI公司)。
3. 实验设计:根据肿瘤靶区变化分为靶区变化和靶区不变组。靶区变化组:应用术后1个月复查CT勾画靶区,识别粒子,粒子活度为植入时的初始活度衰变1个月后的活度,为0.70×107~1.59×107 Bq;靶区不变组:假设术后1个月肿瘤靶区及粒子位置不变,应用术后当日CT勾画靶区。观察两组的V(肿瘤的靶体积)、D90(90%靶体积的吸收剂量)、V90(90%处方剂量覆盖的体积占靶体积的百分比)、V100和V150的差异。应用公式Vd=(V\-B-V\-A)/VB,计算两组间肿瘤靶体积的差值百分比(%);应用公式D90 d=(D90A-D90B)/D90B×100%,计算两组间D90的差值百分比(%),考察Vd和 D90 d之间的关系。
4. 统计学处理:计量数据以x±s表示,利用SPSS 13.0进行分析。两组间V90和V150的差异比较采用配对t检验,V、D90和V100的差值d不满足正态分布,采用Wilcoxon符号秩检验。P<0.05为差异有统计学意义。
1. 两组肿瘤靶体积(V)及剂量学参数比较:结果列于表 1。由表 1可知,靶区变化组与不变组相比,肿瘤靶体积(V)下降(z=-3.17,P <0.05),周边剂量(D90)及V90等体积参数值均增加(z=-3.17,t=4.65,P<0.05),说明肿瘤靶区变化显著影响周边剂量。
| 表 1 两组肿瘤靶体积(V)及剂量学参数比较(x±s) |
2. 两组肿瘤靶体积(V)和D90的差值百分比如图 1所示,V的差值百分比为6.7%~82.5%,相应的D90差值百分比在4.4%~163.2%之间。结果显示,随两组肿瘤靶体积差值百分比增大,D90的差值百分比也呈增大趋势,说明术后相同时间内肿瘤靶体积缩小越多,周边剂量变化越大。
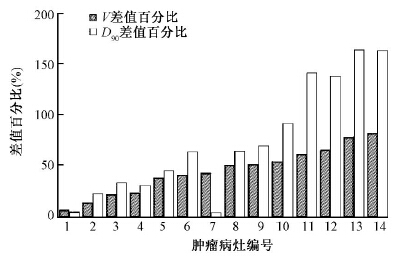 | 图 1 靶区变化组和靶区不变组肿瘤靶体积(V)和D90的差值百分比 |
目前,B超引导下经会阴125I粒子组织间植入治疗为早期前列腺癌的标准治疗手段[3, 4, 5],术后验证计划是评价前列腺癌粒子植入质量及实际受照剂量的金标准,以CT为基础的验证计划是前列腺癌术后验证的主要方法[1]。应用TPS计算周边剂量时,受靶区范围、粒子位置、粒子活度等多种因素影响,在粒子植入术后,靶体积逐渐变小,粒子也因肿瘤的缩小发生移位,从而影响肿瘤靶区的周边剂量及靶区内剂量分布的均匀度。因此,肿瘤的实际受照剂量也随之发生变化。
粒子植入时,TPS计算的处方剂量是在肿瘤靶体积及粒子位置不变的前提下,粒子完全衰变后肿瘤靶区吸收的剂量。在实际的临床应用中,肿瘤的靶体积是动态变化的,靶体积的改变显著影响肿瘤的周边剂量。Pinkawa等[6]对前列腺癌粒子植入患者术后第1天及第30天分别行验证计划,得出前列腺的体积由第1天的(49±12)cm3降至第30天的(40±9)cm3;D90从(138±21)Gy升至(151±30)Gy;V100从87%±7%升至90%±7%。本研究中,术后1个月肺肿瘤的靶体积明显减小,周边剂量(D90)及V90等体积参数均升高,说明肿瘤靶体积缩小显著影响周边剂量。
125I粒子植入术后肿瘤靶体积缩小导致粒子与周围正常组织间的距离减小。Gejerman等[7]研究表明,对于组织间种植治疗,在放射源与组织界面之间,极小体积的组织所吸收的射线剂量非常大,在肿瘤治疗中,倘若相似剂量的射线过多为正常组织吸收,则会引起严重并发症。Taussky等[8]研究得出前列腺癌患者粒子植入术后1个月,由于前列腺体积的减小,每1 cm3直肠的受照量平均增加39.2 Gy。本研究中,肿瘤靶体积缩小越明显,D90变化也越大,肿瘤缩小明显者其D90甚至超过术后当天的验证剂量,高达150 Gy,若此肿瘤病灶临近重要组织或器官,可能引起严重并发症。上述结果提示为避免出现严重并发症,在粒子植入制定治疗计划时需考虑术后肿瘤的缩小速度,根据传统放疗经验,放疗敏感的肿瘤致死剂量<80 Gy,若剂量过高会迅速杀死肿瘤细胞,肿瘤液化坏死,导致粒子聚集,局部出现超高剂量区[9]。因此,对于放疗敏感或高度敏感的实体肿瘤,应该制定较低的处方剂量;而对于分化程度高、质地坚硬、不易液化坏死等放疗不敏感肿瘤其处方剂量可相对较高。
本研究中,有1例患者的肿瘤靶体积虽明显缩小,但周边剂量未发生明显变化,结果较理想。但是,肿瘤如何缩小才能得出理想的周边剂量以及肿瘤的缩小速度,125I粒子位置的变化,肿瘤的病理类型,给予肿瘤多大处方剂量,选用何种粒子活度,肿瘤的大小等有无影响,仍需进一步研究。
| [1] | Stock RG, Stone NN. Importance of post-implant dosimetry in permanent prostate brachytherapy[J]. Eur Urol, 2002, 41(4):434-439. |
| [2] | Sasaki T. New guidelines to evaluate the response to treatment“RECIST”[J]. Gan To Kagaku Ryoho, 2000, 27(14):2179-2184. |
| [3] | Blasko JC, Grimm PD, Ragde H. Brachytherapy and organ preservation in the management of carcinoma of the prostate[J]. Semin Radiat Oncol, 1993, 3(4):240-249. |
| [4] | Blasko JC, Wallner K, Grimm PD, et al. Prostate specific antigen based disease control following ultrasound guided 125iodine implantation for stage T1/T2 prostatic carcinoma[J]. J Urol, 1995, 154(3):1096-1099. |
| [5] | Stock RG, Stone NN, Wesson MF, et al. A modified technique allowing interactive ultrasound-guided three-dimensional transperineal prostate implantation[J]. Int J Radiat Oncol Biol Phys, 1995, 32(1):219-225. |
| [6] | Pinkawa M, Gagel B, Piroth MD, et al. Changes of dose delivery distribution within the first month after permanent interstitial brachytherapy for prostate cancer[J]. Strahlenther Onkol, 2006, 182(9):525-530. |
| [7] | Gejerman G, Mullokandov E, Saini AJ, et al. The effects of edema on urethral dose following palladium-103 prostate brachytherapy[J]. Med Dosim, 2002, 27(3):221-225. |
| [8] | Taussky D, Yeung I, Williams T, et al. Rectal-wall dose dependence on postplan timing after permanent-seed prostate brachytherapy[J]. Int J Radiat Oncol Biol Phys, 2006, 65(2):358-363. |
| [9] | 谷铣之,殷蔚伯,余子豪,等. 肿瘤放射治疗学[M]. 4版. 北京:中国协和医科大学出版社,2007:93-94. |
 2015, Vol. 35
2015, Vol. 35



