2. 223300 淮安, 南京医科大学附属淮安第一医院放疗科
食管癌手术切除的Ⅱ/Ⅲ期食管癌患者5年生存率较低(20%左右)[1, 2]。而术后化疗、术后放疗或术前放疗均无足够的证据表明可以进一步提高治疗效果[3, 4, 5];虽然很多食管癌术前同步放化疗临床试验结果相互矛盾[6, 7, 8],但有些研究显示可以减少局部复发,提高生存率[6, 9]。食管癌术前同步放化疗临床试验显示术后病理完全缓解者预后较好[10],但这种预后判断是基于术后的病理结果,术前放化疗后影像学近期疗效评价能否判断预后非常重要,因为在术前准确的判断预后可以给患者提供更多的治疗选择。本研究回顾性分析南京医科大学附属淮安第一医院145例食管癌术前放化疗患者总生存期与病理完全缓解、X射线造影完全缓解及实体瘤疗效评价标准(RECIST)完全缓解的关系。
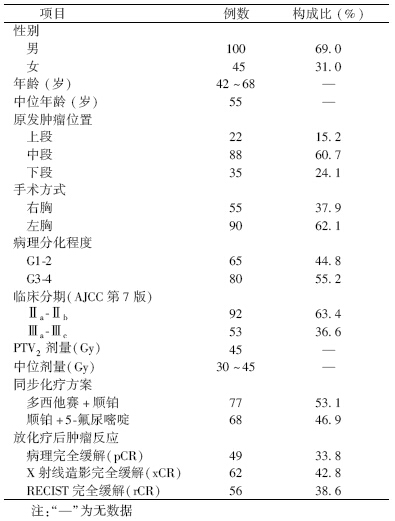
1.临床资料:选择本院2005年至2009年连续145例食管癌术前放化疗患者进行回顾性分析。本研究病例入组标准:病理确诊的可手术的Ⅱ/Ⅲ期食管癌;行术前同步放化疗的患者,并按计划完成了根治性手术;放化疗后于手术前完成X射线造影、超声内镜(EUS)及CT检查患者;随访资料完整者。临床资料收集还包括患者年龄、性别、分期、病变部位、病理类型、化疗方案、放疗剂量、X射线造影疗效评价结果、RECIST近期疗效评价结果及术后肿瘤病理缓解情况。按照AJCC第7版分期系统对手术后患者重新分期。患者一般资料见表 1。
| 表 1 145例食管癌患者一般资料 |
2.放射治疗方法:全部患者采用三维适形或简单调强技术,德国西门子Oncor或Primus 加速器行放射治疗,并于CT下增强连续扫描,扫描层厚5 mm。获取定位图像后在CMS XIO 计划系统内勾画出病灶及重要功能器官的轮廓。靶区勾画1原发肿瘤GTV(GTVnx):根据食管造影片和CT检查结果共同确定食管原发病灶,淋巴结以CT检查为根据,为GTVnd。2CTV1及CTV2确定:原发肿瘤GTV勾画好以后,GTVnx上下方向外放2.0~3.0 cm,左右前后方向外放0.5 cm作为CTV1;CTV2为锁骨以上环甲膜以下淋巴引流区及胸部食管中下段2、4、5、7 淋巴引流区(食管上段肿瘤放疗采用调强技术保护颈段食管以便吻合)。3PTV确定:CTV1外放0.5 cm形成PTV1,在CTV2 基础上外放0.5 cm为PTV2。三维适形放疗仅PTV2 45 Gy/ 25 次;调强放疗时PTV1 50 Gy/ 30 次,PTV2 45 Gy/ 25 次。双侧肺:V20≤25%,V30 ≤20%;脊髓:最大剂量≤45 Gy。在满足计划要求后,于模拟机下进行移位。首次治疗通过电子射野影像系统(EPID)进行位置验证。
3. 化学治疗:多西他赛65 mg/m2,第1天;顺铂65 mg/m2,第1天;第22天重复,或顺铂65 mg/m2,第1天;5-氟尿嘧啶400 mg/m2,第1~5天,第29天重复。 放射治疗期间共化疗两个周期。
4. 手术治疗:术前放化疗结束后4~6周手术,术前评估包括:体检、胸部及腹部CT、食管超声内镜、食管钡餐、颈部彩超、电子支气管镜等检查。行常规的胸腹二野淋巴结清扫。
5. 随访:术后常规定期复查,存活患者至少随访满5年。每次复查的内容包括:体检,胸部X射线/食管吞钡、腹部B超,胸腹部CT检查。
6. 观测指标:术前放化疗后于手术前完成X射线造影、EUS及CT检查。临床疗效评价采用实体瘤疗效评价标准(RECIST)[13],以食管原发灶长轴作为测量基线(EUS及CT联合)。X射线造影疗效评价采用1989 年万钧制定的标准进行评价[12]。
7. 统计学处理:采用SPSS 17.0 软件进行统计分析,每种影像学检查方法与生存率相关的用Kaplan-Meier法,并用双尾的Log-rank法进行显著性检验;多因素分析采用Cox比例风险模型评估独立的预后因素。P<0.05为差异有统计学意义。
1.病理缓解情况与总生存率:全部145例患者,pCR率33.8%(49/145),1、3、5年总生存率为79.3%(115/145)、53.8%(78/145)、36.6%(53/145)。pCR与NpCR患者1、3、5年总生存率分别为87.8(43/49)、79.6%(39/49)、61.2%(30/49)与75%(72/96)、40.6%(39/96)、24.0%(23/96),差异有统计学意义(χ2=20.215,P<0.01),见图 1。
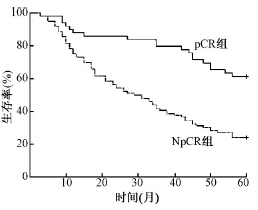 | 图 1 病理完全缓解组(pCR组)与病理 未达完全缓解组(NpCR组)的生存曲线 |
2. X射线造影疗效评价与总生存率:术前放化疗后4周行X射线造影进行疗效评价,xCR率42.8%(62/145),62例达xCR的患者术后pCR者36例。xCR与NxCR患者1、3、5年总生存率分别为80.6%(50/62)、66.1%(41/62)、51.6%(32/62)与75%(65/83)、44.6%(37/83)、25.3%(21/83),两组差异有统计学意义(χ2=8.895,P<0.05,图 2)。
 | 图 2 X射线造影完全缓解组(xCR组)与X射线 造影未达完全缓解组(NxCR组)的生存曲线 |
3. RECIST临床疗效评价与总生存率:RECIST以食管原发灶长轴作为测量基线评价肿瘤消退情况,术前放化疗后4周复查评价,rCR率38.6%(56/145),56例达rCR患者术后pCR者40例。rCR患者与NrCR患者1、3、5年总生存率分别为83.9%(47/56)、69.6%(39/56)、53.6%(30/56)与76.4%(68/89)、46.1%(41/89)、25.8%(23/89),差异有统计学意义(χ2=10.862,P<0.05),见图 3。
 | 图 3 RECIST完全缓解组(rCR组)与RECIST 未达完全缓解组(NrCR组)的生存曲线 |
4. Cox多因素分析:将病理缓解情况、X射线造影疗效及RECIST疗效数据代入Cox模型进行多因素分析,结果显示病理完全缓解是独立预后因素(HR=0.333,95%CI:0.200~0.554,P<0.05)。
在欧美,术前同步放化疗是局部进展期食管癌最常用的治疗手段,但对提高食管癌生存率的价值未达共识[6, 7, 8, 9],不管结果一致与否,很多临床试验均显示术后病理完全缓解者预后较好[10]。但这种预后判断是基于已经手术的患者,对预后不良的患者显然已经失去更有针对性治疗的机会,如果在术前就将这部分患者通过影像学检查筛选出来,或许有机会采取针对性更积极的治疗手段。本研究的目的是分析X射线造影疗效评价、RECIST临床近期疗效评价及术后病理缓解情况与预后的关系,以便为术前影像学评价疗效提供依据。结果显示,X射线造影、RECIST及病理检查完全缓解患者5年总生存率均优于部分缓解和无缓解患者,说明术前影像学评价可以很好的判断疗效。虽然如此,在进行多因素分析时,仅pCR为独立预后因素。因此,pCR依然是判断疗效的金标准。
目前,FDG-PET越来越多地用于食管癌的分期,对评价淋巴结转移及远处转移价值较大,对准确评估T分期价值较小[13]。FDG-PET可以用于评价新辅助治疗组治疗后肿瘤的反应。在一个前瞻性研究中,FDG-PET用于评价新辅助治疗组化疗后远端食管和食管胃结合处腺癌对治疗的早期反应,对于治疗后反应较好的患者其生存明显好于无反应者。不仅如此,该研究尚显示对肿瘤治疗反应良好的患者有较高的R0切除及较高的病理完全缓解率[14]。其他许多研究也证实了新辅助治疗后肿瘤组织内葡萄糖早期快速的变化与预后的关系[15]。但FDG-PET检查价格昂贵,需要在治疗前及治疗中检查两次,不能常规开展,因此,寻找价格低廉的影像学检查就显得相当重要。
国内外很多学者在探索术前同步放化疗后影像学检查结果对食管癌预后价值判断。FFCD9201试验结果显示,术前同步放化疗后EUS检查结果为食管癌独立预后因素[16]。沈文斌等[17]报道食管癌根治性放化疗后近期疗效显示完全缓解(X射线造影)为独立预后因素。相关的研究和本研究得到的结论基本一致,说明影像学疗效评价可以很好地判断食管癌患者术前同步放化疗的预后。
CT检查依然是目前最常用的肿瘤分期手段,但对T分期的准确率较低,文献报道CT对T分期的准确性为43.0%~68.0%[18],因为CT仅从食管厚度来判断肿瘤情况,不能很好地分辨正常组织及肿瘤组织。而EUS下可以很好地显示食管壁的组织学层次具有对应关系。有研究显示,EUS对T分期的准确率为75%~90%[19],其对N分期诊断的准确率为58.0%~66.0%。因此,CT与EUS有一定的互补性,两者联合应用可以提高食管癌T、N分期准确率。本研究pCR者共49例,62例xCR患者术后病理达pCR者有36例,56例rCR患者达pCR者有40例,说明X射线造影缓解情况、RECIST缓解情况与术后病理缓解情况有较高的一致性,而CT与EUS联合评价的RECIST缓解情况与pCR一致性更高。
总的来说,虽然食管癌术前放化疗存在争议,但美国国立综合癌症网络(NCCN)、美国临床肿瘤学会(ASCO)已经把术前同步放化疗联合手术治疗食管癌写入治疗指引并作为标准治疗;术后pCR为食管癌术前放化疗的独立预后因素;虽然xCR、rCR与pCR有较高的一致性,并较NxCR、NrCR明显提高了生存率,可以指导临床进行疗效判断,pCR为独立预后因素,因此,术后pCR依然是食管癌术前同步放化疗疗效判断的金标准。
| [1] | Urschel JD, Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cance[J]. Am J Surg, 2003, 185(6):538-543. |
| [2] | Wobst A, Audisio RA, Colleoni M, et al. Oesophageal cancer treatment:studies, strategies and facts[J]. Ann Oncol, 1998, 9(9):951-962. |
| [3] | Bhansali MS, Vaidya JS, Bhatt RG, et al. Chemotherapy for carcinoma of the esophagus:a comparison of evidence from meta-analyses of randomized trials and of historical control studies[J]. Ann Oncol, 1996, 7(4):355-359. |
| [4] | Fok M, McShane J, Law SYK, et al. Prospective randomised study on radiotherapy and surgery in the treatment of oesophageal carcinoma[J]. Asian J Surg,1994,17(3):223-229. |
| [5] | Arnott SJ, Duncan W, Gignoux M, et al. Preoperative radiotherapy for esophageal carcinoma[J]. Cochrane Database Syst Rev, 2005, CD001799. |
| [6] | Bosset JF, Gignoux M, Triboulet JP, et al. Chemoradiotherapy followed by surgery compared with surgery alone in squamous-cell cancer of the esophagus[J]. N Engl J Med,1997, 337(3):161-167. |
| [7] | Urba SG, Orringer MB, Turrisi A, et al. Randomized trial of preoperative chemoradiation versus surgery alone in patients with locoregional esophageal carcinoma[J]. J Clin Oncol, 2001, 19(2):305-313. |
| [8] | Burmeister BH, Smithers BM, Gebski V, et al. Surgery alone versus chemoradiotherapy followed by surgery for resectable cancer of the oesophagus:a randomised controlled phase III trial[J]. Lancet Oncol,2005,6(9):659-668. |
| [9] | Suntharalingam M, Moughan J, Coia LR, et al. Outcome results of the 1996-1999 patterns of care survey of the national practice for patients receiving radiation therapy for carcinoma of the esophagus[J]. J Clin Oncol, 2005, 23(10):2325-2331. |
| [10] | Berger AC, Farma J, Scott WJ, et al. Complete response to neoadjuvant chemoradiotherapy in esophageal carcinoma is associated with significantly improved survival[J]. J Clin Oncol, 2005, 23(19):4330-4337. |
| [11] | Therasse P, Arbuck SG, Eisenhauer EA, et al. New guidelines to evaluate the response to treatment in solid tumors[J]. J Natl Cancer Inst, 2000, 92(3):205-216. |
| [12] | 万钧, 肖爱勤, 高淑珍, 等. 食管癌放疗后近期疗效评价标准——附1000例分析[J]. 中华放射肿瘤学杂志, 1989, 3(4):205-207. |
| [13] | Meyers BF, Downey RJ, Decker PA, et al. The utility of positron emission tomography in staging of potentially operable carcinoma of the thoracic esophagus:results of the American College of Surgeons Oncology Group Z0060 trial[J]. J Thorac Cardiovasc Surg,2007,133(3):738-745.e1. |
| [14] | Lordick F, Ott K, Krause BJ, et al. PET to assess early metabolic response and to guide treatment of adenocarcinoma of the oesophagogastric junction:the MUNICON phase II trial[J]. Lancet Oncol, 2007,8(9):797-805. |
| [15] | Weber WA, Ott K, Becker K, et al. Prediction of response to preoperative chemotherapy in adenocarcinomas of the esophagogastric junction by metabolic imaging[J]. J Clin Oncol, 2001, 19(12):3058-3065. |
| [16] | Burtin P, Bouché O, Giovannini M, et al. Endoscopic ultrasonography is an independent predictive factor of prognosis in locally advanced esophageal cancer. Results from the randomized FFCD 9102 study from the Fédération Francophone de Cancérologie Digestive[J]. Gastroenterol Clin Biol, 2008, 32(3):213-220. |
| [17] | 沈文斌, 高红梅, 祝淑钗,等.食管癌放疗后达完全缓解患者的失败模式分析[J]. 中华放射医学与防护杂志,2014,34(3):206-210. |
| [18] | Maerz LL, Deveney CW, Lopez RR, et al. Role of computed tomographic scans in the staging of esophageal and proximal gastric malignancies[J]. Am J Surg, 1993, 165(5):558-560. |
| [19] | Lowe VJ, Booya F, Fletcher JG, et al. Comparison of positron emission tomography, computed tomography, and endoscopic ultrasound in the initial staging of patients with esophageal cancer[J]. Mol Imaging Biol, 2005, 7(6):422-430. |
 2015, Vol. 35
2015, Vol. 35