2. 石家庄市第一医院放射科
食管鳞癌(esophageal squamous cell carcinoma,ESCC)患者的放化疗疗效近年来取得了一定的疗效,但结果仍不能令人满意,尤其是放疗靶区的勾画存在较大争议。对于ESCC患者,是否需要行选择性淋巴结照射(elective nodal irradiation,ENI),以及从中如何获益,目前尚无定论。对临床早期ESCC患者接受ENI后的疗效分析结果认为,早期ESCC患者行ENI有益[1, 2]。为进一步明确早期ESCC患者接受ENI的益处,并排除淋巴结转移对疗效的干扰,本研究对临床未见转移且病变长度均≤5 cm的ESCC患者进行了分析,以便为最佳放疗方式的选择提供依据。
1.病例资料:回顾性分析2003年1月至2009年12月间在本院放疗科接受根治性放射治疗的食管癌患者。入组条件:食管病变病理类型为鳞状细胞癌;食管病变为单发且为原发灶,CT显示病变食管壁厚>5 mm;接受放疗前均接受胸部强化CT扫描检查、电子胃镜及食管钡餐造影等相关检查;经CT、MRI或PET/CT等检查,均未发现锁骨上、纵隔、腹腔淋巴结转移及远处脏器转移;患者食管病变钡餐造影长度均≤5.0 cm,且均为接受三维适形放疗(3D-CRT)或根治性调强放疗(IMRT)的初治患者;所有患者均无影响治疗的严重疾病及第二原发癌。符合入组条件的共158例,其中接受累及野照射(involved field irradiation,IFI)110例,ENI患者48例。所有患者均签署知情同意书,经医院伦理委员会认证。两组患者一般临床资料比较显示,两组资料均衡,见表 1。
| 表 1 两组患者的一般临床资料比较 |
2.适形放疗计划中的IFI靶区勾画:患者于CT模拟机(德国西门子公司)下扫描定位,所得图像传输进入治疗计划系统(ADAC Pinnacle3 8.0,荷兰飞利浦公司),依据胸部定位CT、食管钡餐造影片及电子胃镜检查等,勾画食管肿瘤为肿瘤靶区(GTV),GTV前后左右方向各外放0.5~0.8 cm,上下方向各外放2.0~3.0 cm,为临床靶区(CTV);CTV再均匀外放0.5~1.0 cm,为计划靶区(PTV),要求95%的PTV接受剂量为54~68 Gy/27~34次,共5~7周,中位剂量62 Gy。
ENI靶区勾画:患者 GTV、CTV和PTV的勾画方式同IFI患者,依据美国胸科协会对胸部淋巴结的分组[3] ,进行淋巴结引流区的勾画。勾画的淋巴结引流区定义为CTV-N,在CTV-N的基础上前后左右方向各外放0.3~0.5 cm,上下方向各外放1.0~1.5 cm为PTV-N,要求95%的PTV-N接受剂量为45~50.4 Gy/25~28次,共5周,中位剂量50.4 Gy。前程放疗结束后缩野至PTV,处方剂量10~20 Gy/5~10次,持续1~2周,总处方剂量56~70 Gy,中位剂量62 Gy。
IFI及ENI患者在勾画靶区的同时勾画相邻重要组织和器官,要求双肺V20<25%,平均剂量<14 Gy,心脏平均剂量<24 Gy,脊髓最大剂量<45 Gy。采用西门子直线加速器6 MV X射线实施治疗。
3.化疗:全组158例患者中,接受化疗57例,其中同步放化疗31例,序贯放化疗26例。化疗疗程为2~6个周期。化疗方案以顺铂为基础,主要有LFP(第1~5天,亚叶酸钙200 mg/次,替加氟1 g/次,顺铂20 mg/次)和TP(紫杉醇240 mg/次,第1天,顺铂20 mg/次,第1~5天)。
4. 食管病变周边组织器官受侵评价及测定:患者胸部CT显示食管病变与周边正常组织的关系判断标准如气管支气管受累标准、主动脉及心包受侵标准等均依据既往判断标准进行[4, 5]。
5.放疗患者近期疗效及不良反应评价:全部患者均顺利完成治疗计划,治疗结束后间隔1、3、6个月随访1次,长期生存患者1年至少随访2次。行胸部CT/磁共振成像(MRI)、食管钡餐造影、腹部B超等检查。近期疗效评价采用1989年万钧等[6]的食管癌放射治疗后近期疗效评价标准。治疗前吞咽困难依据RTOG评价标准进行分级,治疗前患者一般情况依据ECOG分级标准进行分级。患者急性及后期不良反应应用RTOG评价标准进行进行评价。
6.统计学处理:采用SPSS 11.5软件进行分析,组间比较采用χ2检验,单因素分析应用Kaplan-Meier法,并用双尾的Log-rank法进行显著性检验;多因素分析采用Cox比例风险模型,并用Forward:Wald筛选法评估独立的预后因素。P<0.05为差异有统计学意义。
[TP07沈文斌T1.TIF,BP,DY#]
[TS(][JZ(][HT6SS]注:ENI.选择性淋巴结照射;IFI.累及野照射
[HT6H][STHZ]图 1 [STBZ][HTSS]
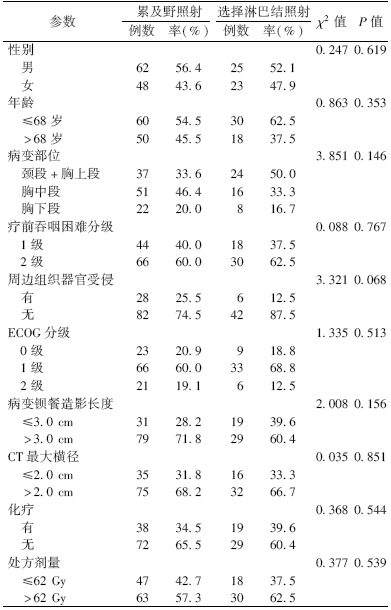
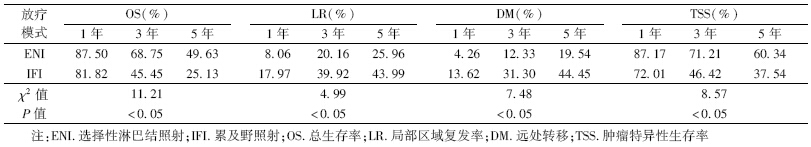
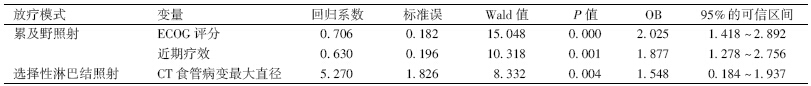
ENI与IFI患者总生存率(A)、局部区域复发率(B)、
远处转移率(C)及肿瘤特异性生存率(D)的生存曲线[JZ)][HT3.]
[TS)]
1.随访结果:患者随访截至2013年12月31日,随访时间为3~123个月,中位39个月,随访率100%。患者生存满1、3、5年分别为136、83及38例。
2.近期疗效:158例均按照计划完成治疗,全组患者治疗后疗效评价为完全缓解(CR)81例(51.3%),部分缓解(PR)73例(46.2%),无缓解(NR)4例(2.5%),有效率为97.5%。其中,ENI和IFI组患者CR、PR及NR病例数分别为27(56.3%)、21(43.7%)、0(0%)例和54(49.1%)、52(47.3%)、4(3.6%)例,两组患者近期疗效差异无统计学意义(χ2=2.17,P>0.05)。
3.两组患者生存情况分析:ENI与IFI组患者相比,前组患者总生存率(over survival rate,OS)及肿瘤特异性生存率(tumor specificity survival rate,TSS)均显著高于后组(χ2=11.21、8.57,P<0.05),但LR及远处转移(DM)均显著低于后组(χ2=4.99、7.48,P<0.05),见图 1,表 2。
 | 注:ENI.选择性淋巴结照射;IFI.累及野照射图 1 NI与IFI患者总生存率(A)、局部区域复发率(B)、 远处转移率(C)及肿瘤特异性生存率(D)的生存曲线 |
| 表 2 ENI与IFI患者的生存情况分析结果 |
4.预后影响因素分析:将可能影响患者预后的因素,包括年龄、治疗前吞咽困难分级、ECOG分级、周边组织器官受侵情况、食管病变钡餐造影长度、CT显示食管病变最大直径及近期疗效等纳入COX多因素分析模型,分别对ENI和IFI组患者进行多因素分析。结果列于表 3。由表 3可知,患者ECOG分级及近期疗效为IFI组患者的独立性预后影响因素(χ2=15.05、10.32,P<0.05),CT显示食管病变最大直径为ENI组患者的独立性预后影响因素(χ2=8.32,P<0.05)。
| 表 3 两组患者多因素分析结果 |
5.不良反应:全组患者出现≥2级急性放射性食管炎(radiation esophagitis,RE)51例(32.3%),其中,2级41例(25.9%),3级10例(6.3%);出现≥2级急性放射性肺炎(radiation pulmonitis,RP)15例(9.5%),其中,2级13例(8.2%),3级2例(1.3%)。后期不良反应中,出现≥2级食管损伤17例(10.8%),其中,2级12例(7.6%),3级1例(0.6%),4级4例(2.5%);≥2级肺损伤23例(14.6%),其中2级15例(9.5%),3级5例(3.2%),4级3例(1.9%);有7例(4.4%)患者出现与心脏相关的死亡,其中2例为猝死。在48例接受ENI的患者中出现≥2级RE 12例(25.0%),≥2级RP 6例(12.5%);与110例行IFI患者的39例(38.6%)和9例(8.9%)相比,差异均无统计学意义(χ2=2.68、1.46,P>0.05)。
本研究对接受不同放疗方式的158例临床早期ESCC患者的治疗疗效进行了长期随访及回顾性分析,结果显示,接受ENI患者的总生存率及肿瘤特异性生存率优于IFI患者,而区域复发率及远处转移生存率低于后者,认为对于临床早期ESCC患者选择应用ENI,可能为患者的生存带来益处。究其原因可能是由于临床早期ESCC患者有长期生存可能,出现局部复发和或转移的概率较大,而ENI的应用可能在一定程度上消灭了临床微转移灶,从而减少了复发概率,给患者的生存带来益处。但由于本研究为回顾性分析,且病例数较少,此结论还有赖于大宗病例的前瞻性研究进一步证实。
放射治疗联合或不联合化疗为非手术治疗食管癌患者的主要治疗模式,虽然随着放疗技术的快速发展及化疗药物的不断更新,此部分患者的生存率有了较大提高,然而,区域性复发及远处转移仍为其主要失败原因。如何提高患者的局部控制率,尤其是降低区域淋巴结转移率,一直是临床放疗科医师研究的重点,其中,关于临床靶区的勾画范围、是否应该行ENI等,成为食管癌放疗的研究热点,但到目前为止仍无较为满意的结论。有研究认为,ENI对食管癌患者有益。Onozawa等[7]对不同期别的共102例食管癌患者进行了ENI的研究,结果表明,60例患者达到了完全缓解,10例患者局部复发,9例患者出现远处转移,接受了ENI的患者中仅有1例患者出现复发。Hideomi等[8]对126例食管癌患者进行了研究,结果同样表明,ENI可以有效地预防区域淋巴结复发的发生。但有的研究认为,IFI在减少急性不良反应的同时,并不增加患者的淋巴结失败率。例如,Ma等[9]对102例颈段及胸上段食管癌患者进行研究,认为食管癌患者接受IFI后淋巴结转移率并未增加。同时,Zhao等[10]应用后程加速分割放疗对53例食管癌患者进行了研究,同样认为ENI并未对患者区域内淋巴结转移复发率有显著影响。本研究中,对158例无转移且病变长度≤5 cm的ESCC患者的放化疗结果进行了回顾性分析,并对其中48例接受了ENI的患者进行了分析,研究结果显示,即使未接受手术治疗,该部分患者也有较好的治疗效果,同时显示接受ENI的患者生存情况好于IFI患者,且ENI为本组患者独立性预后影响因素。因此,认为对于钡餐造影长度≤5 cm且无转移的ESCC患者,ENI的实施能在提高患者局部控制率的同时,使患者的生存获益。
食管癌放化疗的影响因素较多,且结论不尽统一。本研究中,多因素研究结果显示,患者近期疗效及ECOG分级为其独立性预后影响因素。食管癌治疗后有无肿瘤残留为预后评价的重要指征[11, 12, 13]。有研究认为,治疗后达到CR的患者与PR及NR患者相比,有25%~30%CR患者的5年生存率得到了提高[14, 15, 16, 17]。Meguid等[12]对267例接受了术前新辅助治疗的患者进行分析,结果表明,CR组患者的局部复发和远处转移的发生时间也显著晚于PR及NR组患者。Denham等[13]对274例食管癌患者进行研究分析,认为治疗后无癌残留患者的复发率和远处转移率显著低于有癌残留患者。Fakhrian等[18]对163例临床分期为T1-4N0-1M0接受放(化)疗食管鳞状细胞癌患者进行了分析,结果显示,患者ECOG分级为其独立性预后影响因素。以上报道均与本研究结果相似。认为患者入院前一般状态良好,治疗后近期疗效较好等,均可能会给患者生存带来益处。
放射性肺损伤及食管损伤为食管癌放疗难以避免的不良反应,理论上ENI患者较IFI患者照射野范围增大,因此,增加了双侧肺的照射面积,从而造成了肺的放射性损伤。本研究结果显示,IFI组患者的RP发生率低于ENI组患者,但差异无统计学意义。这可能与本组食管癌患者采用3D-CRT和IMRT放疗技术,能有效地控制患者双肺的受照剂量有关[19]。
综上所述,对于钡餐造影病变长度≤5.0 cm且无转移的ESCC患者,放(化)疗有较好疗效,且ENI较IFI更可能给此部分患者的局部控制率及长期生存带来益处,且未增加此部分患者的不良反应。为此,建议对于食管钡餐造影长度较短、且临床无转移的ESCC患者,可行ENI,当然,这有赖于大宗病例的进一步研究证实。
| [1] | 沈文斌, 高红梅, 祝淑钗,等. 临床早期食管癌选择性淋巴结照射与累及野照射的初步比较[J]. 中国肿瘤临床, 2013, 40(7):1047-1050. |
| [2] | 祝淑钗, 许金蕊, 刘志坤, 等. 三维技术放疗食管癌不同临床靶区的初步研究[J]. 中华放射肿瘤学杂志, 2014,23(2):127-130. |
| [3] | Korst RJ, Rasch VW, Venkatraman E, et al. Proposed revision of the staging clasification for esophageal cancer[J]. J Thorac Cardiovasc Surg, 1998, 115(3):660-669. |
| [4] | Picus D, Balfe DM, Koehcer RE, et al. Computed tomography in the staging of esophageal carcinoma[J]. Radiology, 1983,146(2):433-438. |
| [5] | Sharma OP, Chandermban SM, Mashankar AS, et al. Role of computed tomography in preoperative evaluation of esophageal carcinoma[J]. Indian J Cancer,1994,31(1):12-18. |
| [6] | 万钧, 肖爱勤, 高淑珍, 等. 食管癌放疗后近期疗效评价标准——附1000例分析[J]. 中国放射肿瘤学,1989,3(4):205-207. |
| [7] | Onozawa M, Nihei K, Ishikura S, et al. Elective nodal irradiation (ENI) in definitive chemoradiotherapy (CRT) for squamous cell carcinoma of the thoracic esophagus[J]. Radiother Oncol, 2009,92(4):266-269. |
| [8] | Hideomi Y, Kae O, Reiko W, et al. Details of recurrence sites after elective nodal irradiation (ENI) using 3D-conformal radiotherapy (3D-CRT) combined with chemotherapy for thoracic esophageal squamous cell carcinoma—A retrospective analysis[J]. Radiother Oncol, 2011, 98(2):255-260. |
| [9] | Ma JB, Song YP, Yu JM, et al. Feasibility of involved-field conformal radiotherapy for cervical and upper-thoracic esophageal cancer[J]. Onkologie, 2011,34(11):599-604. |
| [10] | Zhao KL, Ma JB, Liu G, et al. Three-dimensional conformal radiation therapy for esophageal squamous cell carcinoma:is elective nodal irradiation necessary?[J]. Int J Radiat Oncol Biol Phys, 2010,76(2):446-451. |
| [11] | Chen G, Wang Z, Liu XY, et al. Recurrence pattern of squamous cell carcinoma in the middle thoracic esophagus after modified Ivor-Lewis esophagectomy[J]. World J Surg, 2007,31(5):1107-1114. |
| [12] | Meguid RA, Hooker CM, Taylor JT, et al. Recurrence after neoadjuvant chemoradiation and surgery for esophageal cancer:does the pattern of recurrence differ for patients with complete response and those with partial or no response?[J]. J Thorac Cardiovasc Surg, 2009,138(6):1309-1317. |
| [13] | Denham JW, Steigler A, Kilmurray J, et al. Relapse patterns after chemo-radiation for carcinoma of the oesophagus[J]. Clin Oncol (R Coll Radiol), 2003,15(3):98-108. |
| [14] | Reynolds JV, Muldoon C, Hollywood D, et al. Long-term outcomes following neoadjuvant chemoradiotherapy for esophageal cancer[J]. Ann Surg, 2007, 245(5):707-716. |
| [15] | Ancona E, Ruol A, Santi S, et al. Only pathologic complete response to neoadjuvant chemotherapy improves significantly the long term survival of patients with resectable esophageal squamous cell carcinoma:final report of a randomized, controlled trial of preoperative chemotherapy versus surgery alone[J]. Cancer, 2001,91(11):2165-2174. |
| [16] | Chirieac LR, Swisher SG, Ajani JA, et al. Posttherapy pathologic stage predicts survival in patients with esophageal carcinoma receiving preoperative chemoradiation[J]. Cancer, 2005,103(7):1347-1355. |
| [17] | Rohatgi P, Swisher SG, Correa AM, et al. Characterization of pathologic complete response after preoperative chemoradiotherapy in carcinoma of the esophagus and outcome after pathologic complete response[J]. Cancer, 2005, 104(11):2365-2372. |
| [18] | Fakhrian K, Heilmann J, Schuster T, et al. Primary radiotherapy with or without chemotherapy in non-metastatic esophageal squamous cell carcinoma:a retrospective study[J]. Dis Esophagus, 2012, 25(3):256-262. |
| [19] | Liu MN, Shi XH, Guo XM, et al. Long-term outcome of irradiation with or without chemotherapy for esophageal squamous cell carcinoma:a final report on a prospective trial[J]. Radiat Oncol, 2012, 7(2):142-149. |
 2015, Vol. 35
2015, Vol. 35