2. 山西省长治市妇幼保健院
吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)是一种小分子的巯基化合物,它具有多种生化活性,如改变氧化还原状态、重金属的螯合剂抑制酶的作用。PDTC最初被作为一种抗氧化剂应用,它既能抵抗自由基的毒性作用,也能干扰促炎细胞因子的生成,现已被用作核因子κB(NF-κB)的强效抑制剂[1, 2, 3, 4, 5]。一些体内外实验研究显示,PDTC可以促进多种体外培养的肿瘤细胞凋亡,抑制其增殖,并可增加肿瘤细胞对化疗及放疗的敏感性[6, 7, 8, 9]。本研究探讨了PDTC对小鼠辐射损伤的保护作用。
1. 药品与试剂:PDTC,购于美国Sigma公司;注射用氨磷汀(amifostine,WR-2721),购自大连美罗大药厂;碳酸氢钠、无水氯化钙、冰醋酸、高氯酸,购自天津江天化工技术公司;乙二胺四乙酸二钾(EDTA-2Ka),购自天津光复精细化工研究所;氯化钠注射液购于中国大冢制药有限公司。
2. 动物与仪器:ICR雄性小鼠,SPF级, 6~8周龄,体重20~22 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2012-0001。137Cs γ射线辐射源(Gammacell 40,加拿大原子能有限公司),剂量率为0.99 Gy/min,源皮距15 cm。BC-2800全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司)。
3.30 d存活率实验:小鼠50只,按体重随机分为5组,每组10只。空白单照组:于照射前30 min腹腔注射生理盐水0.2 ml/只;阳性对照组:于照射前30 min腹腔注射WR-2721 250 mg/kg;PDTC 30、60、90 mg/kg剂量组:于照射前30 min各给予相应剂量。137Cs γ射线7.5 Gy一次性全身照射,每天观察记录小鼠的存活情况并算出保护指数。保护指数=[(ab+30c)/n]/[(a'b'+30c')/n']。式中,a、a'分别为给药组(阳性对照组和PDTC组)与空白单照组死亡鼠平均存活天数;b、b'分别为给药组(阳性对照组和PDTC组)与空白单照组死亡小鼠数;c、c'分别为给药组(阳性对照组和PDTC组)与空白单照组的30 d存活只数;n、n'分别为给药组(阳性对照组和PDTC组)与空白单照组总小鼠数。
4. 体内抗辐射活性实验:6~8周龄雄性ICR小鼠,50只,按体重随机分为5组,每组10只。各组处理同存活率实验。137Cs γ射线5 Gy一次性全身照射。
5. 外周血及脏器系数的测定:照射后第8天,小鼠眼球取血20 μl,加入到含20 mg/ml EDTA-2Ka的生理盐水溶液100 μl,用BC-2800全自动血液细胞分析仪检测白细胞、红细胞、血小板数目及血红蛋白含量。小鼠称重后,颈部脱臼处死。解剖小鼠取心、胸腺、脾、肝,用精密电子天平称量质量,按下列公式计算心、胸腺、脾、肝系数:脏器系数=脏器重量/体重。
6.股骨有核细胞数(bone marrow nucleated cells,BMNC)和DNA含量测定:照射后第8天将小鼠脱臼处死,取一侧股骨,用白细胞稀释液冲洗骨髓,在电子显微镜下计算股骨有核细胞数。取另一侧股骨,用10 ml 的0.05 mol/L氯化钙溶液冲洗骨髓,4℃放置30 min,离心半径13.5 cm,2 500 r/min,离心15 min。弃上清后,加入5 ml的0.2 mol/L高氯酸反应液,充分混匀,90℃加热15 min,冷却,过滤,滤液用紫外分光光度计测定268 nm处吸光度(A)值。
7.脾结节(colony forming unit of spleen,CFU-S):将取出的脾脏放入Bouin液内固定,约24 h后取出,肉眼计数脾脏表面突出的结节数(CFU-S)。
8.统计学处理:各组数据以x±s表示。采用SPSS 12.0统计学软件,组间比较采用配对t检验。P<0.05为差异有统计学意义。
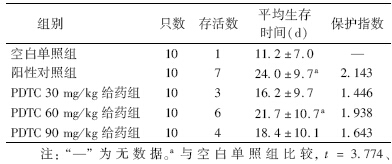
1. 各组小鼠照射后30 d存活率结果:由表 1可见,30、60、90 mg/kg PDTC给药组小鼠的30 d存活率与空白单照组比较,明显提高了受致死剂量照射小鼠的存活率,尤其是60 mg/kg给药组,虽然相比阳性对照组稍低,但可以表明PDTC具有一定抗辐射损伤的作用。60 mg/kg PDTC给药组的小鼠平均存活天数与空白单照组相比,差异有统计学意义(t=2.760,P<0.05),阳性对照组为24.0 d。
| 表 1 各处理组小鼠照射后30 d的存活率和保护指数(x±s) |
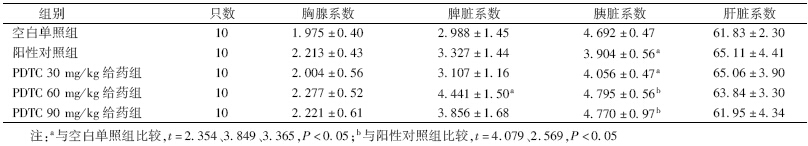
2. 各组小鼠脏器系数比较:由表 2可见,与空白单照组相比,PDTC给药组的胸腺系数、脾脏系数、胰脏系数、肝脏系数均有所提高,并且与空白单照组相比,PDTC 60 mg/kg给药组的脾脏系数差异有统计学意义(t=2.354,P<0.05),PDTC 30 mg/kg给药组胰脏系数差异有统计学意义(t=3.365,P<0.05)。
| 表 2 各组小鼠脏器系数比较(x±s) |
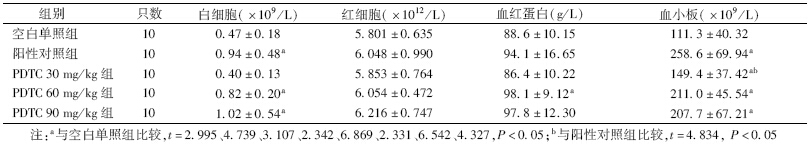
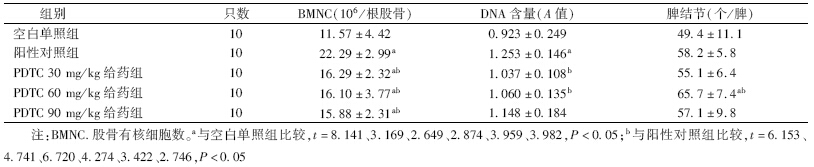
3. 各组小鼠造血系统指标比较:由表 3可见,PDTC给药组与空白单照组相比,白细胞、红细胞、血红蛋白、血小板都有所升高,并且PDTC 60 mg/kg给药组在这三方面的数值与空白单照组相比,差异有统计学意义(t=4.739、2.342、6.542,P<0.05);PDTC 30 mg/kg给药组PLT值差异有统计学意义(t=2.331,P<0.05);PDTC 90 mg/kg给药组白细胞、血小板值与空白单照组相比,差异有统计学意义(t=3.107、4.327,P<0.05)。由表 4可知,给药组小鼠每根股骨的有核细胞数和DNA含量相比空白单照组数值均有所增加,并且3个剂量的股骨有核数相比空白单照组差异均有统计学意义(t=3.169、2.649、2.874,P<0.05)。在对脾结节影响方面,3个给药组的小鼠的脾结节数都大于空白单照组,并且60 mg/kg剂量组差异有统计学意义(t=3.982,P<0.05)。
| 表 3 不同剂量PDTC对γ射线损伤小鼠外周血的影响(x±s) |
| 表 4 不同剂量PDTC对γ射线损伤小鼠造血系统的影响(x±s) |
机体受电离辐射后会引起一系列物理及化学变化,进而产生一系列生物学效应,从而表现出辐射损伤作用。电离辐射损伤效应主要表现在机体重要器官受损、体重下降、免疫和造血功能的降低,电离辐射达到一定的高剂量还会导致动物死亡。
NF-κb作为一种重要的多功能核转录因子,在人体免疫、炎症、肿瘤的发生发展和侵袭转移等方面起到相当重要的作用。以往的研究表明,电离辐射可以诱导多个通路从而激活NF-κB的表达。而氧化损伤机制是辐射损伤机制中最为重要的,辐射引起机体中自由基的增加也是激活NF-κB表达的重要通路之一。PDTC属于一种强抗氧化剂,能特异性抑制NF-κB的活性,作用机制表现在能特异性抑制NF-κB活性亚单位P65表达或抑制IκB降解,减少NF-κB的核移位[10]。另外PDTC可直接清除活性氧介质,或者与其相关酶中的金属离子发生螯合作用抑制其活性,从而减少活性氧介质的产生,抑或增加谷胱甘肽前提及还原性谷胱甘肽的含量,从而达到预防电离辐射损伤的作用。
本实验以照后30 d小鼠存活率来直观地反映了PDTC对于小鼠辐射损伤的防护作用。胸腺和脾脏是机体重要的免疫器官,本实验选取二者来体现PDTC对于辐射照射损伤小鼠免疫功能的防护作用。造血系统对辐射也很敏感[11],骨髓是机体造血的主要组织,其受到照射后,会产生多方面的病理变化,如造血干细胞减少;而表现在外周血中即白细胞、红细胞、血小板数目降低,血红蛋白含量减少。脾结节数和股骨有核细胞数的增加也代表了机体造血组织的恢复。实验结果显示,与空白对照组相比,PDTC能提高辐射损伤小鼠的30 d存活率,并在很大程度上具有增强免疫和改善造血系统的作用,尤其60 mg/kg作用最为明显。但并不呈剂量依赖性,相对的大剂量可能对机体具有一定的毒副作用,可能与其含有硫元素相关,有待进一步的深入研究。本研究中PDTC的作用虽然比起氨磷汀的辐射防护的效果有一定的欠缺,但氨磷汀效价低、有效时间短,不良反应大并且口服无效等因素使实际应用受到限制,PDTC在辐射防护方面的作用提供了新的思路,可以从不同的角度来作为今后研发新的防护药的方向。
| [1] | Kim KS, Oh DH, Choi HM, et al. Pyrrolidine dithiocarbamate, a NF-кB inhibitor, upregulates MMP-1 and MMP-13 in IL-1β-stimulated rheumatoid arthritis fibroblast-like synoviocytes[J]. Eur J Pharmacol, 2009, 613(1):167-175. |
| [2] | Cardoso SM, Oliveira CR. Inhibition of NF-κB renders cells more vulnerable to apoptosis induced by amyloid β peptides[J]. Free Radic Res, 2003, 37(9):967-973. |
| [3] | Zhao Z, Huang G, Wang B, et al. Inhibition of NF-kappaB activation by Pyrrolidine dithiocarbamate partially attenuates hippocampal MMP-9 activation and improves cognitive deficits in streptozotocin-induced diabetic rats[J]. Behav Brain Res, 2013, 238:44-47. |
| [4] | Zhang J, Xu Z, Zhang C, et al. Pyrrolidine dithiocarbamate inhibits nuclear factor-κB pathway activation, and regulates adhesion, migration, invasion and apoptosis of endometriotic stromal cells [J]. Mol Hum Reprod, 2010, 17(3):175-181. |
| [5] | Zhang J, Jiang W, Zuo Z. Pyrrolidine dithiocarbamate attenuates surgery-induced neuroinflammation and cognitive dysfunction possibly via inhibition of nuclear factor κB[J]. Neuroscience, 2014, 261:1-10. |
| [6] | Chen YW, Chen KL, Chen CH, et al. Pyrrolidine dithiocarbamate (PDTC)/Cu complex induces lung epithelial cell apoptosis through mitochondria and ER-stress pathways[J]. Toxicol Lett, 2010, 199(3):333-340. |
| [7] | 闫亚妮, 吴静, 张颖, 等. 抗氧化剂吡咯烷二硫代氨基甲酸有助于提高卡铂对宫颈癌SiHa细胞化疗的敏感性[J]. 西安交通大学学报(医学版), 2011, 32(5):610-614. |
| [8] | Lee MF, Li CT, Chen MD, et al. Pyrrolidine dithiocarbamate (PDTC) attenuates luteolin-induced apoptosis in human leukemia HL-60 cells[J]. JCT, 2012, 3(6):1125. |
| [9] | Chen YW, Chen KL, Chen CH, et al. Pyrrolidine dithiocarbamate (PDTC)/Cu complex induces lung epithelial cell apoptosis through mitochondria and ER-stress pathways[J]. Toxicol Lett, 2010, 199(3):333-340. |
| [10] | Nuutinen U, Simelius N, Ropponen A, et al. PDTC enables type I TRAIL signaling in type II follicular lymphoma cells[J]. Leuk Res, 2009,33(6):829-836. |
| [11] | 周美娟, 郑莉, 丁振华. 辐射对造血系统的影响[J]. 国外医学·放射医学核医学分册, 2004, 28(3):139-142. |
 2015, Vol. 35
2015, Vol. 35