目前约70%的肿瘤需行放疗,但大多数肿瘤都存在一定的放射抗拒性。即使在精确放疗的今天,临床上放疗野内复发的情况仍然存在。因此,细胞的放射敏感性及其影响因素的相关研究已上升为近年来的研究热点。有研究表明,基因治疗能够提高肿瘤对放、化疗的敏感性,同时,减少肿瘤的复发和转移[1]。
脂肪量与肥胖相关基因(fat mass and obesity associated gene,FTO)是近年来研究的热门基因之一。全基因组关联分析显示FTO基因的单核苷酸多态性可能与某些肿瘤(胰腺癌[2]、子宫内膜癌[3]、乳腺癌[4]、前列腺癌[5]等)的发生风险有关,但其在人体中的作用机制尚未完全阐明[6]。有研究发现,FTO基因敲除可能影响肿瘤细胞的能量平衡及增殖活性[7, 8]。本研究从放射增敏的角度,探讨FTO基因与脑胶质瘤细胞放射敏感性的关系。
1.细胞系:人脑胶质瘤A172细胞购自美国ATCC细胞库。按FTO表达情况将A172细胞分别应用干扰RNA瞬时转染技术和重组质粒转染联合G418筛选的方法构建A172/NC、A172/siRNA、A172/PC和A172/FTO组,分别为低表达对照组、低表达组、高表达对照组和高表达组,并得到验证。4组细胞均由苏州大学长江学者实验室构建并提供。A172细胞为正常表达组。
2. 主要试剂:DMEM培养基、胎牛血清、胰酶均购自美国GIBCO公司。姬姆萨染液购自美国Biosharp公司,抗FTO抗体、抗γ-H2AX抗体、抗Ku80抗体、抗p-p95/NBS1抗体、抗Rad50抗体等均购自美国Abcam公司和美国Santa Cruz公司。化学发光试剂盒购自美国Millipore公司。
3. 照射条件:高能6 MV PRIMUS医用直线加速器(德国西门子公司)X射线照射,吸收剂量率200 cGy/min,固定源靶距100 cm,照射野为10 cm×10 cm,1.5 cm补偿膜以取消建成效应。
4.Western blot法:各组蛋白样品分别取50 μg,经电泳分离后转印至聚偏氟乙烯(PVDF)膜上。用5%脱脂牛奶封闭后,加入特异性一抗溶液置于室温作用1 h,0.1%磷酸盐吐温缓冲液(TBST)洗涤后,与二抗溶液室温作用45 min,洗涤后化学发光显色试剂盒(EZ-ECL)进行曝光。
5. 克隆集落形成法:5组细胞按照不同剂量(0、0.5、1、2、4、8 Gy)分别照射,每组细胞每个剂量点设3个平行样。常规培养15 d。终止培养后用无水甲醇固定30 min,姬姆萨染色1 h,于显微镜下计数不小于50个细胞的集落。计算出克隆形成率(PE)和存活分数(SF)并拟合细胞存活曲线:SF=1-(1-e-D/D\-0)N。式中,D0为平均致死剂量,Dq为准阈剂量,N为外推值。
6. 免疫荧光法计数γ-H2AX foci数:各组细胞分别用4%多聚甲醛固定10 min,0.5%Triton穿孔15 min,1%BSA封闭30 min。加入一抗于37℃孵育2 h,二抗于37℃孵育1 h,5 μg/ml DAPI染色2 min,抗淬灭封片剂封片。置于共聚焦显微镜下计数γ-H2AX foci数目。
7. 统计学处理:所有实验均重复3次,数据结果以x±s表示。采用SPSS 19.0统计软件分析,在检验数据正态分布及方差齐性的条件下,多组间数据比较采用方差分析;各组组间差异比较采用LSD检验。P<0.05为差异具有统计学意义。
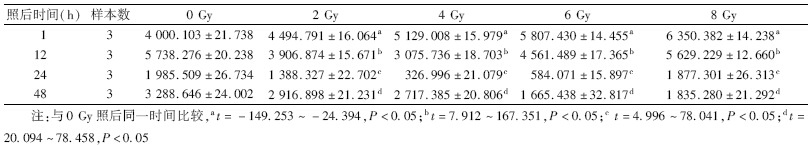
1.X射线对A172细胞内FTO蛋白表达水平的影响:如图 1、表 1所示,当剂量为2、4、6、8 Gy时,照后1 h FTO蛋白表达水平均较未照射A172细胞增加(t=-149.253~-24.394,P<0.05),且剂量越大,FTO表达增加越明显(r=0.996)。当时间大于或等于12 h时,X射线照射后FTO蛋白表达均比未照射A172细胞减少(t=4.996~167.351,P<0.05),且经过一定时间后,FTO蛋白表达降至最低后可逐渐恢复。
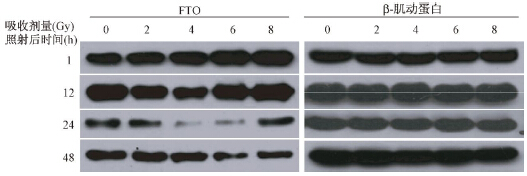 | 图 1 A172细胞受不同剂量X射线照射后不同时间,FTO蛋白的表达水平 |
| 表 1 不同剂量X射线照射后不同时间对A172细胞内FTO蛋白表达水平的影响(x±s) |
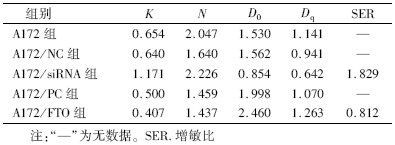
2. FTO对A172细胞放射敏感性的影响:将细胞克隆形成实验所得数据采用多靶单击模型拟合细胞存活曲线并计算与放射敏感性相关的参数,结果如图 2和表 1所示。当干扰FTO表达时,A172与A172/NC组细胞存活曲线之间差异无统计学意义,而A172/siRNA组的存活曲线较前两组均明显下移,且随着照射剂量增加,存活曲线下移越明显。此外,A172/siRNA组细胞存活曲线肩区较前两组窄,这说明干扰FTO表达能抑制A172细胞发生亚致死性损伤修复。当FTO过表达时,A172/FTO组在低剂量照射后的细胞存活率较A172和A172/PC组均变化不大;而在照射剂量大于4 Gy的情况下,A172/FTO组的细胞存活率大于后两者,但A172/PC组细胞存活率亦大于A172组。这说明FTO过表达对A172细胞的辐射保护作用不能排除质粒pcDNA3.1干扰的因素。由表 2可知,A172/siRNA组的放射增敏比为1.829,而A172/FTO组的放射增敏比为0.812。这进一步说明FTO基因可能是一种辐射耐受的靶点基因,抑制FTO表达可以明显增加A172细胞的放射敏感性。
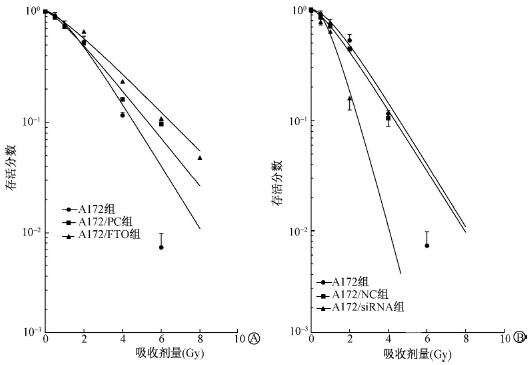 | 图 2 改变FTO表达对A172细胞放射敏感性的影响 A.FTO高表达;B.FTO低表达 |
| 表 2 改变FTO表达对A172细胞放射敏感性相关参数的影响 |
3.FTO对X射线照射后A172细胞DNA损伤修复的影响:采用免疫荧光法检测FTO不同表达水平的A172细胞接受4 Gy X射线照射后1 h的γ-H2AX蛋白foci形成并计数,结果列于图 3。与A172/NC组比较,A172/siRNA组内γ-H2AX蛋白foci形成数目明显增加(t=-21.884,P<0.05),但A172/FTO组较A172/PC组内γ-H2AX foci数目未见明显差异(t=0.856,P>0.05)。这说明抑制FTO表达可以诱发A172细胞发生电离辐射损伤。
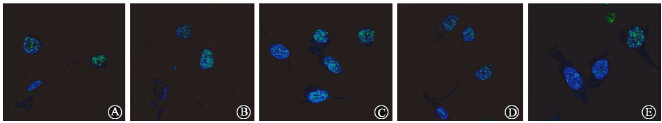 | 图 3 FTO对A172细胞电离辐射后γ-H2AX foci形成数目的影响 A. A172组;B. A172/NC组; C. A172/siRNA组;D. A172/PC组;E. A172/FTO组 |
为了进一步研究FTO影响A172细胞DNA损伤修复的机制,采用Western blot法对比FTO不同表达水平时A172细胞内DNA损伤修复相关蛋白的表达,结果列于图 4、5。由图 4可知,改变FTO蛋白的表达水平后,5组内调控DNA损伤修复相关的蛋白Ku80、p-p95/NBS1、Rad50蛋白表达均相应改变。由图 5可进一步了解,FTO低表达时,A172/siRNA组内Ku80和p-p95/NBS1蛋白表达下降,Rad50蛋白表达增加。而FTO高表达时,结果正好相反。由此可知,FTO可能通过调控DNA损伤修复蛋白的表达进而影响A172细胞的放射敏感性。
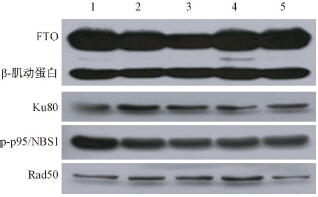 | 注:1~5分别表示A172、A172/NC、A172/siRNA、A172/PC、A172/FTO组图 4 改变FTO对A172受照射后DNA损伤修复相关蛋白表达的影响 |
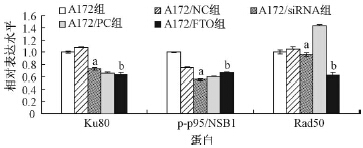 | 注:a与同一蛋白A172/NC组比较,t=3.140~24.731,P<0.05;b与同一蛋白A172/PC组比较,t=-8.364~26.829,P<0.05图 5 FTO表达对A172受照射后DNA损伤修复相关蛋白表达的影响 |
FTO蛋白属于AlkB家族高度同源蛋白,表达于细胞核,含有与Fe2+以及α-酮戊二酸(α-ketoglutaric acid,α-KG)依赖的加氧酶相同的基序[9, 10]。Zhao等[11]的研究提示约75%的继发性恶性脑胶质瘤和5%的原发性恶性脑胶质瘤存在可溶性异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)基因突变,该突变可导致催化异柠檬酸氧化脱羧生成α-KG的能力大大下降,而向肿瘤细胞转染α-KG 后,IDH1的突变效应可以得到逆转。这为FTO基因与脑胶质瘤之间的联系提供了一种可能。
本实验发现,采用不同剂量的X射线照射A172细胞,经过不同时间后FTO蛋白的表达水平不同。这为研究通过改变FTO基因表达来影响肿瘤细胞放射敏感性提供了可能。
当用不同剂量的X射线分别照射正常表达组A172细胞,1 h后FTO蛋白表达水平均较未照射A172细胞显著增加,且FTO蛋白表达水平与照射剂量呈正相关(r=0.996 3)。这提示X射线能够诱导FTO蛋白在短时间(1 h)内的表达,FTO蛋白可能参与辐射引起的细胞急性损伤,其作用及作用机制仍缺乏足够的实验数据支持。当照射剂量固定时,照后1 h FTO蛋白表达增加,照后12~24 h FTO蛋白表达逐渐下降,当照后48 h,FTO蛋白表达又逐渐恢复。这提示,FTO蛋白参与X射线引起的细胞辐射损伤及损伤修复的过程。
本研究进一步探索了FTO蛋白与辐射之间的关系。通过细胞克隆形成实验检测体外培养细胞受照射后的细胞克隆存活率,是分析细胞内在放射敏感性的一种有效手段[12]。应用多靶单击模型对FTO不同表达水平的A172细胞受X射线照射后的细胞存活曲线进行拟合,发现FTO低表达时A172细胞的存活曲线较正常表达时明显下移,而且肩区明显变窄,这说明干扰FTO表达能通过抑制A172细胞发生亚致死性损伤修复来达到放射增敏的效果。免疫荧光法发现A172/siRNA细胞内γ-H2AX foci形成数目明显增加,这进一步证实了干扰FTO表达能诱发受照后的A172细胞发生DNA损伤。另一方面,FTO过表达相关实验的结果与前面结果却并不一致。A172/FTO细胞受低剂量照射后的细胞存活率较A172细胞和A172/PC细胞均变化不大;而当照射剂量大于4 Gy时,A172/FTO细胞的存活率大于后两者,且A172/PC细胞存活率亦大于A172细胞。FTO过表达时A172细胞γ-H2AX计数与空质粒组比较数目减少,但差异不具有统计学意义。这提示FTO可能是一种辐射抗性基因,抑制FTO蛋白的表达,可使X射线更易诱导A172细胞的死亡。其过表达时未显现出增加A172细胞辐射抗性的作用可能与质粒pcDNA3.1本身影响A172细胞的放射敏感性有关。
众所周知,细胞的放射敏感性与受照后DNA的损伤修复能力密切相关[13]。当受到电离辐射时,细胞发生单链断裂(single-strand breaks,SSBs)和双链断裂(DNA double-strand breaks,DBSs),其中DSBs被认为是DNA受到电离辐射后最致命的损伤[14]。感受到损伤后,由Mre11、Rad50和p95/NBS1组成的三聚复合物MRN首先识别DNA损伤,招募活化的ATM到损伤位点,使ATM下游底物H2AX、BRCA1等发生磷酸化并聚集,进而参与DSB的识别和修复[15,16,17]。已知细胞修复DSBs主要通过非同源末端结合(non-homologous end joining,NHEJ)和同源重组(homologous recombination,HR)两种途径。在NHEJ途径中,Ku蛋白首先识别DNA双链断裂末端并在此聚集形成DNA-Ku70/Ku80复合物,进一步激活DNA依赖性蛋白激酶DNA-PKs与DNA结合,由DNA连接酶、DNA连接酶辅因子XRCCs等多个分子参与并共同完成DNA修复[18,19,20,21]。采用Western blot法对比FTO不同表达水平时A172细胞内DNA损伤修复相关蛋白的表达,结果提示,FTO低表达时,A172细胞内Ku80和p-p95/NBS1蛋白表达下降。而FTO高表达时,结果正好相反。由此可知,FTO可能通过调控DNA损伤修复蛋白的表达进而影响A172细胞的放射敏感性。
综上所述,FTO基因可能是一种与辐射耐受有关的靶点基因。通过一些药物作用于该基因,选择性的提高肿瘤细胞的放射敏感性,同时又不增加正常组织的放射损伤,有望成为一种理想的放射增敏方法。但是,以FTO基因作为分子靶点的放射增敏剂,在取得基础实验和循证医学的进一步证实和验证方面仍有大量的工作需要完成。
| [1] | Gridley DS, Slater JM. Gene therapy:A possible aid to cancer radiotherapy[J]. Discov Med, 2004,4(24):408-414. |
| [2] | Li G, Chen Q, Wang L, et al. Association between FTO gene polymorphism and cancer risk:evidence from 16277 cases and 31153 controls[J]. Tumour Biol, 2012,33(4):1237-1243. |
| [3] | Lurie G, Gaudet MM, Spurdle AB, et al. The obesity-associated polymorphisms FTO rs9939609 and MC4R rs17782313 and endometrial cancer risk in non-hispanic white women[J]. PLoS One, 2011,6(2):e16756. |
| [4] | da Cunha PA, de Carlos Back LK, Sereia AF, et al. Interaction between obesity-related genes, FTO and MC4R, associated to an increase of breast cancer risk[J]. Mol Biol Rep, 2013,40(12):6657-6664. |
| [5] | Lewis SJ, Murad A, Chen L, et al. Associations between an obesity related genetic variant (FTO rs9939609) and prostate cancer risk[J]. PLoS One, 2010,5(10):e13485. |
| [6] | Fredriksson R, Hägglund M, Olszewski PK, et al. The obesity gene, FTO, is of ancient origin, up-regulated during food deprivation and expressed in neurons of feeding-related nuclei of the brain[J]. Endocrinology, 2008,149(5):2062-2071. |
| [7] | Pitman RT, Fong JT, Billman P, et al. Knockdown of the fat mass and obesity gene disrupts cellular energy balance in a cell-type specific manner[J]. PLoS One, 2012,7(6):e38444. |
| [8] | Zhang ZB, Zhou DM, Lai YL, et al. Estrogen induces endometrial cancer cell proliferation and invasion by regulating the fat mass and obesity-associated gene via PI3K/AKT and MAPK signaling pathways[J]. Cancer Lett, 2012,319(1):89-97. |
| [9] | Han Z, Niu T, Chang J, et al. Crystal structure of the FTO protein reveals basis for its substrate specificity[J]. Nature, 2010,464(7292):1205-1209. |
| [10] | Gerken T, Girard CA, Tung YCL, et al. The obesity-associated FTO gene encodes a 2-oxoglutarate-dependent nucleic acid demethylase[J]. Science, 2007,318(5855):1469-1472. |
| [11] | Zhao SM, Lin Y, Xu W, et al. Glioma-derived mutations in IDH1 dominantly inhibit IDH1 catalytic activity and induce HIF-1alpha[J]. Science, 2009,324(5924):261-265. |
| [12] | Liu XX, Sun C, Jin XD, et al. Genistein enhances the radiosensitivity of breast cancer cells via G2/M cell cycle arrest and apoptosis[J]. Molecules, 2013,18(11):13200-13217. |
| [13] | Berdis AJ. Current and emerging strategies to increase the efficacy of ionizing radiation in the treatment of cancer[J]. Expert Opin Drug Discov, 2014,9(2):167-181. |
| [14] | Fasih A, Elbaz HA, Huttemann M, et al. The mechanism of metformin-induced radiosensitization of pancreatic cancer cells[J]. Int J Radiat Oncol Biol Phys, 2013,87(2):S653. |
| [15] | Ponnala S, Veeravalli KK, Chetty C, et al. Regulation of DNA repair mechanism in human glioma xenograft cells both in vitro and in vivo in nude mice[J]. PLoS One, 2011,6(10):e26191. |
| [16] | Kim YS, Kang MJ, Cho YM. Low production of reactive oxygen species and high DNA repair:mechanism of radioresistance of prostate cancer stem cells[J]. Anticancer Res, 2013,33(10):4469-4474. |
| [17] | Lavrik OI. DNA repair:a key mechanism stabilizing the genome[J]. Biochemistry, 2011,76(1):3. |
| [18] | Bernstein NK, Hammel M, Mani RS, et al. Mechanism of DNA substrate recognition by the mammalian DNA repair enzyme, Polynucleotide Kinase[J]. Nucleic Acids Res, 2009,37(18):6161-6173. |
| [19] | Meyn RE, Munshi A, Haymach JV, et al. Receptor signaling as a regulatory mechanism of DNA repair[J]. Radiother Oncol, 2009,92(3):316-322. |
| [20] | Kashino G, Liu Y, Suzuki M, et al. An alternative mechanism for radioprotection by dimethyl sulfoxide, possible facilitation of DNA double-strand break repair[J]. J Radiat Res, 2010,51(6):733-740. |
| [21] | Herdendorf T, Nelson S. The molecular mechanism of bacteriophage T4 Rad50/Mre11 DNA repair complex[J]. FASEB J, 2012,26:536.3. |
 2015, Vol. 35
2015, Vol. 35