近年来的免疫学理论认为,辅助性T细胞(Th细胞)按其分泌的细胞因子和功能可分为不同的亚群,即Th1、Th2、Th3/Tr1细胞。其中,Th1细胞主要分泌IL-2和IFN-γ,可以增强杀伤细胞的毒性作用等,促进巨噬细胞活化,参与调节细胞免疫,辅助细胞毒性T细胞的分化,介导细胞免疫应答,参与迟发型超敏反应等;Th2细胞主要分泌IL-4、IL-6、IL-10等,介导体液免疫,促进抗体的生成;Th3/Tr1细胞主要分泌TGF-β,在免疫应答中起负性调节作用。大量的研究已证实,低剂量辐射(low dose radiation,LDR)与中等以上剂量的辐射诱导的生物效应截然不同,可刺激生物体或其组织的防御适应性功能,表现为一系列的适应性反应[1]、激活免疫功能[2, 3],预防和治疗炎症性疾病[4],其中T淋巴细胞的激活是辐射免疫效应的中心环节。本研究在以往研究结果的基础上,采用Th1-Th2-Th3功能分类芯片技术,检测并分析高、低剂量辐射诱导小鼠胸腺的Th 细胞各亚型功能相关基因的差异表达。
1. 实验动物及分组:ICR健康小鼠,雌雄各半,6~8周,18~22 g,购于吉林大学白求恩医学部实验动物中心,生产许可证批号SCXK-吉2008-0005,使用许可证批号SCXK(吉)2008-0011。按随机数字表法分组为:假照组4只、低剂量(0.075 Gy)组4只和高剂量(2.0 Gy)组8只。
2. 照射条件:国产X.S.S.205(FZ)型固定式X射线深部治疗机(辽宁丹东市康嘉仪器设备有限公司),单次高剂量(2.0 Gy)照射,源皮距60 cm,剂量率为0.343 Gy/min;单次低剂量(0.075 Gy)照射,源皮距为178.50 cm,剂量率为12.5 mGy/min。小鼠均为全身照射。
3. 样品的处理:不同剂量X射线照射后24 h,断头处死各组小鼠,取出胸腺组织入EP管中称重,在液氮罐里保存,次日干冰送检(上海康城生物有限公司)。
4. RNA质量检测:质量判断标准:对RNA进行定量,A260/A280应为1.8~ 2.0;有清晰的18S和28S的RNA条带,同时28S和18S的光度比应>2。
5. 荧光定量PCR条件:37℃,15 min;聚合酶激活/变性95℃,10 min。扩增40个循环,循环 1:(1×) 95℃,15 s;循环 2:(40×) 95℃,10 min。
6. 数据分析:以Gapdh为参比基因,对样品进行归一化处理。经软件分析,查看每个基因的扩增情况,导出相应的域值循环数Ct值。采用ΔΔCt相对定量方法估算出各个基因在各剂量组中的相对表达量。将对照的表达量作为1,计算出相对量,进行样品间相对量的比较(定量比值)。照射组与假照组的比值>2.0为上调,<0.5为下调。
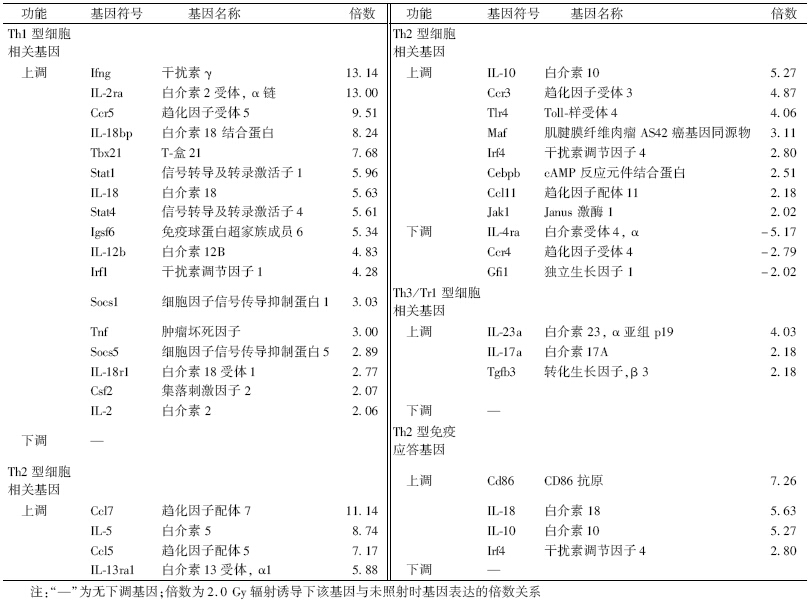
1. 不同剂量辐射诱导Th1-Th2-Th3 PCR Array中差异表达基因分析:结果显示,低剂量(0.075 Gy)X射线全身照射后小鼠胸腺细胞中有8个基因表达上调,5个基因表达下调;高剂量(2.0 Gy)X射线全身照射后小鼠胸腺细胞中有54个基因表达上调,3个基因表达下调。
2. 低剂量辐射诱导Th1-Th2-Th3细胞相关基因的功能分析:表 1结果显示,低剂量辐射诱导胸腺中的Th1型细胞相关基因Stat4和Socs1的表达上调,而对Th2型和Th3/Tr型细胞相关基因IL-4ra、Cebpb、Gata3及Tgfb3的下调,最终导致Th1型免疫应答基因Sftpd上调。
| 表 1 0.075 Gy辐射诱导小鼠胸腺Th1-Th2-Th3功能相关的差异表达基因 |
3. 高剂量辐射诱导Th1-Th2-Th3细胞相关基因的功能分析:表 2结果显示,2.0 Gy辐射均可诱导Th1型、Th2型和Th3/Tr型细胞相关基因的上调,但Th1型免疫应答基因表达无变化,而Th2型免疫应答相关基因Cd86、IL-18、IL-10以及Irf4的上调。
| 表 2 2.0 Gy辐射诱导小鼠胸腺Th1-Th2-Th3功能相关的差异表达基因 |
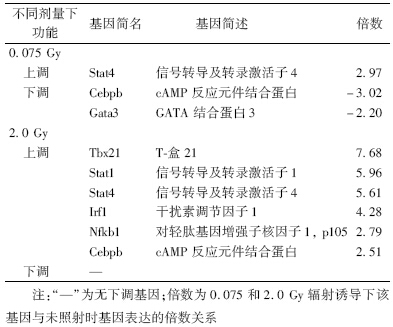
4. 不同剂量辐射诱导Th1-Th2-Th3细胞转录因子及相关基因的分析:表 3结果显示,低剂量辐射诱导转录因子Stat4的上调及Cebpb和Gata3的下调,高剂量辐射可诱导转录因子相关基因[JP] Tbx21、 Stat1、Stat4、Irf1、Nfkb1和Cebpb的上调,但无下调基因。
| 表 3 高、低剂量辐射诱导小鼠胸腺Th1-Th2-Th3 细胞转录因子相关的差异表达基因 |
胸腺是T淋巴细胞分化成熟的重要中枢免疫器官,也是电离辐射作用高度敏感的靶器官之一。因此,胸腺细胞的辐射反应是辐射免疫学研究的重点之一。不同剂量的电离辐射作用于机体可产生不同的生物效应,中等剂量以上的电离辐射对机体产生有害的影响己众所周知,而低剂量的电离辐射效应与之相反,目前仍是辐射研究领域研究的热点。联合国原子辐射效应科学委员会(UNSCEAR)1986年报告指出,低水平辐射是指0.05 Gy以内的高传能线密度(LET)辐射或0.2 Gy以内的低LET辐射,辐射剂量率均应<0.05 mGy/min。目前大量的实验研究己证实低剂量电离辐射可以引起机体免疫功能的增强[5, 6]。
功能分类芯片由于针对性比较强,避免了表达谱芯片中无关基因的干扰,其准确性和灵敏度更高,因此,在辐射免疫学研究中有应用增多的趋势。最新发展的PCR功能分类芯片[7],把实时定量PCR技术与基因芯片技术结合,能在同一张芯片上对上百个基因的mRNA表达水平准确定量检测。该芯片技术克服了先前应用的差异显示PCR方法的假阳性率高、重复性差及对高拷贝基因有偏向性的缺点。本研究通过Th1-Th2-Th3功能分类芯片的结果分析发现,低剂量X射线主要上调诱导Th1细胞中起重要作用的转录激活子4(signal transducer and activators of transcription,Stat4),同时下调Th2细胞的重要转录因子GATA结合蛋白3(Gata3)和Th3/Tr1细胞的标志性细胞因子TGF-β,促使T细胞向Th1细胞分化,诱导Th1型免疫应答,最终提高免疫功能。
近年来的研究表明,当IL-12通过STAT4的信号途径可使CD4+细胞的分化为Th1细胞,而IL-4则通过Stat6的信号途径诱导Th0细胞分化为Th2细胞,并发现这些细胞因子的信号途径对Th1/Th2细胞的极化是与不同SOCS成员的表达有关[8]。如Th分化为Th1型细胞时,SOCS1的表达可比Th2高出2倍;分化为Th2型细胞则表达SOCS3,其表达量可比Th1细胞高出23倍[9]。在本研究结果中发现,2.0 Gy辐射照射后SOCS3的表达高于假照组11.95倍,而SOCS1却上调3.03倍,说明高剂量照射可能主要通过SOCS3的表达上调,向Th2型细胞分化。
另外,本研究结果显示,高剂量辐射上调的基因还有正向调节的细胞因子(IL-12b、IL-15、IL-18、Gm-CSF等)和负向调节的细胞因子(IL-5、TGF-β、IL-10、IL-6、IL-17、IL-23等)以及负向调节的共刺激分子(CTLA-4),同时下调在Th 2 细胞分化早期起重要作用的Gfi-1基因和CD124(IL-4ra),使T细胞主要向Th3/Tr1细胞分化,诱导Th2型免疫应答,抑制机体免疫反应。本实验结果将为辐射免疫学理论增添新的实验依据。
| [1] | Iyer R, Lehnert BE. Low dose, low-LET ionizing radiation-induced radioadaptation and associated early responses in unirradiated cells[J]. Mutat Res, 2002, 503(1-2):1-9. |
| [2] | Ina Y, Sakai K. Activation of immunological network by chronic low-dose-rate irradiation in wild-type mouse strains:analysis of immune cell populations and surface molecules[J]. Int J Radiat Biol, 2005, 81(10):721-729. |
| [3] | Lacoste-Collin L, Jozan S, Cances-Lauwers V, et al. Effect of continuous irradiation with a very low dose of gamma rays on life span and the immune system in SJL mice prone to B-cell lymphoma[J]. Radiat Res, 2007, 168(6):725-732. |
| [4] | Otani A, Kojima H, Guo C, et al. Low-dose-rate, low-dose irradiation delays neurodegeneration in a model of retinitis pigmentosa[J]. Am J Pathol, 2012, 180(1):328-336. |
| [5] | Shan YX, Jin SZ, Liu XD, et al. Ionizing radiation stimulates secretion of pro-inflammatory cytokines:dose-response relationship, mechanisms and implications[J]. Radiat Environ Biophys, 2007, 46(1):21-29. |
| [6] | Dong JC, Cheng GH, Shan YX, et al. Role of PLC-PIP2 and cAMP-PKA signal pathways in radiation- induced immune-suppressing effect[J]. Biomed Environ Sci, 2014, 27(1):27-34. |
| [7] | Lim J, Derrick SC, Kolibab K, et al. Early pulmonary cytokine and chemokine responses in mice immunized with three different vaccines against Mycobacterium tuberculosis determined by PCR array[J]. Clin Vaccine Immunol, 2009, 16(1):122-126. |
| [8] | Tang Y, Chen X, Zhang Y, et al. Fusion protein of tapasin and hepatitis B core antigen 1827 enhances T helper cell type 1/2 cytokine ratio and antiviral immunity by inhibiting suppressors of cytokine signaling family members 1/3 in hepatitis B virus transgenic mice[J]. Mol Med Rep,2014,9(4):1171-1178. |
| [9] | Sporri B, Kovanen PE, Sasaki A, et al. JAB/SOCS1/SSI-1 is an interleukin-2-induced inhibitor of IL-2 signaling[J]. Blood, 2001, 97(1):221-226. |
 2015, Vol. 35
2015, Vol. 35