目前,常用的生物剂量计主要有染色体畸变分析、微核分析等[1, 2]。然而,传统的生物剂量计由于方法复杂、试验周期长,难以在大批量检测时满足快速检测的目的。放射生物剂量学迫切需要找到一种更为快速、简便、高通量的生物剂量计。 DNA损伤诱导基因功能较多涉及细胞周期、细胞凋亡、DNA修复,以及细胞生长、增殖和分化等,多为p53通路相关基因[3]。S100A4基因的功能也与p53基因密切相关,涉及细胞周期调控、细胞凋亡等方面[4, 5, 6]。
本实验室利用基因芯片技术筛选出一系列受到辐射后表达上调的基因,如PIG3、GDF15和S100A4等[7]。张德钦等[8]以及潘艳等[9]已用普通RT-PCR、实时荧光RT-PCR等方法对PIG3基因进行了进一步的研究。本实验将在芯片的研究结果基础上,验证并探索不同电离辐射剂量与永生化淋巴细胞系AHH-1中S100A4基因表达变化的关系。1. 主要试剂和仪器:SYBR Green PCR 荧光混合液(美国ABI公司),TRIzol Reagent(美国ABI公司),7500 Fast实时荧光定量PCR仪(美国ABI公司),Taq聚合酶、DEPC水(北京鼎国昌盛公司),脱氧核糖核苷三磷酸(dNTP)、AMV反转录酶、OligoDT(美国Promega公司),RPMI 1640培养基、胎牛血清(美国GIBCO公司),165系列SDS-PAGE电泳仪(美国Bio-Rad公司),UVP数字凝胶成像系统(美国UVP公司),紫外可见分光光度计(美国Thermo公司)。
2. 细胞培养和照射:永生化淋巴细胞系AHH-1购于北京曼哈顿医学生物技术公司。AHH-1细胞在含体积分数为10%小牛血清、105 U/L青霉素和质量浓度为100 mg/L链霉素的RPMI 1640培养基中,于37℃、饱和湿度的含体积分数为5%CO2培养箱中培养至对数生长期。将处于对数生长期的淋巴细胞换液后在北京师范大学辐照中心进行60Co源γ射线照射。吸收剂量为1 Gy/min,照射距离为73.5 cm,平均照射野为30 cm×30 cm。剂量点分别为0、1、3、5、8、10、15、18 Gy。
3. 细胞总RNA的提取及cDNA合成:照射后预定时间点收获细胞,用1×PBS缓冲液将细胞清洗后,用TRIzol提取总RNA,然后通过紫外分光光度计进行定量。采用RNA反转录法合成相应的cDNA。所有实验组均取2 μg的RNA置于0.5 ml离心管中,然后加入1 μl Oligo(dt)和1 μl 10 mmol dNTP,体积不足7 μl的,用 DEPC水补足至7 μl,在68℃条件下孵育5 min后置于冰上5 min。然后再加入6 μl 5×AMV缓冲液,1 μl AMV反转录酶以及16 μl DEPC水,经40℃ 90 min,95℃ 5 min后终止反应,置于冰上冷却。
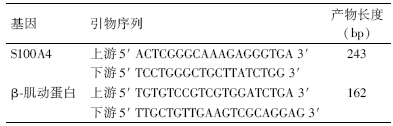
4. 实时定量PCR引物的设计合成: 根据GenBank中的基因信息,应用Primer Premier 5.0软件设计用于实时定量PCR实验检测的S100A4基因,以及内参β-肌动蛋白基因引物序列。引物由上海生工生物技术有限公司合成,并且纯化质检合格(表 1)。
| 表 1 S100A4和β-肌动蛋白基因引物序列 |
5. 实时荧光PCR相对定量检测:利用相对定量的2-ΔΔCt法定量检测S100A4和内参β-肌动蛋白基因表达,并利用Applied Biosystems 7500 Sequence Detection Software(SDS)进行分析。反应体系为:10 μl 2×SYBR green I,2 μl cDNA模板,上下游引物共0.5 μl和7.5 μl双蒸水,共20 μl。反应条件:95℃预变性10 min后进行循环:95℃变性15 s、60℃退火和延伸共1 min,循环进行40次。每个样品设置3个平行样,重复3次实验,并且利用琼脂糖凝胶电泳检测产物的片段大小,确定扩增产物是否为目的基因。每次反应均以β-肌动蛋白为对照。
6. 统计学处理:采用SAS 9.2软件进行统计分析。计量资料以x±s表示。采用6×8析因设计的方差分析(4~72 h共6个时间水平和0~18 Gy共8个剂量水平);两组间差异比较采用t检验;剂量-效应关系分析采用一元线性回归分析。P<0.05为差异有统计学意义。
1. 双因素随机区组设计:照射后各时间点,永生化淋巴细胞系AHH-1中S100A4基因的表达水平上调,各个时间点剂量点上调程度不同。通过方差分析发现,相同时间点,不同受照剂量(0、1、3、5、8、10、15、18 Gy)之间,S100A4 mRNA表达水平不一致,差异有统计学意义(F=2.40,P<0.05);相同受照剂量,不同时间点(4、8、12、24、48、72 h)之间,S100A4 mRNA表达水平不一致,差异有统计学意义(F=8.91,P<0.01);照射后时间与照射剂量之间存在交互作用,差异有统计学意义(F=39.67,P<0.01)。这说明S100A4 mRNA表达水平的上调同时受到照射后时间与照射剂量两个因素的影响。
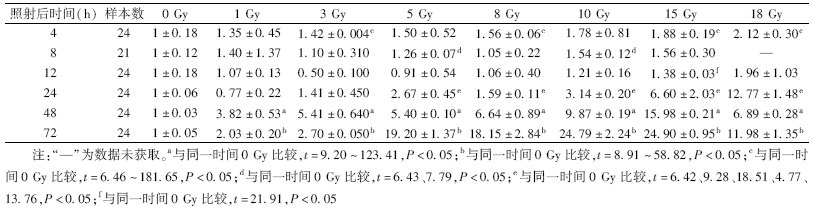
2.不同剂量组与未照射组(0 Gy组)S100A4 mRNA表达水平变化的比较:照射后4、8、12 h,大部分受照组与未照射组相比,S100A4 mRNA表达水平上升不明显,差异无统计学意义,构建剂量-效应曲线无实际意义;照射后24、48及72 h,绝大部分受照组与未受照组相比,S100A4 mRNA表达水平上升明显,差异具有统计学意义,可以构建剂量-效应曲线(表 2)。
| 表 2 不同剂量60Co γ射线照射后不同时间AHH-1细胞S100A4 mRNA相对表达水平(倍数,x±s) |
3. 剂量-效应曲线: 照射后各个时间点0~15 Gy照射剂量范围内S100A4 mRNA表达水平随照射剂量增加大致呈上升趋势,具有一定的剂量-效应关系,分时间点拟合方程,结果如下:24 h时间点,在5~15 Gy剂量范围内,拟合方程为y=-0.72+0.62x(R2=0.7916);48 h时间点,在0~15 Gy剂量范围内,拟合方程为 y=1.63+0.87x(R2=0.931 7);72 h时间点,在0~15 Gy剂量范围内,拟合方程为 y=2.21+1.83x (R2=0.812 9)。其中,y代表S100A4 mRNA表达水平,x代表照射剂量。
随着核能越来越广泛的应用,对大批量目标进行快速、有效、准确的剂量估算成为放射生物计量学的新要求,所以迫切需要找到一种更为快速、简便、高通量的生物剂量计。随着分子生物学技术的不断发展,通过实时荧光PCR的方法检测基因mRNA表达变化的技术已经成熟,具有快速、简便、高通量的优点;研究表明:电离辐射可以诱导一些基因表达上调,其中有些基因的表达变化情况受到电离辐射剂量的影响[7, 8, 9],有可能作为新的辐射损伤标志物,用于估算受照剂量。目前,在放射生物剂量学领域,有关基因表达变化的研究还远不能满足实际应用的要求。本研究在前期芯片研究的基础上,选择了S100A4基因,在照射后的6个时间点(4~72 h)进行研究,希望能为基因表达变化在放射生物剂量学领域中的实际应用提供科学依据。
研究结果显示,S100A4 mRNA的表达变化受到照射剂量与照射时间的影响。当照射时间超过24 h,在0~15 Gy范围内,S100A4 mRNA的表达水平随照射剂量的增加而增加,呈剂量-效应关系。而S100A4 mRNA的表达水平也并非随照射剂量的增加而持续增加,在18 Gy剂量点则表现为不同程度的下降,这可能是由于照射剂量太大,超过了细胞的代偿能力,导致细胞凋亡。当照射时间在24 h之内时,虽然S100A4 mRNA的表达水平随照射剂量的增加而增加,但是只有当照射剂量较大时,S100A4 mRNA表达水平的上升与0 Gy剂量组相比, 差异才具有统计学意义,所以本研究也没有对4~12 h的实验结果拟合方程。本研究结果中,随照射时间的增加,S100A4 mRNA的表达增加幅度增大,照射后72 h S100A4 mRNA的表达增加最多,可达未照射组的24.9倍,而照射后24 h之内则增加较少,大剂量照射后也只能增加2倍左右。另外,在前期试验和本研究中,当照射时间超过或等于24 h时,与5 Gy剂量组相比,8 Gy剂量组S100A4 mRNA的表达水平均有一个小幅的下降,基因芯片的结果也是如此[7],其原因有待于进一步的研究。
人S100A4基因定位于1q21染色体,其mRNA大小为512 bp,属于钙结合蛋白S100家族,最先发现于小鼠肾上腺癌细胞中[10],可在几乎所有的细胞中表达,后证实S100A4在肿瘤细胞中高表达,其高表达与肿瘤大小、TNM分期及不良预后密切相关[11]。S100A4通过与Ca2+结合,发挥多种作用,特别是对细胞的保护作用。首先,S100A4可以和p53 C端的调控区结合,抑制p53在G1~S期检验点的调控功能,从而使细胞跳过检验点进入S期。用S100A4诱导的进入S期的细胞不受G2~M期检验点的审查直接进入M期[4, 5]。另外,S100A4与p53的结合还会导致bax基因的下调,从而抑制由p53介导的凋亡通路[6]。另外,目前也有研究表明,S100A4基因与肿瘤细胞放射敏感性相关,抑制S100A4基因的表达,胰腺癌细胞的的放射敏感性增加[12]。由此可以推断,当细胞受到电离辐射等外界有害刺激时,S100A4基因的表达会上调。这也与本研究所得的结果相符合。
综上所述,S100A4基因在受到60Co γ射线照射后的24~72 h表达上升明显,在一定剂量范围内(0~15 Gy)具有一定的线性关系,照射后48 h S100A4基因表达上升明显,线性关系最好,可重复性最佳,可以作为联合辐射损伤标志物进一步研究。
| [1] | Ghardi M, Moreels M, Chatelain B, et al. Radiation-induced double strand breaks and subsequent apoptotic DNA fragmentation in human peripheral blood mononuclear cells[J]. Int J Mol Med, 2012, 29(5):769. |
| [2] | Vral A, Fenech M, Thierens H. The micronucleus assay as a biological dosimeter of in vivo ionising radiation exposure[J]. Mutagenesis, 2011, 26(1):11-17. |
| [3] | Mayer C, Popanda O, Zelezny O, et al. DNA repair capacity after γ-irradiation and expression profiles of DNA repair genes in resting and proliferating human peripheral blood lymphocytes[J]. DNA repair, 2002, 1(3):237-250. |
| [4] | Parker C, Lakshmi MS, Piura B, et al. Metastasis-associated mts1 gene expression correlates with increased p53 detection in the B16 murine melanoma[J]. DNA Cell Biol, 1994, 13(4):343-351. |
| [5] | Parker C, Whittaker PA, Usmani BA, et al. Induction of 18A2/mts1 gene expression and its effects on metastasis and cell cycle control[J]. DNA Cell Biol, 1994, 13(10):1021-1028. |
| [6] | Grigorian M, Andresen S, Tulchinsky E, et al. Tumor suppressor p53 protein is a new target for the metastasis-associated Mts1/S100A4 protein functional consequences of their interaction[J]. J Biol Chem, 2001, 276(25):22699-22708. |
| [7] | 陆雪, 李玉文, 封江彬, 等. 用基因芯片技术分析不同剂量60Co γ射线照射后淋巴细胞株的差异基因表达谱[J]. 辐射研究与辐射工艺学报, 2009, 27(4):244-247. |
| [8] | 张德钦, 王卉, 张庆召, 等. 60Co γ射线照射后不同时间PIG3基因表达的剂量效应关系研究[G]//中国生物物理学会,上海生物物理学会:第九届全国辐射与环境生物物理学术交流会会议论文.哈尔滨:中国生物物理学会,上海生物物理学会,2011. |
| [9] | 潘艳, 李玉文, 封江彬, 等. 60Co γ射线照射淋巴细胞诱导PIG3和GADD45基因mRNA变化[J]. 辐射研究与辐射工艺学报, 2008, 26(5):309-313. |
| [10] | Ebralidze A, Tulchinsky E, Grigorian M, et al. Isolation and characterization of a gene specifically expressed in different metastatic cells and whose deduced gene product has a high degree of homology to a Ca2+-binding protein family[J]. Genes Develop, 1989, 3(7):1086-1093. |
| [11] | Ismail NI, Kaur G, Hashim H, et al. S100A4 overexpression proves to be independent marker for breast cancer progression[J]. Cancer Cell Int, 2008, 8:12. |
| [12] | 李鹏, 刘江伟, 袁芳, 等. siRNA干扰S100A4mRNA对人胰腺癌细胞放射敏感性的影响[J]. 中华肝胆外科杂志, 2013, 19(10):777-781. |
 2015, Vol. 35
2015, Vol. 35