肿瘤生长是在一个复杂、动态的微环境中,局部浸润的免疫细胞、间质细胞及所分泌的活性介质等均影响肿瘤的生长[1]。调节性T细胞(regulatory T cells,Treg)是一类具有免疫调节功能的成熟T细胞亚群,在机体免疫反应过程中,具有抑制细胞免疫的作用。肿瘤细胞微环境中,Treg也起着抑制肿瘤免疫的作用。因此,研究辐射对肿瘤微环境中的Treg细胞及其相关负性调节因子表达的影响,有助于阐明肿瘤细胞的辐射耐受机制和提高肿瘤的放疗疗效。本实验采用人外周血淋巴细胞与肺腺癌A549细胞建立共培养体系,重点观察辐射对肿瘤微环境中Treg细胞及其标志物叉头翼状螺旋转录因子(Foxp3)和神经纤毛蛋白1(NrP1),负性调节作用的共刺激分子细胞毒T淋巴细胞抗原-4(CTLA-4)和诱导共刺激分子(ICOS)以及负性细胞因子白介素10(IL-10)、转化生长因子-β(TGF-β)和IL-17的影响,探讨电离辐射诱导肿瘤微环境中的免疫耐受机制。
1. 细胞系与主要试剂:人肺腺癌A549细胞系购自中国科学院上海细胞库,[JP2]用RPMI 1640(美国GIBCO公司)培养基[内含10%的胎牛血清(美国GIBCO公司)及青霉素与链霉素各100 U/ml(北京碧云天生物技术研究所)]、37℃、5%CO2孵箱中培养。用0.25%胰酶消化贴壁细胞并传代。PE标记的抗人CD4抗体、FITC标记的抗人CD25抗体、PerCP-cy5.5标记的抗人Foxp3抗体、APC标记的抗人ICOS抗体、PE标记的抗人CTLA-4抗体,均购于美国BD公司;APC标记的抗人NrP1抗体购于美国RD公司。人Foxp3固定/破膜剂及人IL-10、TGF-β、IL-17 ELISA试剂盒均购于美国eBioscience公司。
2. 照射条件:[JP2]国产固定式X射线深部治疗机(XSZ-220/20,辽宁丹东市康嘉仪器设备有限公司),滤板0.5 mm Cu+1.0 mm Al,电压为180 kV,电流18 mA。单次吸收剂量6.0 Gy,源靶距为60 cm,照射野直径30 cm,吸收剂量率为0.372 Gy/min。
3. 外周血淋巴细胞的分离:无菌转移淋巴细胞分离液(lymphocyte separation medium,LSM)到离心管中,将抗凝血和RPMI 1640(-/-)培养基按1[DK]∶1混匀,缓慢加到离心管中,使血液和LSM间形成明显分层;1 500 r/min,离心半径13 cm,室温下离心20 min,在LSM上分4层,吸取淋巴细胞层以及下面一半的LSM,用等体积的RPMI 1640(-/-)洗两次即得淋巴细胞。用RMPI 1640(+/-)重悬细胞。
4. 共培养体系的建立:6孔板中接种肺腺癌A549细胞系(每孔3×105),培养10 h贴壁后,按1:5的比例接种上步提取的淋巴细胞(每孔1.5×106),两组单独接种淋巴细胞、两组与A549细胞进行共培养。3 h后,对一组单独培养和一组共培养细胞进行6.0 Gy X射线照射,培养48 h,另一组不照射。
5. 流式细胞术检测:收集单独培养组与共培养体系中淋巴细胞,调细胞浓度为1×107/ml,每份取100 μl。检测不同亚型Treg细胞,单独培养组与共培养组均加入CD4、CD25抗体,4℃避光30 min,1×PBS洗2遍;分别向其中加入NrP1和Foxp3抗体(胞内分子先加Foxp3固定/破膜剂,4℃避光60 min,破膜缓冲液洗2遍;加入2%血清4℃封闭15 min,[JP3]再加入Foxp3抗体),4℃避光30 min,用0.01 mol/L PBS洗2次,离心半径13 cm,1 500 r/min[JP],离心5 min,弃上清,加PBS 100 μl定容,采用美国BD公司的FACS Aria流式细胞仪检测;另取单独培养组和共培养组分别直接加入ICOS和CTLA-4抗体,4℃避光30 min,0.01 mol/L PBS洗2次,上机检测。每组设5个平行样,共4组。
6. ELISA法检测:严格按照IL-10、TGF-β、IL-17 ELISA试剂盒推荐的步骤进行检测,用自动酶联免疫标记仪,450 nm处检测吸光度(A)值,根据标准品绘制标准曲线,并得出公式,求出所测样本的相应浓度。每组设5个复孔。
7. 统计学处理:采用SPSS 18.0软件进行数据分析,结果以x±s表示。不同组间比较采用方差分析和独立样本t检验,P<0.05为差异有统计学意义。
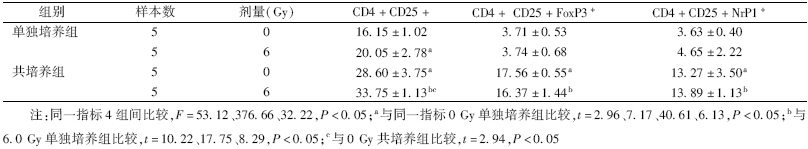
1. 辐射对肿瘤微环境中Treg细胞分化的影响:结果见表 1。由表 1可知,共培养组中,CD4+CD25+、CD4+CD25+FoxP3+、CD4+CD25+NrP1+ Treg细胞比例明显高于淋巴细胞单独培养组(t=7.17、40.61、6.13、10.22、17.75、8.29,P<0.05),但经6.0 Gy X射线照射后,除CD4+CD25+外(t=2.96、2.94,P<0.05),其余亚群比例与0 Gy比较,差异无统计学意义。
| 表 1 辐射对共培养体系中的Treg细胞分化的影响(%,x±s) |
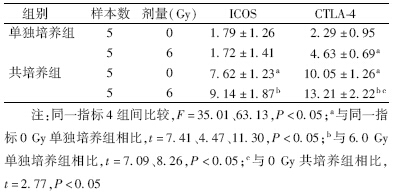
2. 辐射对肿瘤微环境中ICOS和CTLA-4表达的影响:结果见表 2。由表 2可知,与A549细胞共培养的淋巴细胞表达ICOS和CTLA-4的水平均明显高于单独培养组(t=7.41、11.30、7.09、8.26,P<0.05);经6.0 Gy X射线照射后,CTLA-4的比例与0 Gy比较有明显增加(t=4.47、2.77,P<0.05),但ICOS未见明显改变。
| 表 2 辐射对共培养体系中的淋巴细胞ICOS和CTLA-4的表达变化(%,x±s) |
3. 辐射对肿瘤微环境中IL-10、TGF-β和IL-17分泌量的影响:结果见表 3。由表 3可知,与单独培养组比较,共培养组上清中IL-10、TGF-β含量明显升高(t=15.73、2.78、9.06、7.74,P<0.05),但照射后共培养组本身无明显变化;而照射后共培养组IL-17分泌量却明显高于照后单独培养组和未照射共培养组(t=4.00、4.71,P<0.05)。
| 表 3 辐射对共培养体系中的细胞因子IL-10、TGF-β、IL-17分泌量的变化(%,x±s) |
调节性T细胞是一类具有负性免疫调节作用的T淋巴细胞亚群。在肿瘤逃逸、促进肿瘤生长中发挥重要作用。小鼠和人的体外实验表明,CD4+[JP+1]CD25+Treg细胞通过细胞接触依赖机制和分泌抑制性细胞因子等多种机制维持免疫耐受[2]。细胞接触依赖机制,主要是通过膜结合分子介导,抑制T细胞的活化和增殖。叉头翼状螺旋转录因子(Foxp3),依靠其叉头样结构和DNA结合并停留在细胞核内,使基因转录受到抑制,同时抑制某些细胞因子表达。NrP1与CD4+ CD25+ Treg的标志物Foxp3相似,也是表面标志之一,它的存在不依赖于Treg是否活化[3]。有研究认为,NrP1能影响树突状细胞(DC)与T细胞接触,进而影响抗原呈递过程[4]。CD4+CD25+ Foxp3+ Treg通过表达CTLA-4,与活化T细胞表面的B7分子结合来抑制T细胞,还与抗原提呈细胞(APC)表面的CD80、CD86结合,逆向转导信号,产生吲哚胺-2,3-双氧酶(IDO),降解色氨酸,减少T细胞的活化及降解活化的T细胞[5]。本实验结果显示,同肺癌A549细胞共培养后,淋巴细胞中CD4+CD25+ Treg比例明显增多,其表面的Foxp3、NrP1和CTLA-4表达均上调,表明肿瘤细胞在刺激T细胞免疫应答的同时,也作为肿瘤抗原诱导CD4+CD25+ Treg细胞的分化,产生对肿瘤细胞的免疫耐受。6.0 Gy的电离辐射就可刺激CD4+CD25+ Treg分化,促进CTLA-4表达,进一步增强免疫抑制作用,促进对肿瘤的免疫耐受,而对NrP1没有明显作用。目前认为,ICOS与CD28和CTLA-4同源,表达于活化后的T细胞和记忆T细胞上,代替CD28发挥主要的共刺激作用,为Th细胞的有效增殖和活化提供共刺激信号,在活化后的Th细胞效应功能维持上发挥重要作用[6]。本研究结果显示,肿瘤细胞能刺激其周围的淋巴细胞表达ICOS,但辐射对其没有明显的影响。CD4+CD25+Foxp3+Treg经过TCR介导的信号刺激活化,分泌IL-10及TGF-β细胞因子,以抗原非依赖的方式抑制CD4+及CD8+T细胞从而发挥抑制作用。当肿瘤激活非特异性免疫时,DC进行抗原呈递的同时,未成熟的DC会诱导Treg生成。调节性DC被激活后能分泌高水平的IL-10,从而诱导Treg生成,而Treg分泌IL-10又反过来促进DC的分化[7, 8]。Zhang等[9]证实,IL-10通过抑制细胞黏附分子、IFN-β及IL-6诱导免疫耐受。一般认为,TGF-β会在肿瘤细胞进入机体后,拮抗淋巴细胞反应、抑制淋巴细胞增殖、抑制巨噬细胞的激活,并作为一种信号,关闭免疫应答及炎症反应。Treg细胞可通过分泌TGF-β抑制CD8+T细胞和自然杀伤(NK)细胞对肿瘤的直接杀伤作用。本研究结果显示,肿瘤细胞明显促进共培养体系中的IL-10、TGF-β的分泌,而6.0 Gy的X射线照射后并没有明显影响它们的表达,提示在辐射诱导的肿瘤微环境的免疫耐受机制中,可能此两种细胞因子不起关键作用。IL-17是Th17的标志性细胞因子,能增加髓源性抑制细胞的浸润,抑制T细胞增殖和杀伤能力,诱导产生Treg,参与肿瘤免疫逃逸、免疫耐受等病理过程[10]。本研究结果显示,肿瘤细胞刺激后共培养体系中IL-17的分泌量未见明显变化,这与Beriou等[11]报道一致,该研究认为分泌IL-17的Treg细胞在促进其抑制功能的环境中不分泌IL-17,但本实验中发现6.0 Gy X射线照射后共培养体系中IL-17的分泌量显著升高,表明辐射可促进肿瘤微环境的免疫耐受,进而提高肺癌细胞的辐射抗性。Th17细胞究竟是通过诱导细胞毒性T细胞活化来减少肿瘤细胞转移和播散,还是通过促进肿瘤细胞生长增殖等进而促进肿瘤生长,目前仍存在争议[12, 13],但本研究结果表明,辐射在诱导Treg细胞升高的同时,确实可以促进肿瘤微环境中IL-17的分泌,其具体机制尚待进一步研究。
综上,肿瘤细胞作为一种异常细胞,之所以能在强大的免疫系统作用下得以增殖生长,主要原因可能是刺激了调节性T细胞的产生,增强了肿瘤微环境的免疫抑制功能。本实验结果表明,辐射利于Treg细胞的分化和表达,促进Treg的免疫抑制功能,然而,进一步的分子机制还需深入探讨。
| [1] | Sautès-Fridman C, Cherfils-Vicini J, Damotte D, et al. Tumor microenvironment is multifaceted[J]. Cancer Metastasis Rev, 2011, 30(1):13-25. |
| [2] | Bruce MH, Nirupama DV, Giang TT, et al. Distinct regulatory CD4+T cell subsets; differences between naïve and antigen specific T regulatory cells[J]. Curr Opin Immunol, 2011, 23(5):641- 647. |
| [3] | Bruder D, Probst-Kepper M, Westendorf AM, et al. Neuropilin-1:A surface marker of regulatory T cels[J]. Eur J Immunol, 2004,34(3):623-630. |
| [4] | Chaudhary B, Khaled YS, Ammori BJ, et al. Neuropilin 1:function and therapeutic potential in cancer[J]. Cancer Immunol Immunother,2014,63(2):81-99. |
| [5] | Walker LSK. Treg and CTLA-4:Two intertwining pathways to immune tolerance[J]. J Autoimmun,2013, 45(100):49-57. |
| [6] | 许雪青. ICOS:一种重要的新型诱导共刺激分子[J]. 第三军医大学学报,2003, 25(4):351-354. |
| [7] | Whalen JD, Lechman EL, Carlos CA, et al. Adenoviral transfer of the IL-10 gene periarticularly to mouse paws suppresses development of collagen-induced arthritis in both injected and un-injected paws[J]. J Immunol,1999, 162(6):3625-3632. |
| [8] | Sabat R, Grütz G, Warszawska K, et al. Biology of interleukin-10[J]. Cytokine Growth Factor Rev, 2010, 21(5):331-344. |
| [9] | Zhang XG, Lu Y, Wang B, et al. Cytokine production during the inhibition of acute vascular rejection in a concordant hamster-to-rat cardiac xenotransplantation model[J]. Chin Med J (Engl),2007,120(2):145-149. |
| [10] | He D, Li H, Yusuf N, et al. IL-17 promotes tumor development through the induction of tumor promoting microenvironments at tumor sites and myeloid-derived suppressor cells[J]. J Immunol, 2010, 184(5):2281-2288. |
| [11] | Beriou G, Costantino CM, Ashley CW, et al. IL-17 producing human peripheral regulatory T cells retain suppressive funotion[J]. Blood, 2009, 113 (18):4240-4249. |
| [12] | 夏粱. 白细胞介素17与肺癌关系的研究进展[J]. 中国胸心血管外科临床杂志, 2013, 20(2):204-208. |
| [13] | 齐文慧, 黄小娟. Th17细胞与肿瘤微环境关系的研究进展[J]. 中国肿瘤临床, 2013, 40(5):297-299. |
 2015, Vol. 35
2015, Vol. 35