2. 徐州医学院附属医院放疗科
多聚异戊二烯基苯甲酮(garcinol),是由印度藤黄籼果果皮衍生而来的一种化合物,具有抗肿瘤、抗病毒、抗炎、抗氧化及抗衰老等作用[1],它能抑制包括前列腺癌、胰腺癌、乳腺癌等多种肿瘤的生长[2, 3, 4]。此外,garcinol还是一种天然组蛋白乙酰基转移酶(histone acetltransferase,HAT)抑制剂,它能有效抑制HAT家族成员p300/CBP和PCAF(p300/CBP相关因子)的活性,具有增加肿瘤细胞放射敏感性的潜能和抑制肿瘤增殖的作用[5]。2012年日本学者Olike等[6]研究表明,garcinol对宫颈癌HeLa细胞和肺癌A549细胞具有一定的放射增敏作用。本研究建立了体外宫颈癌HeLa 细胞的乏氧模型,研究garcinol对乏氧HeLa细胞的放射敏感性的影响;并通过检测乏氧诱导因子-1α(hypoxia inducible factor -1,HIF-1α)在mRNA及蛋白水平的表达情况,初步探索其影响乏氧HeLa细胞放射敏感性的作用机制,为宫颈癌的临床治疗提供新思路。一、材料与方法
1. 主要试剂与设备:DMEM培养基、胎牛血清购于美国Hyclone公司;garcinol购于美国Cayman公司;二甲基亚砜(DMSO)购于美国Sigma公司;细胞计数仪CCK-8、姬姆萨染色液购于北京碧云天公司;兔抗人HIF-1α抗体购于南京Bioword公司;鼠抗人β-肌动蛋白抗体购于北京中杉金桥公司,山羊抗鼠、抗兔荧光二抗购于美国LICOR公司。医用直线加速器(美国 Varian 公司,23EX)。
2. 细胞培养与处理:HeLa细胞源自徐州医学院肿瘤生物治疗实验室,用含10%胎牛血清的DMEM培养基,于37℃、5%CO2恒温培养箱中孵育培养,每2~3天传代1次。采用上海力康公司三气培养箱制备乏氧模型。取对数生长期的HeLa细 胞,分组处理后放入三气培养箱中,关闭培养箱,将O2、CO2分别调至1%、5%,向培养箱内持续充入99.999%高纯N2,30 min内O2可降至1%,自此计时24、48和72 h后进行下一步实验。
3. 细胞照射:采用6 MV X射线垂直照射,源靶距100 cm,照射剂量0、2、4、6和8 Gy,剂量率300 cGy/min,照射面积根据培养板面积而定,其上加盖1.5 cm的固体胶。
4. CCK-8法检测garcinol对乏氧HeLa细胞增殖的影响:[JP2]取对数生长期细胞,以2.5×104/ml的密度接种于96孔培养板,每孔终体积200 μl,待细胞贴壁后,更换培养液,分别加入含浓度为0、2.5、5、10、20、30和40 μmol/L的garcinol培养液200 μl,每一浓度设4个复孔,同时设调零组(仅加入培养液200 μl),乏氧培养24、48和72 h后,弃去药物,每孔按培养基:CCK-8为10∶1的比例加入CCK-8试剂,注意避光操作。加完CCK-8后30 min,1、2和4 h在全自动酶标仪(测定波长为450 nm)测定每孔吸光度值(A)。实验重复3次取平均值。细胞增殖率=(实验组平均A值/对照组平均A值)×100%,计算药物作用于宫颈癌HeLa细胞的10%抑制浓度(IC10)。
5. 细胞克隆形成实验观察garcinol对乏氧HeLa细胞放射敏感性的影响:取对数生长期的HeLa细胞,以100~3 000/孔接种于6孔板中(每组设3个平行样本),待细胞贴壁后分单纯乏氧组、garcinol+乏氧组(浓度为20 μmol/L),作用24 h,分别给予0、2、4、6和8 Gy的6 MV X射线照射,照射后更换不含药物的培养基继续培养,每3天换液1次,培养10~14 d,固定、姬姆萨染色,镜下计数每孔中形成的克隆数(≥50个细胞为1个克隆形成标准)。实验重复3次,取平均值。按以下公式计算克隆形成率(PE)=(克隆数/细胞接种数)×100%,细胞存活分数(SF)=某照射组细胞PE/未受照射组细胞PE。根据单击多靶模型和线性二次模型拟合细胞存活曲线,并计算细胞放射敏感性参数。
6. 反转录PCR法检测HIF-1α mRNA的表达:实验分常氧组、乏氧组、DMSO组、乏氧+照射组、乏氧加药组和乏氧加药照射组。提取各组总RNA,测定RNA的浓度和纯度,并进行RNA定量,配成相同浓度的RNA。取3 μg总RNA进行反转录,以cDNA为模板,进行PCR,反应条件:95℃预变性3 min;95℃变性40 s,53~55℃退火40 s,72℃延伸1 min,循环35次;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳分析,紫外凝胶成像,实验重复3次。HIF-1α引物上游:5' ACCACTGCCACCACTGATG 3',下游:5' TGCTCCATTCCATTCTGTT-CAC 3',扩增产物为455 bp。GAPDH引物上游:5' AGGTCGGAGTCAACGGATTTG 3',下游:5' GTGATGGCATGGACTGTGGT 3',扩增产物为532 bp。
7. Western blot法检测HIF-1α的表达:用全细胞裂解液裂解不同处理组细胞,提取细胞总蛋白,测定蛋白浓度,制作12%分离胶和4%浓缩胶,待其凝固后,每孔加40~60总蛋白,SDS-聚丙烯酰胺凝胶电泳2 h左右,NC膜半干转60~90 min,在含5%脱脂奶粉的TBST中封闭2 h,4℃孵育一抗过夜(β-肌动蛋白 1∶500、HIF-1α 1∶500),室温孵育二抗(1∶5 000)2 h,TBST连续洗脱二抗3次后,荧光扫描成像。
8. 统计学处理: 计量数据用x±s 表示, 采用SPSS 16.0软件进行数据统计分析, 。两组之间比较采用t检验,多组间比较采用单因素方差分析,方差齐两两比较用SNK法检验和(或)LSD法检验。P<0.05为差异有统计学意义。 二、结果
1. garcinol对乏氧HeLa细胞增殖活性的影响:用不同浓度garcinol作用于乏氧HeLa细胞不同时间后观察细胞的生长情况(表 1),可见garcinol对乏氧HeLa细胞具有增殖抑制作用,且在一定浓度范围内呈浓度-时间依赖性,随着药物浓度的升高和作用时间的延长,其对细胞增殖的抑制作用逐渐增强。计算24 h的IC10为20.63 μmol/L,据此确定实验浓度为20 μmol/L。
| 表 1 不同浓度的garcinol作用不同时间后的 乏氧HeLa 细胞增殖率(%,x±s ) |
2. garcinol对乏氧HeLa细胞放射敏感性的影响:应用Graphpad prism 5.0软件分别采用单击多靶模型和线性二次模型计算出各组放射生物学参数(表 2)。garcinol+乏氧组SF2明显低于单纯乏氧组(t=8.23,P<0.05),garcinol+乏氧组的D0和Dq大于garcinol+乏氧组,α小于garcinol+乏氧组,SER为1.13。
| 表 2 单击多靶模型和线性二次模型生物学参数 |
3. 反转录PCR检测HeLa细胞中HIF-1α mRNA的表达:乏氧HeLa细胞经不同处理后,对比常氧和乏氧下HIF-1α mRNA的表达情况(图 1)。乏氧各处理组中HIF-1α mRNA的表达高于常氧组(t=3.75~8.22,P<0.05);但在乏氧各处理组间变化不大。
 | 注:1.常氧组;2.乏氧组;3.DMSO组;4.乏氧+照射(4 Gy);5.乏氧加药组(20 μmol/L garcinol);6. 乏氧加药照射组(20 μmol/L garcinol+4 Gy);M.Marke图 1 不同处理组HIF-1α mRNA的表达变化 |
4.Western blot检测细胞内HIF-1α的表达:乏氧组HIF-1α表达较常氧组升高(t=3.37,P<0.05);DMSO组和乏氧组HIF-1α蛋白表达差异无统计学意义(P>0.05);乏氧加药组中HIF-1α较乏氧组下降(t=3.20,P<0.05);与乏氧照射组(t=14.04,P<0.05)和乏氧加药组(t=7.98,P<0.05)相比,乏氧加药照射组HIF-1α蛋白表达降低(图 2)。
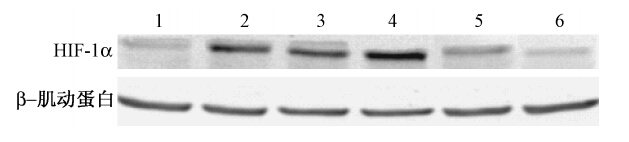 | 注:1.常氧组;2.乏氧组;3.DMSO组;4.乏氧+照射(4 Gy);5.乏氧加药组(20 μmol/L garcinol);6. 乏氧加药照射组(20 μmol/L garcinol +4 Gy) 图 2 不同处理组HIF-1α蛋白的表达变化 |
5.不同时间、浓度下HeLa细胞内HIF-1α的蛋白表达:如图 3所示,随着乏氧时间的增加,HeLa细胞内的HIF-1α的表达逐渐增加(F=45.30,P<0.05);乏氧24 h时,随着garcinol作用浓度的增加,HIF-1α的表达逐渐减低(F=30.26,P<0.05)。这表明,HIF-1α的蛋白表达与乏氧作用时间具有时间相关性;gsrcinol抑制HIF-1α的蛋白表达具有浓度依赖性。
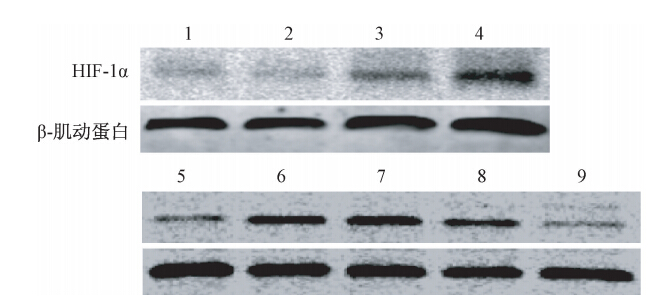 | 注: 1.常氧;2.乏氧12 h;3.乏氧24 h; 4.乏氧48 h; 5.常氧;6.乏氧24 h;7.乏氧24 h+10 μmol/L garcinol; 8. 乏氧24 h+20 μmol/L garcinol;9.乏氧24 h+40 μmol/L garcinol图 3 Western blot检测HeLa细胞内HIF-1α的表达[ |
肿瘤生长的微环境对细胞放射敏感性的影响,其中最重要的是细胞的氧合状态,实体瘤中乏氧细胞占10%~50%,其放射抗拒比正常氧合细胞强2.5~3倍[7]。此外,乏氧与肿瘤增殖、免疫逃逸、代谢、侵袭转移均有重要关系,严重影响肿瘤放射治疗疗效[8, 9]。放射治疗是宫颈癌的重要治疗手段,然而临床上放射治疗效果并不理想,其原因与肿瘤内存在乏氧细胞密切相关。
乏氧肿瘤细胞能上调HIF-1的表达,主要是HIF-1α,HIF-1上调后作用于下游VEGF、COX-2等至少150种基因的表达,促进了肿瘤血管生成,有利于肿瘤细胞再氧合,使放射治疗的抗拒性增加[10]。经研究发现,乏氧是通过促进HIF-1α的C末端转活区域与p300等共同激活因子相结合,从而增加HIF-1α活性[11]。作为一种天然HAT抑制剂,garcinol可有效抑制p300/CBP和PCAF的活性[12]。因此,在乏氧HeLa细胞中,garcinol可能会通过抑制p300/CBP的活性影响HIF-1α的表达,从而起到放射增敏作用。
本研究通过模拟宫颈癌的乏氧微环境,建立体外培养HeLa细胞的乏氧模型,通过对乏氧HeLa细胞的增殖率的比较发现:在一定浓度范围内,garcinol对乏氧HeLa细胞的增殖具有抑制作用,且呈明显的时间-浓度依赖性。克隆形成实验结果表明garcinol对乏氧HeLa细胞具有一定的放射增敏作用。反转录PCR实验表明,garcinol对乏氧HeLa细胞中HIF-1α mRNA的表达无明显作用;或者20 μmol/L garcinol不足以引起乏氧HeLa细胞中HIF-1α mRNA的表达变化。Western blot结果显示,随着乏氧时间的增加,HeLa细胞内的HIF-1α的表达逐渐增加;相同乏氧时间,随着garcinol作用浓度的增加,HIF-1α的表达逐渐减低。这表明garcinol增加乏氧HeLa细胞放射敏感性与可降低HIF-1α蛋白表达密切相关。
综上所述,garcinol对乏氧HeLa细胞的增殖具有抑制作用,并起到一定的放射增敏作用,其机制可能是通过降低乏氧HeLa细胞中HIF-1α蛋白表达水平来实现的,这为临床上宫颈癌的治疗提供一定的理论依据和实验基础。但是,garcinol对乏氧肿瘤细胞的作用机制错综复杂,详细机制有待进一步的研究来阐明。
| [1] | Sang S, Cheng X, Stark RE, et al. Chemical studies on antioxidant mechanism of tea catechins: analysis of radical reaction products of catechin and epicatechin with 2,2-Diphenyl-1-picrylhydrazyl [J]. Bioorg Med Chem, 2002, 10(7) :2233-2237. |
| [2] | Ahmad A, Wang Z, Wojewoda C, et al. Garcinol-induced apoptosis in prostate and pancreatic cancer cells is mediated by NF-κB signaling [J]. Front Biosci(Elite Ed), 2011, 3 :1483-1492. |
| [3] | Parasramka MA, Gupta SV. Synergistic effect of garcinol and curcumin on anti- proliferative and apoptotic activity in pancreatic cancer cells [J/OL]. J Oncol, 2012, 2012 :709739. |
| [4] | Ahmad A, Sarkar SH, Bitar B, et al. Garcinol regulates EMT and Wnt signaling pathways in vitro and in vivo, leading to anticancer activity against breast cancer cells [J]. Mol Cancer Ther, 2012, 11(10) :2193-2201. |
| [5] | Balasubramanyam K, Altaf M, Varier RA, et al. Polysoprenylated Benzophenone, garcinol, a natural histone acetyltransferase inhibitor, represses chromatin transcription and alters global gene expression [J]. J Biol Chem,2004, 279(32):33716-33726. |
| [6] | Olike T, Ogiwara H, Torikai K, et al. Garcinol, a histone acetyltransferase inhibitor, radiosensitizes cancer cells by inhibiting non-homologous end joining [J]. Int J Radia Oncol Biol Phys, 2012, 84(3) :815-821. |
| [7] | Karar J, Maity A. Modulating the tumor microenvironment to increase radiation responsiveness [J]. Cancer Boil Ther, 2009, 8(21): 1994-2001. |
| [8] | Rockwell S, Dobrucki IT, Kim EY, et al. Hypoxia and radiation therapy: past history, ongoing research, and future promise [J]. Curr Mol Med, 2009, 9(4):442-458. |
| [9] | Wouters A, Pauwels B, Lardon F, et al. Implications of in vitro research on the effect of radiotherapy and chemotherapy under hypoxia conditions [J]. Oncologist, 2007, 12(6):690-712. |
| [10] | Cohen-Jonathan Mogal E. Angiogenic inhibitors and radiotherapy: from the concept to the clinical trial [J]. Cancer Radiother, 2009, 13(6-7): 562-567. |
| [11] | Lando D, Peet DJ, Gorman JJ, et al. FIH-1 is an asparaginyl hydroxylase enzyme that regulates the transcriptional activity of hypoxia-inducible factor [J]. Genes Dev, 2002, 16(12): 1466-1471. |
| [12] | Balasubramanyam K, Altaf M, Varier RA, et al. Polyiso-prenylated benzophenone, garcinol, a natural histone acetyltransferase inhibitor, represses chromatin transcription and alters global gene expression [J]. J Biol Chem, 2004, 279(32): 33716-33726. |
 2015, Vol. 35
2015, Vol. 35