近距离放疗具有在局部的高剂量及边缘剂量的迅速衰减优势。鉴于头颈部复杂的解剖结构和重要的生理功能,在控制原发肿瘤的同时要尽量保留器官的生理功能,放射粒子植入近距离放疗则不失为一个理想的选择。持续低剂量照射在治疗头颈部鳞癌方面已经积累了很多的经验[1]。近距离放疗不但能提高肿瘤局部的照射剂量,而且本实验还证明了在相同的照射剂量下,对于舌鳞癌Tca8113细胞,125I粒子持续低剂量率照射比单次高剂量率照射、分次高剂量率照射具有更强的抗肿瘤效应。 一、材料与方法
1. 细胞培养:人舌鳞癌细胞Tca8113由北京市肿瘤防治研究所提供,购自美国标准生物品收藏中心(ATCC)。细胞培养用含10%胎牛血清的RPMI 1640(美国Hyclone公司),置于37℃,5%CO2培养箱中。
2. 实验分组:取对数生长期细胞,通过胰酶-EDTA消化制成单细胞悬液,种植于35 mm培养皿,24 h贴壁后进行照射。实验分为4组:假照射对照组、单次高剂量率照射组(SDR)、分次高剂量率照射组(FDR)、125I粒子持续低剂量率照射组(125I-CLDR),每组3个平行样。
3. 照射方式:125I粒子持续低剂量率照射采用粒子照射模型[2, 3]。初始剂量率为2.77 cGy/h。根据公式计算[2],照射0.5、1、2、4和6 Gy分别需要18.1、36.5、73.7、150.0和229.4 h。高剂量率外照射使用RS2000 X射线生物辐射仪(美国Rad Source公司),剂量率为1.052 Gy/min。单次照射组为1次照射完成总剂量。125I粒子持续低剂量率照射组采用相同的剂量点。分次照射组为1次/d,每次2 Gy,仅照射4和6 Gy。
4. 集落形成实验:[JP2]取一定数量的活细胞种植在35 mm培养皿中,24 h后进行照射,然后继续培养14 d。甲醇固定10 min,瑞氏姬姆萨染色5 min。在常规显微镜下计数,>50个细胞为1个克隆,计算克隆形成率(PE):PE(%)=(克隆数/细胞接种数)×100%;计算存活分数(SF):SF(%)=(照射组PE/对照组PE)×100%。根据线性平方模型SF=e-(αD-βD2),采用Graphpad prism 5.0软件拟合剂量存活曲线,计算相对生物学效能(RBE):RBE=标准射线剂量(SDR)/待测射线剂量(CLDR)。
5. 细胞凋亡检测:于照射4 Gy后的24、48和72 h,将消化后的细胞,制成浓度为5×105/ml的单细胞悬液。取1 ml细胞悬液,PBS(北京中杉金桥生物技术有限公司)洗2遍,加入200 μl染液(北京庄盟国际生物基因科技有限公司),避光室温孵育15 min。1 ml PBS洗1遍,400 μl PBS重悬,流式细胞仪(美国BD公司)检测前加10 μl PI(1 μg/ml,美国Sigma公司)。Annexin V-FITC阳性细胞为凋亡细胞。
6. 细胞周期检测:取已制成的单细胞悬液1 ml,预冷的PBS洗2遍,预冷的75%乙醇2 ml固定,4℃冰箱过夜。PBS洗2遍,300 μl染色液(PI和 RNaseA至终浓度50 μg/ml)重悬细胞,37℃水浴避光孵育30 min。PBS洗1遍,400 μl PBS重悬细胞,流式细胞仪检测,结果用ModFitLT 2.0软件进行分析。
7. Western blot检测:照射4 Gy后分别提取各组细胞的总蛋白,检测照射后24、48和72 h不同时间点γ-H2AX、CyclinB1、Caspase3的表达量的变化。
8. 统计学处理:每个实验重复2~3次。数据用x±s 表示,以Graphpad prism 5.0软件进行统计学处理,采用非配对t检验或双因素方差分析比较组间差异。P<0.05为差异有统计学意义。 二、结果
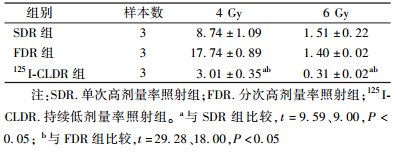
1. 125I-CLDR对Tca8113细胞克隆形成的抑制作用:克隆形成实验结果表明,SDR组和125I-CLDR组的SF2分别为0.53和0.24。125I-CLDR 组照射4 Gy时,与SDR组相比,RBE=1.3。在4和6 Gy下,不同照射方式对Tca8113细胞克隆形成的抑制能力依次为125I-CLDR>SDR>FDR,组间比较,差异有统计学意义(t=9.59,29.28和9.00,18.00,P<0.05,表 1)。
| 表 1 不同照射方式4和6 Gy照射下Tca8113细胞的克隆形成率(%,x±s ) |
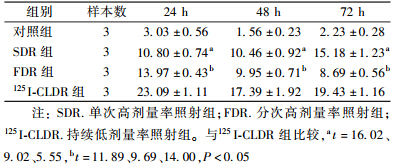
2. 125I粒子照射诱导细胞凋亡结果:4 Gy照射后24、48和72 h,3组的凋亡率均较对照组增高。其中,125I-CLDR组的凋亡率增高最明显。与对照组、SDR组和FDR组比较,差异有统计学意义(t=5.55~16.02,P<0.05,表 2)。
| 表 2 Gy照射后不同时间各组Tca8113细胞的凋亡率(%,x±s ) |
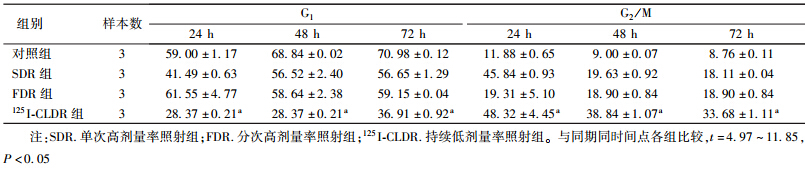
3. 125I粒子照射对细胞周期比例的影响:与对照组比较,3组细胞在4 Gy照射后24、48和72 h,G1期细胞比例均下降,G2/M期细胞比例均增加。与SDR组和FDR组比较,125I-CLDR组G2/M期细胞比例增加最明显,G1期细胞比例下降最明显。除了与SDR组24 h差异无统计学意义外,与其他各组各个时间点比较,差异均有统计学意义(t=4.97~11.85,P<0.05,表 3)。
| 表 3 各组细胞4 Gy照射后不同时间G1和G2/M期分布情况(%,x±s ) |
4. 125I粒子照射对γ-H2AX、Caspase3、CyclinB1等蛋白表达量变化的影响: 4 Gy照射后,γ-H2AX、Caspase3、CyclinB1 等蛋白量的表达,SDR组、FDR组、125I-CLDR组都较对照组增加,并且125I-CLDR组蛋白量增加最为明显(图 1)。
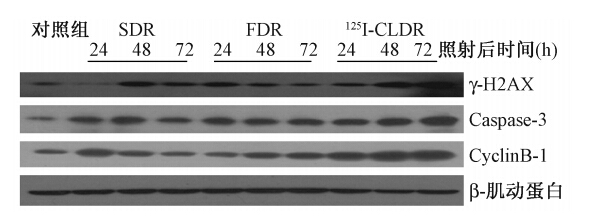 | 注:SDR.单次高剂量率照射组;FDR.分次高剂量率照射组;125I-CLDR.持续低剂量率照射组图 1 不同方式照射后相关蛋白表达量的变化 |
近距离放疗适用于舌癌的治疗。既可单独应用,也可以与外照射联合治疗肿瘤。GEC-ESTRO对于舌鳞癌单独的近距离治疗主要推荐用于T1N0和T2N0的<4 cm肿瘤[1]。Kobayashi等[3]采用单纯近离距放疗、外照射联合近距离放疗对100例舌鳞癌患者进行治疗后,单纯近距离放疗组和近距离放疗联合外照射组的5年局部控制率分别为93.9%和91.6%,5年生存率为74.2%和41.4%(后者生存率低主要是因为晚期病例更多)。Mazeron等[4]对T1-2N0的患者单独采用近距离放疗的局部控制率>90%,高于外照射补加近距离放疗者。Jiang等[5]对25例复发性头颈部鳞癌采用125I植入治疗取得了较好疗效,中位无病生存期12个月。1年和2年的局部控制率分别为48.7%和39.9%,1年和2年的生存率分别为42.5%和28.3%。
持续低剂量率辐射能够抑制肿瘤的增殖。其生物学效应主要表现包括辐射引起的DNA损伤、细胞周期再分布、细胞凋亡诱导等。本研究显示,4 Gy照射后,Tca8113细胞克隆能力下降。Tca8113的125I-CLDR组存活分数比SDR组和FDR组明显降低,差异有统计学意义。辐射引起DNA双链断裂后,组蛋白H2AX磷酸化形成γ-H2AX,并在或邻近DNA双链断裂的部位形成γ-H2AX聚集点[6]。γ-H2AX的表达量往往与DNA双链断裂及DNA损伤修复密切相关。史鸿云等[7]将食管癌细胞系进行X射线照射后,4 Gy照射的ECA109和TE13细胞在0.5 h后γ-H2AX蛋白量表达即有升高,并且随着照射剂量的增加,γ-H2AX蛋白表达的第1次高峰逐渐提前。ECA109细胞在低剂量照射后24 h能够恢复到放疗前水平。本实验中的γ-H2AX的蛋白量表达在3个照射组中均较对照组有明显上调。SDR组中48 h表达量最高,FDR组中24 h时表达量最高,而125I-CLDR组则有持续增高的趋势,提示125I-CLDR组可能存在持续的DNA损伤修复过程。SDR组在24 h时γ-H2AX下降,其后又出现了γ-H2AX的升高。因未检测24 h内蛋白的变化,故24 h γ-H2AX蛋白表达下降,具体原因还需要进一步研究。
不少学者认为凋亡是辐射后肿瘤细胞死亡的主要形式之一。Szostak等[8]对前列腺癌患者进行125I粒子治疗,发现近距放疗后较照射前凋亡指数明显增加。Chen等[9]对肺癌的125I粒子治疗研究中都证实了大量凋亡的存在。在本研究中,125I-CLDR组Tca8113细胞完成4 Gy照射后24、48和72 h的凋亡率较SDR组和FDR组均有明显增加。3组照射后细胞Caspase-3蛋白量表达均明显上调。Caspase家族在凋亡的调节中具有重要作用。当细胞受到凋亡信号刺激时,外源性凋亡通路激活Caspase-8、Caspase-10。内源性凋亡通路激活Caspase-9。一旦被活化,Caspase-8、Caspase-9就可以剪切并激活Caspase效应因子Caspase-3、Caspase-6、 Caspase-7,从而剪切相应的细胞骨架蛋白、DNA等,引起细胞凋亡[10]。Caspase-3是最重要的凋亡执行因子之一。本实验中,125I-CLDR组的Caspase-3蛋白量表达持续增加,与流式细胞仪检测到细胞凋亡比率持续增加的现象一致,说明125I-CLDR可以通过诱导Tca8113细胞Caspase-3蛋白表达上调,从而引起细胞的凋亡。
辐射可以引起细胞周期再分布,主要是G2/M期的阻滞。本实验中在3组不同方式的照射后,均出现了G1期细胞比例下降,G2/M期细胞比例增加。G2/M期细胞的比例以125I-CLDR组最高,并且出现持续高比例的现象。FDR组G2/M期细胞的比例增加最少。SDR组在照射后24 h达高峰,与125I-CLDR组相近,之后有所减少,与FDR组相近。检测照射各组细胞CyclinB1蛋白的表达量与其细胞周期阻滞现象的变化一致。从G2期进入M期需要活化的CDK1/CyclinB。CyclinB在G1期活性很低,随着细胞的进程,CyclinB表达逐渐增加,在G2期积累,并与CDK1结合,形成无活性的CDK1/CyclinB复合体。在G2/M交界处由磷酸化的CDC25介导激活CDK1/CyclinB复合体,从而促进细胞有丝分裂的进程。以往文献报道,当辐射导致DNA损伤时,就会激活ATM/ATR,最终抑制CDC25磷酸化,从而抑制CDK1/CyclinB复合体的激活[11]。本实验显示的125I-CLDR组G2/M期持续阻滞,CyclinB1蛋白量表达持续上调,说明该照射方式可以长时间地抑制Tca8113细胞的有丝分裂进程,可能也是通过抑制CDK1/CyclinB1蛋白复合体的活化,而不是直接抑制CyclinB1蛋白的表达来实现的。由于细胞处于G2/M期时对辐射更敏感,因此,大量细胞凋亡。
总之,相对于外照射组,125I粒子持续低剂量率照射后导致TCa8113细胞更高的凋亡率,持续的G2/M期的阻滞,更低的克隆形成能力,说明125I粒子持续低剂量率照射造成的TCa8113细胞DNA的损伤更明显。
| [1] | Mazeron JJ, Ardiet JM, Haie-Méder C, et al. GEC-ESTRO recommendations for brachytherapy for head and neck squamous cell carcinomas[J]. Radiot Oncol, 2009, 91(2):150-156. |
| [2] | 王济东,王俊杰,张红志,等.放射性125I粒子离体照射模型的建立和测量[J].中华放射医学与防护杂志,2007,27(3):267-270. |
| [3] | Kobayashi Y, Karasawa K, Komiya Y, et al. Therapeutic results for 100 patients with cancer of the mobile tongue treated with low dose rate interstitial irradiation[J]. Anticancer Res, 2007, 27(3B):1689-1692. |
| [4] | Mazeron JJ, Noël G, Simon JM. Head and neck brachytherapy[J]. Semin Radiat Oncol, 2002,12(1):95-108. |
| [5] | Jiang YL, Meng N, Wang JJ, et al. Percutaneous computed tomography/ultrasonography guided permanent iodine-125 implantation as salvage therapy for recurrent squamous cell cancers of head and neck[J]. Cancer Biol Ther, 2010,9(12):959-966. |
| [6] | Rogakou EP,Boon C, Redon C,et al.Megabase chromatin domains involved in DNA double-strand breaks in vivo[J]. J Cell Biol,1999,146(5):905-916. |
| [7] | 史鸿云,祝淑钗,卢付河,等.γ-H2AX在不同食管癌株系中的剂量时间效应特点[J]. 肿瘤防治研究,2013,40(4):321-326. |
| [8] | Szostak MJ, Kaur P, Amin P, et al. Apoptosis and bcl2-expression in prostate cancer: significance in clinical outcome after brachytherapy[J]. J Urol,2001,165(6 Pt1):2126-2130. |
| [9] | Chen HH, Jia RF, Yu L, et al. Bystander effects Induced by continuous low-dose-rate 125I seeds potentiate the killing action of irradiation on human lung cancer cells in vitro[J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1560-1566. |
| [10] | Thornberry NA, Lazebnik Y. Caspases:enemies from within[J]. Science, 1998,281(5381):1312-1316. |
| [11] | Kastan MB, Bartek J. Cell-cycle checkpoints and cancer[J]. Nature,2004,432(7015):316-323. |
 2015, Vol. 35
2015, Vol. 35