肿瘤的免疫治疗是指通过调节机体对肿瘤的免疫反应而产生抗肿瘤作用的治疗方法,它可以通过提高机体的免疫功能,从而抑制或消除肿瘤生长,还可通过提高机体对放、化疗的耐受能力,达到协同抑制或消除肿瘤的目的。其中,过继免疫治疗被认为是抗肿瘤治疗的有效方案,已成为继手术、放疗、化疗后,对肿瘤患者进行综合治疗的重要手段之一[1, 2, 3]。其中,以细胞因子诱导的杀伤细胞 (cytokine-induced killer,CIK)和树突状细胞(dendritic cells,DC)为基础的肿瘤免疫治疗是研究的重点。低剂量辐射(low dose radiation,LDR)是指人体遭受200 mGy以内的低LET辐射或50 mGy以内的高LET辐射。许多研究已经发现LDR 可以诱导体外培养的体细胞出现免疫增强效应。本实验通过观察DC细胞、CIK细胞、DC+CIK细胞联合低剂量辐射对乳腺癌细胞体外杀伤活性的影响,为肿瘤的临床治疗提供实验依据。
1. 材料和主要试剂:RPMI 1640培养基购自美国GIBCO公司,人淋巴细胞分离液LymphoprepTM购自挪威Axis-Shield公司,重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、干扰素-γ(IFN-γ)、重组人白介素-2(rhIL-2)、重组人白介素-4(rhIL-4)购自厦门特宝生物工程有限公司,CD3、CD56、HLA-DR、CD14、CD83、CD86抗体均购自美国BD公司。人外周血浓缩白细胞购自长春市中心血站,乳腺癌细胞系MCF-7和SK-BR-3由本研究室提供。
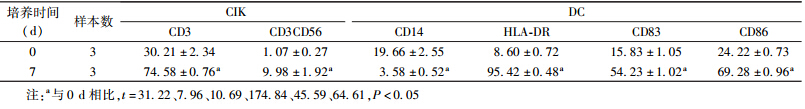
| 表 1 培养不同时间细胞表面因子表达情况 (%,x±s) |
2. DC与CIK细胞制备:人外周血浓缩白细胞经人淋巴细胞分离液密度梯度离心获得外周血单个核细胞(PBMC),生理盐水洗涤2次,用无血清RPMI 1640重悬,调整细胞浓度为5×106/ml铺入6孔板,置于37℃、5%CO2培养箱中静止培养2 h。贴壁细胞用于DC的培养,采用含IL-4(30 ng/ml)、GM-CSF(50 ng/ml)和10%胎牛血清的RPMI 1640培养基,于37℃、5%CO2培养箱中培养。第6天,加入TNF-α100 ng/ml,并继续培养。收集未贴壁细胞置于新的培养瓶中,调整细胞浓度为2×106/ml,当天加入IFN-γ1000 U/ml,培养24 h,加入CD3单抗50 ng/ml及IL-2 300 U/ml。每3天调整细胞密度为1×106/ml,更换培养基,并补加IL-2 300 U/ml。
3. DC与CIK的共培养:DC、CIK细胞分别培养至第7天,计数后,按1∶5的比例混合,用CIK细胞培养液(含有IL-2 300 U/ml)培养产生DC-CIK细胞。
4. 细胞表型分析:收集培养7 d的DC和CIK细胞,用PBS洗涤重悬后,以流式细胞术检测DC表型(HLA-DR、CD14、CD83、CD86)和CIK表型(CD3、CD56)。收集共培养7 d的DC-CIK细胞和培养14 d的CIK细胞,联合低剂量照射后,流式细胞术检测CD3CD56的表达情况。
5. 细胞毒活性检测:以培养14 d的CIK细胞和共培养7 d的DC-CIK细胞为效应细胞,乳腺癌SK-BR-3细胞系为靶细胞进行细胞毒活性检测。取对数期生长的SK-BR-3细胞,以7 000/孔的密度接种于96孔板,24 h后以不同效靶比(2.5∶1、5∶1、10∶1、20∶1、40∶1)把效应细胞及靶细胞加入96孔板,另设单独靶细胞及效应细胞孔,每孔设3个复孔,24 h后每孔加入CCK-8 20 μl,1~4 h后应用酶标仪检测吸光度(A)值,计算杀伤率。计算公式为:杀伤率(%)=[1-(A实验孔-A效应细胞孔) /A靶细胞孔]×100%。
6. CCK-8法检测各组效应细胞对MCF-7和SK-BR-3细胞的杀伤活性:收集培养14 d的CIK细胞和共培养7 d的DC-CIK细胞,应用CCK-8的方法,检测CIK组和DC-CIK组对MCF-7和SK-BR-3细胞的杀伤活性。
7. 低剂量辐射联合CIK或DC-CIK的杀伤活性检测:采用美国Branford公司X-RAD 320 X射线辐照仪照射,源靶距30 cm,剂量率12.5 mGy/min。按方法5接种MCF-7和SK-BR-3细胞,CIK和DC-CIK细胞分别接受40、80、120 mGy X射线照射。照射后24 h将效应细胞以效靶比10∶1加入96孔板,设3个平行样,同时设靶细胞对照组。于37℃、5%CO2条件下培养24 h,每孔加入CCK-8 20 μl,1~4 h后应用酶标仪检测吸光度(A)值,计算杀伤率。
8. 统计学处理:数据以x±s 表示。采用SPSS 17.0软件进行分析,两样本均数的比较采用t检验。P<0.05为差异有统计学意义。
1. DC与CIK细胞的表型分析:DC与CIK细胞培养至第7天时,与培养前相比,表达CD3、CD3CD56、HLA-DR、CD83、CD86的细胞显著增加,CD14表达明显降低,差异均有统计学意义(t=7.96~174.84,P<0.05),见表 1。
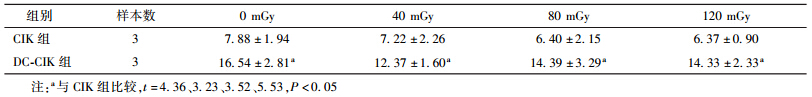
2. 低剂量照射后细胞表面因子CD3CD56表达情况:培养14 d的CIK细胞和共培养7 d的DC-CIK细胞分别经40、80、120 mGy X射线照射后,检测细胞表面因子的表达,结果见表 2。照射前后CIK和DC-CIK细胞CD3CD56表达差异无统计学意义。两组相比,各照射剂量点DC-CIK组的CD3CD56表达水平明显增加,差异有统计学意义(t=3.23~5.53,P<0.05)。
| 表 2 两组不同剂量的低剂量照射后CIK及DC-CIK细胞表型CD3CD56的差异(%,x±s ) |
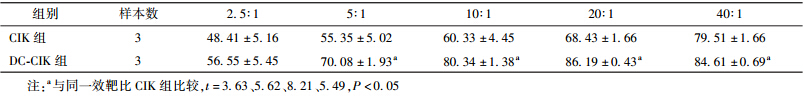
3. CIK和DC-CIK细胞对SK-BR-3细胞的杀伤作用:以乳腺癌细胞SK-BR-3为靶细胞,在5~40效靶比范围内,DC-CIK组细胞对SK-BR-3的杀伤活性均高于CIK组,且差异具有统计学意义(t=3.63~8.21,P<0.05),见表 3。
| 表 3 两组效应细胞不同效靶比时的杀伤活性(%,x±s ) |
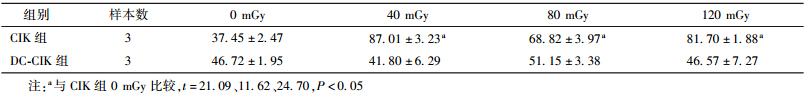
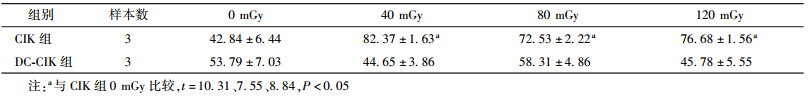
4.联合低剂量照射后CIK 和DC-CIK对乳腺癌细胞的杀伤作用:CCK-8结果显示,CIK细胞照射后对乳腺癌细胞MCF-7和SK-BR-3的杀伤活性高于未照射细胞,DC-CIK细胞照射前与照射后对乳腺癌细胞杀伤作用差异无统计学意义。见表 4,5。
| 表 4 两组效应细胞不同剂量照射后对MCF-7的杀伤活性(%,x±s ) |
| 表 5 两组效应细胞不同剂量照射后对SK-BR-3的杀伤活性(%,x±s ) |
CIK细胞是将人外周血单个核细胞在体外用多种细胞因子共同培养一段时间后获得的一群异质细胞。CIK兼具有T淋巴细胞强大的抗癌活性和NK细胞的非组织相容性抗原复合物(MHC)限制性杀瘤优点。CD3+CD56+表型T淋巴细胞是CIK细胞群中主要效应细胞[4]。
DC细胞是人体内最有效的专职抗原提呈细胞,具有捕获、加工处理抗原和向T淋巴细胞提呈抗原分子、表达共刺激分子、释放细胞因子和白细胞介素等特性[5]。因此,DC在肿瘤细胞免疫应答中起主要免疫调节作用,是肿瘤免疫中最重要的免疫辅佐细胞。
已有研究证实,DC与CIK共培养可以促进CIK细胞成熟,同时增强CIK的杀伤作用,这可能与DC分泌的多种细胞因子有关[6, 7, 8, 9]。DC能分泌IL-2、IL-12、IFN-γ等,促进CIK成熟。DC分泌的高水平IL-2能诱导Th1型免疫应答,有利于杀伤肿瘤细胞。因此,在肿瘤的临床治疗中,经常采用DC-CIK细胞回输的方法。本研究表明,DC与CIK共培养获得的DC-CIK细胞较单纯CIK细胞对乳腺癌细胞有更强的杀伤活性。
低剂量辐射可以刺激细胞提高在分子水平上的修复功能、提高淋巴反应性、促进抗体形成以及增强细胞抗肿瘤效应,机体受到低剂量辐射的最终结果是机体免疫功能增强。免疫增强效应早在20世纪70年代就有报道,它表现在淋巴细胞及其亚群分裂、增殖加快以及抗体水平形成加快、NK细胞活性和抗体依赖性细胞活性(ADCC)增强、细胞因子分泌增强等。LDR可以诱导体外培养的体细胞出现免疫增强效应已被广泛证实,例如Kraska和Bilski[10]研究表明,低于200 mSv的电离辐射可能对生物体有益。对日本原子弹爆炸受照者的研究发现,0.5 Gy以下剂量的受照者移居美国后,后期免疫功能增强,其中,以外周血NK细胞毒活性升高表现较为显著,而在日本居住的原爆幸存者中未发现这种免疫增强现象[11]。CIK细胞接受低剂量辐射,80 mGy为最佳照射剂量,且2次照射CIK细胞的杀伤活性高于单次照射[12]。本实验选用低剂量辐射常用的40、80、120 mGy为研究剂量,结果发现低剂量辐射能增强CIK细胞对乳腺癌细胞的杀伤活性,即低剂量辐射能协同免疫杀伤作用。而DC-CIK细胞没有表现出低剂量辐射诱导的兴奋效应,其原因可能与DC细胞的辐射抗性有关[13]。还有文献报道,DC细胞与T细胞共培养能降低T细胞增殖,从而抑制免疫系统的功能[14]。DC-CIK生物免疫疗法目前已在临床得到应用,成为肿瘤生物治疗最成熟的治疗方案之一,而联合低剂量辐射优化治疗方案的相关研究还未见报道。本研究表明CIK联合LDR的杀伤效应优于单纯CIK、DC-CIK和DC-CIK联合LDR,临床上更节约成本和时间,操作更简便,为临床过继免疫治疗提供了新思路。
综上所述,本研究表明,低剂量辐射能增强CIK细胞对乳腺癌细胞的杀伤活性,为乳腺癌临床治疗提供了可靠依据。低剂量辐射对效应细胞的作用机制还不明确,针对机制的进一步研究正在进行中。
| [1] | 杨光, 王彬, 何志洁. 自体CIK细胞治疗晚期恶性肿瘤的临床研究[J]. 南京医科大学学报(自然科学版), 2009, 29(12):1744-1747. |
| [2] | Olioso P, Giancola R, Di Riti M, et al. Immunotherapy with cytokine induced killer cells in solid and hematopoietic tumours: a pilot clinical trial[J]. Hematol Oncol, 2009, 27(3):130-139. |
| [3] | Leemhuis T, Wells S, Scheffold C, et al. A phase I trial of autologous cytokine-induced killer cells for the treatment of relapsed Hodgkin disease and non-Hodgkin lymphoma[J]. Biol Blood Marrow Transplant, 2005, 11(3):181-187. |
| [4] | Wang Y, Dai H, Li H, et al. Growth of human colorectal cancer SW1116 cells is inhibited by cytokine-induced killer cells[J]. Clin Dev Immunol, 2011,2011:621414. |
| [5] | Gordon JR, Ma Y, Churchman L, et al. Regulatory dendritic cells for immunotherapy in immunologic diseases[J]. Front Immunol, 2014,5: 7. |
| [6] | González-Carmona MA, Mrten A, Hoffmann P, et al. Patient-derived dendritic cells transduced with an a-fetoprotein-encoding adenovirus and co-cultured with autologous cytokine-induced lymphocytes induce a specific and strong immune response against hepatocellular carcinoma cells[J]. Liver Int, 2006,26(3): 369-379. |
| [7] | Wongkajornsilp A, Somchitprasert T, Butraporn R, et al. Human cytokine-induced killer cells specifically infiltrated and retarded the growth of the inoculated human cholangiocarcinoma cells in SCID mice[J]. Cancer Invest, 2009,27(2): 140-148. |
| [8] | Tan G, Zhang X, Feng H, et al. The therapeutic effect of cytokine-induced killer cells on pancreatic cancer enhanced by dendritic cells pulsed with K-ras mutant peptide[J]. Clin Dev Immunol, 2011,2011:649359. |
| [9] | Annunziato F, Cosmi L, Santarlasci V, et al. Phenotypic and functional features of human Th17 cells[J]. J Exp Med, 2007,204(8): 1849-1861. |
| [10] | Kraska A, Bilski B. Exposure of healthcare personnel to ionizing radiation in the light of radiation hormesis hypothesis[J]. Med Pr, 2012,63(3): 371-376. |
| [11] | 李小娟, 孙全富. 低剂量电离辐射全身照射人群的结核病危险及其免疫状态[J]. 中华放射医学与防护杂志, 2006,26(1):97-99. |
| [12] | 杨光,姚丽华,孙利兵,等. 低剂量辐射对恶性肿瘤患者自体CIK细胞免疫功能影响的实验研究[J]. 中华放射医学与防护杂志, 2010,30(6):708-711. |
| [13] | Bogdándi EN, Balogh A, Felgyinszki N, et al. Effects of low-dose radiation on the immune system of mice after total-body irradiation[J]. Radiat Res, 2010,174(4):480-489. |
| [14] | Jahns J, Anderegg U, Saalbach A, et al. Influence of low dose irradiation on differentiation, maturation and T-cell activation of human dendritic cells[J]. Mutat Res, 2011, 709-710:32-39. |
 2015, Vol. 35
2015, Vol. 35