2. 南方医科大学附属珠江医院血液内科
由医用直线加速器所产生的高能X射线进行放疗,是恶性肿瘤治疗常用的方法。X射线产生的电离辐射可使机体发生生理、病理和生化等方面的改变,不同剂量X射线可诱导不同免疫效应。辅助性T细胞在炎症、自身免疫病、肿瘤等免疫失衡所引发的疾病中发挥重要的免疫调节作用,电离辐射对辅助性T细胞及其相关细胞因子影响的研究日益受到关注[1, 2]。本实验观察了不同剂量X射线照射后,小鼠Th细胞及其相关细胞因子的变化特点,期望能为电离辐射免疫损伤的分子机制研究提供新的启示,对该类损伤的治疗提供基础研究。
1. 实验动物: 8~10周龄SPF级BALB/c小鼠100只,购自南方医科大学实验动物中心,饲养于南方医科大学药学院动物实验科空气层流房无菌饲养室。小鼠照射前1周开始,在饮水中加红霉素250 mg/L和庆大霉素320 mg/L,持续至实验结束。
2.主要试剂及仪器: 红细胞裂解液(Tris-NH4Cl)由分析纯试剂配制。QAM-TH17-1细胞因子芯片为美国RayBiotech 公司产品。FACS Calibar流式细胞仪为美国BD公司产品。ELISA检测试剂盒为美国R&D公司产品。
3.分组及照射条件: 100只BALB /c小鼠用随机数字表完全随机分为4组,包括健康对照组和X射线照射组3个组(分别予2、4和6 Gy 照射),每组25只。每组按5个不同的检测时间点0、7、14、21和28 d完全随机分为5个亚组,每组5只。
4. 外周血白细胞计数: 每周从4个组中各取相应时间点的5只小鼠尾静脉断尾取血,以红细胞裂解液处理后,常规方法计数白细胞总数。
5. 细胞因子芯片检测: 每只小鼠取血清35 μl,将每亚组5只小鼠血清混合后用于基因芯片检测。检测采用双抗体夹心法,通过激光扫描仪(激发频率=532 nm)读取数据。采用QAM-TH17-1的数据分析软件来进行数据分析。两组之间就标准化值进行比对,得出相应比值,若比值>1.3或<0.77,视为表达上调或下调。
6. ELISA检测: 经细胞因子芯片筛选后,用ELISA方法检测IL-4、IFN-γ、IL-17含量。用眼球摘除采血法每只小鼠取血清100 μl,按照ELISA 试剂盒说明书推荐步骤进行,使用TECAN SUNRISE 酶标仪在450 nm 波长处检测各孔吸光度(A)值,绘制标准曲线,在标准曲线上查出血清样品各细胞因子的含量。
7. 统计学处理: 实验结果用x ±s表示,数据采用SPSS 16.0软件进行析因设计资料方差分析,多重比较采用LSD-t检验。P<0.05为差异有统计学意义。
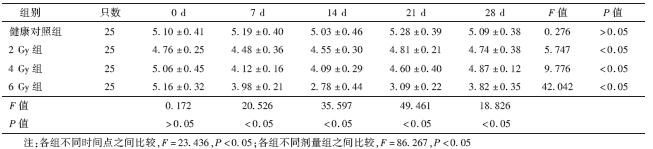
1.X射线照射后外周血白细胞变化:与健康对照组相比,其他各组在照射后14 d内白细胞呈进行性降低,降低程度随照射剂量增大而增大。至第21天白细胞数逐渐回升,2 和4 Gy组4周后恢复至正常水平,6 Gy组在第28天仍明显低于健康对照组(t=6.178,P<0.05),见表 1。
| 表 1 各组小鼠照射后不同时间外周血白细胞的变化(×109/L,x ±s) |
2. X射线照射后Th相关细胞因子的芯片分析:QAM-TH17-1细胞因子芯片包含IL-1b、IL-2、IL-4、IL-5、IL-6、IL-10、IL-12 p70、IL-13、IL-17、IL-17F、IL-21、IL-22、IL-23、IL-28、IFN-γ、MIP-3α、TGF-β及TNF-α共18种细胞因子抗体。经软件分析,IFN-γ、IL-6、IL-17、TGF-β多时间点出现上调;IL-23多时间点出现下调,IL-4、IL-5、IL-10、TNF-α在6 Gy高剂量率照射后早期(7 d)出现下调。Th17细胞分泌的IL-17经2~6 Gy 照射后均出现增高,4和6 Gy等较大剂量辐照对IL-17分泌的刺激作用持续到21 d,Th17细胞的分化刺激因子IL-23在4和6 Gy组下调,21 d可恢复。
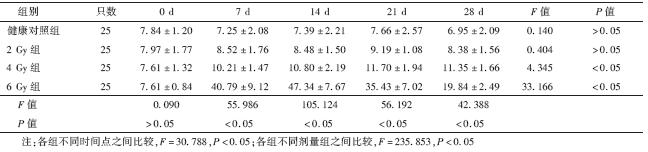
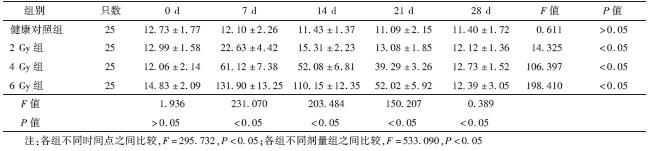
3.某些细胞因子及IFN-γ/IL-4比值的变化: 根据细胞因子芯片筛选的结果,对与Th1/Th2细胞平衡密切相关的IFN-γ、IL-4和Th17细胞大量分泌的IL-17进行ELISA检测,并对IFN-γ/IL-4值进行分析。IFN-γ浓度随照射剂量增高而明显增高,且浓度增高可持续至28 d(与正常对照相比t=6.856,P<0.05);IL-4浓度在2和4 Gy照射后7 d增高, 但在6 Gy照射后下降(与正常对照相比t=7.328,P<0.05),经统计分析6 Gy X射线照射后IFN-γ/IL-4值在7、14、21和28 d均比健康对照组明显增高(t=8.335、9.982、6.990、3.074,P<0.05),呈先升高后降低的变化趋势,14 d达峰值(表 2)。IL-17浓度随照射剂量增高而明显增高,6 Gy组在7、14和21 d均明显高于对照(t=23.743、21.759、17.662,P<0.05),7 d达峰值(表 3)。
| 表 2 各组小鼠照射后不同时间血清IFN-γ/IL-4值的变化 |
| 表 3 各组小鼠照射后不同时间血清IL-17的变化 |
本实验对小鼠进行X射线照射发现,与健康对照组比较,小鼠在接受2、4和6 Gy的X射线照射后白细胞均呈先降低后回升的趋势。细胞因子芯片筛查发现,照射后7 d小鼠血清IL-4、IL-5、IL-10、IL-23、TNF-α含量减少,之后随着白细胞数量回升,细胞因子也基本恢复到正常水平,推测白细胞总量的减少可能是导致细胞因子减少的原因之一。X射线照射后浓度增高的细胞因子较多,在多个时间点均出现IFN-γ、IL-6、IL-17、TGF-β的增高,其中IL-6、TGF-β受多种因素诱导,可由多种细胞分泌,其变化可能继发于组织损伤,特异性较差[3, 4]。IFN-γ和IL-17分别是Th1细胞和Th17细胞特征分泌的细胞因子。因此,经筛选,对IFN-γ、IL-4和Th17进行ELISA检测。
IFN-γ主要由Th1 细胞分泌,此外Th1 细胞还分泌IL-2、IFN-γ、TGF-β等细胞因子,介导细胞免疫、细胞毒性T 细胞(CTL) 分化与激活、巨噬细胞活化,抑制B 细胞,在清除胞内微生物感染中发挥重要作用。Th2 细胞主要分泌IL-4特征性细胞因子等,介导体液免疫反应,也是IgG和IgE 类抗体生成的转换因子。IL-4、IL-2 及IFN-γ 的相互作用是维持Th1 /Th2 平衡的关键。IL-2 和IL-4 分别是诱导Th1和Th2 细胞分化的主要细胞因子,促进它们的增殖分化,而IFN-γ则可拮抗IL-4 的作用。其他细胞因子也参与了Th1 /Th2 细胞分化的调控,可见在Th1 /Th2 细胞的分化过程中是由一系列细胞因子构成复杂的细胞因子网络调控完成的[5]。
既往研究发现,可以用IFN-γ和IL-4表达量的比值变化来反映Th1 /Th2平衡的变化趋势[6, 7],本实验显示,随着照射剂量的增大,IFN-γ与IL-4比值明显增高,提示Th1细胞发挥重要作用,抑制了Th2细胞的分化,也就是Th1 /Th2 细胞的平衡发生了向Th1细胞的偏移,细胞免疫反应增强。赵冬梅等[8]研究也发现,全身照射可导致小鼠各脏器淋巴细胞数量减少,但诱导IFN-γ表达阳性的效应性Th1和Tc1细胞百分比增加[8]。Th1细胞比例的相对升高,可能是由于照射造成了广泛的组织损伤,促进IFN-γ和TNF-α等细胞因子的释放,IFN-γ又进一步诱导Th0向Th1的分化,分化的Th1又能分泌IFN-γ,从而进入向Th1偏移的循环。
机体的抗肿瘤免疫以细胞免疫为主,Th1型反应发挥重要作用,IL-2 刺激NK细胞或CTL发挥杀瘤活性,IFN-γ具有较强的免疫调节作用,TGF-β可直接导致瘤细胞的凋亡,而Th2型细胞因子具有抑制作用。因此,这种增强在肿瘤、病原体入侵的状态下有利于对肿瘤的杀伤和对病原体的清除。但是在自身免疫性疾病或者移植排斥状态下,IFN-γ、TGF-β的过度表达将加重靶器官的损伤。究竟这种偏移是急性照射直接作用于免疫系统的结果,还是照射对其他脏器损伤的继发效应,还有待进一步的实验证实。
本实验还发现在X线照射后,IL-17含量持续升高,至照后28 d尚未恢复至正常水平,但其刺激因子IL-23在4和6 Gy照射后下降。IL-17是可由Th17细胞大量分泌,但不具有Th17细胞特异性[9],在炎症反应过程中先天免疫细胞也产生了大量的IL-17[10]。IL-17的上调在肿瘤发生发展中的作用目前尚有争议,一方面,IL-17 可通过诱导IL-6活化Stat3途径,上调抗凋亡、促生长和促血管生成基因的表达,发挥促进肿瘤生长的作用;另一方面,IL-17 也能通过诱导趋化因子招募树突状细胞及杀伤性效应细胞至肿瘤位置,从而间接起到抗肿瘤的作用[11]。因此,X射线照射后发生的IL-17持续上调对机体的利弊有待进一步研究,维持IL-17在一个合理的范围内可能有助于肿瘤性疾病的治疗。
综上所述,低于致死量的X射线照射可使小鼠血清增强免疫的IFN-γ、IL-17等细胞因子浓度升高,呈Th1细胞偏移。这种对免疫系统的增强作用可能在放疗过程中起到了加强对肿瘤细胞杀伤的效果。
| [1] | 郝振月,徐德胜. 电离辐射对淋巴细胞及某些细胞因子的影响[J].中华放射医学与防护杂志,1994,14(1):64-66. |
| [2] | 孟凡旭,何淑梅,董娟聪,等.电离辐射对小鼠脾细胞中调节性T细胞及其相关分子表达的影响[J].中华放射医学与防护杂志,2010,30(5):540-543. |
| [3] | Jin J, Sundararaj KP, Samuvel DJ, et al. Different signaling mechanisms regulating IL-6 expression by LPS between gingival fibroblasts and mononuclear cells: seeking the common target[J]. Clin Immunol,2012,143(2): 188-199. |
| [4] | Licona-Limón P, Soldevila G. The role of TGF-β superfamily during T cell development: new insights[J]. Immunol Lett, 2007, 109(1): 1-12. |
| [5] | Coghill JM, Sarantopoulos S, Moran TP, et al. Effector CD4+ T cells, the cytokines they generate, and GVHD: something old and something new[J]. Blood, 2011, 117(12): 3268-3276. |
| [6] | Sharma A, Khan R, Joshi S, et al. Dysregulation in T helper 1/T helper 2 cytokine ratios in patients with multiple myeloma[J]. Leuk Lymphoma, 2010, 51(5):920- 927. |
| [7] | Franke A, Lante W, Kollig E, et al. Exogenous IL-12 and its effect on TH 1/TH 2 cell activity after cardiac surgery[J]. Shock, 2009, 32(4):366- 373. |
| [8] | 赵冬梅, 尹玲玲, 徐开林,等. 60Co全身致死剂量照射对小鼠T细胞亚群分布及其IFN-γ和IL-17表达水平的影响[J]. 中华血液学杂志,2014,35(11):1005-1008. |
| [9] | Cua DJ, Tato CM. Innate IL-17-Produecing cells: the sentinels of the immune system[J]. Nat Rev Immunol, 2010,10(7): 479-489. |
| [10] | Korn T,Bettelli E,Oukka M,et al. IL-17 and Th17 Cells[J]. Annu Rev Immunol, 2009, 27: 485-517. |
| [11] | Zou W, Restifo NP. T(H)17 cells in tumour immunity and immunotherapy[J]. Nat Rev Immunol, 2010, 10(4):248-256. |
 2015, Vol. 35
2015, Vol. 35