2. 天津市环湖医院放疗科
恶性胶质瘤是常见的原发性中枢神经系统肿瘤,预后较差[1, 2]。放射治疗是恶性胶质瘤重要的辅助治疗[3],其通过损伤DNA杀死肿瘤细胞。然而DNA损伤修复系统(DNA damage repair,DDR)会修复受损的DNA,导致肿瘤细胞产生放射抗性[4, 5]。研究发现射线可诱导肿瘤细胞内miRNA的表达发生变化[6, 7],并且miRNA作为一种基因转录后调节因子,可参与调节DDR[8]。有文献报道,胶质瘤细胞中miR-221和miR-222的表达水平明显高于正常脑组织,其与瘤细胞的放射敏感性相关[9]。本实验发现胶质瘤细胞受照后通过c-jun介导miR-221/222的表达,并且证实miR-221/222通过激活Akt通路增加了恶性胶质瘤细胞的放射抗性。
1.试剂:U251、U87及LN229恶性胶质瘤体外细胞系购自中国科学院上海细胞生物学研究所。DMEM 和胎牛血清购自美国GIBCO公司。脂质体2000购自美国BRL公司。Akt、 pAkt、PTEN、c-jun、p-c-jun、 DNA-PKcs及GSK-3β等抗体购自美国Santa Cruz公司。miRNA反义寡核苷酸和随机对照寡聚核苷酸购自上海吉玛制药公司,反义miR-221序列:5' GUCAACAUCAGUCUGAUAAGCUA 3',反义miR-222序列:5' GUCAACAUCAGUCUGAUAAGCUA 3',随机对照序列:5' UCUACUCUUUCUAGGAGGUUGUGA 3'。免疫组织化学试剂盒购自北京中杉公司。BALB/c裸鼠鼠龄为5周,体重约为18~22 g,购自并饲养于天津医科大学动物实验中心。
2.细胞培养和转染:所有细胞采用常规方法在DMEM完全培养液中进行培养。恶性胶质瘤体外细胞系培养与转染方法见文献[10]。每个胶质瘤细胞系分3组,分别为对照组、转染无义序列组和反义miR-221/222共转染组。
3.照射方法:采用美国瓦力安600直线加速器6 MV X射线,源靶距为100 cm,剂量率为3.2 Gy/min,总剂量2 Gy。
4. Real-time PCR检测胶质瘤细胞受照射后miR-221/222的表达:按照Ambion mirVanaTMmiRNA提取试剂盒说明书,提取上述3组细胞总miRNA,Nanodrop紫外分光光度计测定总miRNA的浓度和纯度。按照mirVanaTMqRT-PCR miRNA检测试剂盒说明书操作,Opticon 3软件计算△Ct值。
5. 平板克隆形成实验观察敲低miR-221/222对胶质瘤细胞的放射增敏作用:对照组及反义miR-221/222共转染组接种于6孔板内,分别进行特定剂量的照射处理(0、2、4、6、8、10 Gy),24 h后,用2.5 g/L的胰酶消化并计数,种植相应数量的细胞于含10%胎牛血清的DMEM培养基中培养。培养10~14 d后用平衡盐溶液冲洗,Giemsa液染色10 min,清水冲洗,在SYNGENE ChemGenius成像,系统上成像并计算克隆数(细胞数大于或等于50),评测细胞的贴壁效率及计算细胞的存活率。
6. 染色质免疫沉淀实验:用1%甲醛混溶1×107个细胞,加入甘氨酸至终浓度为0.125 mol/L,平衡盐溶液漂洗,SDS裂解液预冷,超声波破碎细胞(每次10 s,间隔60 s,执行10次)。离心半径8 cm,12 000 r/min,4℃离心5 min,取超声剪切的染色质,加入Protein A,4℃摇床1 h,离心半径8 cm,2 500 r/min,离心5 min,取上清的10%作为Input,余上清分成3份。在4℃条件下向上述3份上清中加入c-jun抗体,聚合酶Ⅱ抗体(阳性对照)和IgG抗体(阴性对照)进行隔夜培养。之后加入Protein A凝胶磁珠进行沉淀,洗脱蛋白质-DNA复合物,去交联,纯化DNA,按照相关文献处理[11]。对3份样品进行实时PCR扩增处理,c-jun引物序列为:5' TGGTCCTTCCTCTAAGATTGGTCC 3',反义5' TCAACACAACTGCCTACTGC 3';阳性对照组:5' AAACCACCCATCCAGAAGGG 3',阴性对照组:5' CGTGGCAGCACTCGTAAGACT 3'。PCR产物用1.5%琼脂糖凝胶电泳检测。用比较阈值法评价实验结果[11]。
7.生物信息学分析及虫荧光素酶活性报告试验:分别通过TESS数据库(TESS database: http://www.cbil.upenn.edu/cgi-bin/tess/tess)和miRNA靶标数据库(http://pictar.bio.nyu.edu/),查询miR-221/222与c-jun及PTEN的相关生物信息。构建含PTEN 3'UTR及其突变序列的载体(pGL3'UTR-PTEN和pGL3'UTR mut-PTEN),将其分别与U251细胞系转染无义序列组,反义miR-221组,反义miR-222组及反义miR-221/222共转染组进行转染,同时设对照。48 h后,采用Tecen多功能连续波长扫描分析检测系统,检测虫荧光素酶活性。
8. Western blot检测敲低胶质瘤细胞miR-221/222表达后相关蛋白的表达:方法见参考文献[12]。
9. 体内实验:建立裸鼠移植肿瘤模型,分4组:对照组、反义miR-221/222共转染组、放射组与反义miR-221/222共转染联合放射组。具体方法见参考文献[13]。从治疗开始测量移植瘤的最大径和最小径,按公式V=(a×b2)/2计算肿瘤大小(a为肿瘤的长径,b为肿瘤的短径),每2天测量1次,直至第28天结束。处死小鼠,免疫组织化学染色检测相关蛋白的表达,采用S-P免疫组织化学试剂盒,在同一标本的4张病理切片中分别加入PTEN、 pAkt、 DNA-PKcs和GSK-3β(按照1∶100稀释)4种鼠I抗,4℃过夜,加入生物素标记鼠抗IgG,辣根过氧化物酶标记的链酶卵白素,DAB显色,苏木素复染,以细胞核染成黄褐色为阳性,观察移植瘤中相关蛋白的表达情况。
10. 统计学处理:SPSS 17.0统计软件处理,计量资料以x ±s表示,使用方差分析、t检验及SNK 检验,P<0.05为差异有统计学意义。
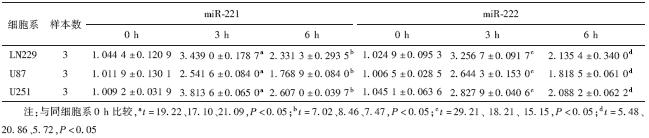
1. 放射后胶质瘤细胞miR-221和miR-222的表达上调:给予胶质瘤细胞2 Gy照射, Real-time PCR检测受照后3 和 6 h的miR-221和miR-222水平,结果显示U251,U87及LN229细胞受照射后3 和 6 h miR-221 和miR-222水平升高,差异有统计学意义(t=5.48~29.21,P<0.05),见表 1。
| 表 1 不同细胞系2 Gy射线照射后不同时间miR-221和miR-222的相对表达(x ±s) |
2. 敲低miR-221/222的表达提高了胶质瘤细胞的放射敏感性:平板克隆形成实验结果显示,U251,U87及LN229细胞在接受不同剂量的照射处理后,反义miR-221/222共转染组的细胞存活率明显低于对照组,差异有统计学意义(F=1 012.32~1 789.12,P>0.05),见表 2。
| 表 2 各组不同细胞系不同剂量照射后的存活率(%,x ±s) |
3. 放射激活c-jun介导miR-221与miR-222的转录:生物信息学分析发现c-jun可能与miR-221和miR-222启动子存在结合。Western blot检测胶质瘤细胞受照后5、15、30 min、1、3及6 h磷酸化c-jun(p-c-jun)及总c-jun的水平,结果显示在受照射后5 min到1 h 时间内p-c-jun水平明显升高,但c-jun水平保持稳定(图 1A)。c-jun RNAi下调胶质瘤细胞c-jun的表达 (图 1B) ,Real-time PCR检测细胞中miR-221和miR-222的表达,结果显示两者水平较对照组均明显降低(P<0.001)。染色质免疫沉淀实验结果显示c-jun在miR-221/222启动子区较阴性对照组明显丰富,而在敲低c-jun细胞中未发现相关染色质丰富情况。上述结果表明放射激活c-jun转录调控miR-221与miR-222的表达。
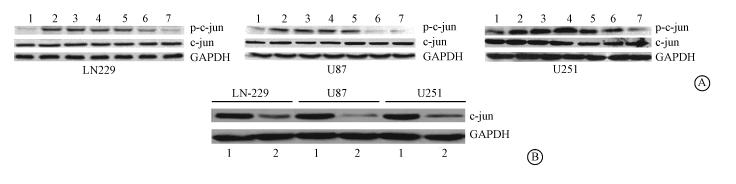 | 图 1 放射激活c-jun转录调控miR-221/222的表达。A. Western blot显示放射后LN229、U87及U251的p-c-jun与未磷酸化c-jun的表达水平(1.对照组;2.受照后5 min;3.受照后15 min;4.受照后30 min;5.受照后1 h;6.受照后3 h;7.受照后6 h); B. Western blot显示,c-junRNAi显著抑制了c-jun的表达(1.对照;2.c-junRNAi) |
4. miR-221/222不依赖PTEN调节pAkt的表达:生物信息学分析发现,PTEN是miR-221/222潜在的靶基因。Western blot结果显示,敲低miR-221/222后,除了U87 外其他细胞系中PTEN表达是增加的,而U87细胞系PTEN表达无变化(图 2A)。虫荧光素酶活性报告试验结果显示,共转染了反义miR-221/222和pGL3'-UTR PTEN 的胶质瘤细胞其荧光活性值为(121±21.056),反义miR-221、反义miR-222与pGL3'-UTR PTEN转染组荧光活性值分别为(66±12.165),(83±15.166),无义序列组荧光活性值为(56±10.235),反义miR-221/222和pGL3'-UTR PTEN共转染组明显高于无义序列组 (t=13.16,P<0.05)。证实PTEN 是miR-221/222的一个靶基因。PTEN能够通过抑制磷脂酰肌醇-3'激酶(PI3K)信号通路来抑制pAkt的表达[14]。而Akt通路与肿瘤的放射抗性机制相关[15]。通过生物信息学发现miR-221/222可通过非PTEN靶基因及PTEN靶基因调节pAkt表达。Western blot检测显示敲低LN229(野生型 PTEN)、U251 (突变型 PTEN)和U87 (无 PTEN)中miR-221/222表达后,pAkt表达均减少(图 2B),证实miR-221/222可调控pAkt的表达。上述结果表明,在恶性胶质瘤细胞中miR-221/222可通过PTEN或非PTEN靶基因调控pAkt的表达。
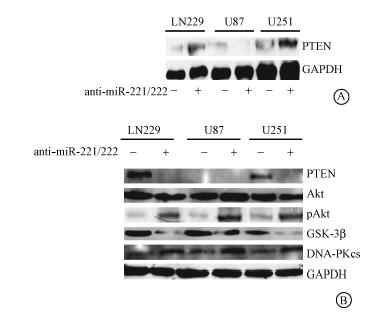 | 图 2 Weston blot 检测敲低miR-221/222后不同蛋白表达水平的电泳图A.敲低miR-221/222后PTEN的表达情况;B. 敲低miR-221/222后胶质瘤细胞内不同蛋白的表达 |
5. miR-221/222 通过激活Akt通路调节DDR:Western blot 结果显示,在3种细胞系中,miR-221/222转染组给于Akt siRNA处理后,Akt及pAkt的表达水平均显著下降(图 3),同时,平板克隆形成实验结果显示,在miR-221/222转染和Akt siRNA处理组经放射处理后,其存活率明显低于miR-221/222转染组与对照组,这说明下调Akt的表达后,miR-221/222过度表达并没有增加胶质瘤细胞的放射抗性。除此以外,使用LY294002 处理3种胶质瘤细胞系,Western blot 结果显示LY294002 明显抑制了pAkt 的表达(图 3),平板克隆形成实验结果显示miR-221/222过度表达并没有增加这3种细胞系的放射抗性。这表明miR-221/222通过激活Akt通路来调节 DDR。
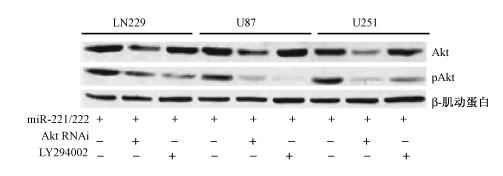 | 图 3 Western blot 显示Akt RNAi和LY294002明显抑制了胶质瘤细胞Akt 与pAkt的表达 |
6.体内实验:与对照组相比,反义miR-221/222共转染联合放射组胶质瘤的抑制效果最显著(F=56.36,P<0.05)。免疫组织化学检测结果显示,放射组pAkt与DNA-PKcs表达上调,GSK3β表达下调,反义miR-221/222共转染组PTEN与GSK3β表达上调,pAkt与DNA-PKcs表达下调(图 4)。Real-time PCR检测各组肿瘤组织中miR-221/222的水平,结果显示单纯放射组miR-221/222的水平明显升高,反义miR-221/222共转染组miR-221/222的水平则显著降低(t=19.00,P<0.05)。
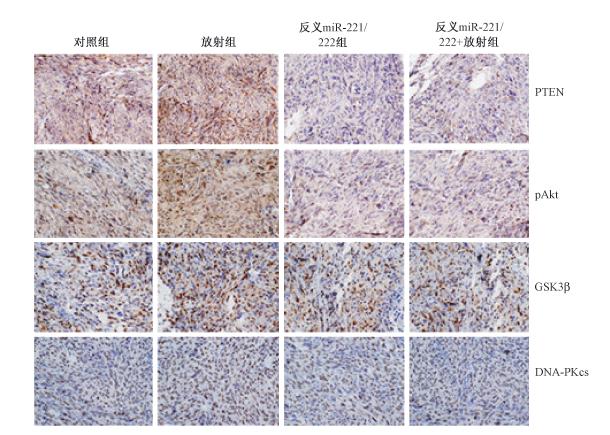 | 图 4 免疫组织化学显示各组中不同蛋白的表达SP法染色 ×200 |
研究发现,放射后数小时内肿瘤细胞内多种miRNA的表达发生变化[7, 8]。miRNA作为一种基因表达的转录后调节因子,可参与调控DDR[9]。笔者推测恶性胶质瘤的放射抗性可能与放射诱导的miRNA的异常表达有关。实验发现U251,U87及LN229细胞在受照后,miR-221和miR-222的表达上调,并且发现敲低胶质瘤细胞miR-221/222的表达后,放射敏感性显著提高。这表明miR-221/222与恶性胶质瘤细胞的放射抗性有关。
有研究指出放射可诱导c-jun激活[16],本实验中,Western blot检测胶质瘤细胞受照后不同时间点c-jun及p-c-jun的水平,发现p-c-jun 是在放射后5 min到1 h这个时间段内明显升高,而c-jun的水平无明显改变。已有文献报道c-jun转录调控miR-221和miR-222的表达[11, 17],染色质免疫共沉淀实验也证实了这一结论。此外,本研究通过c-jun RNAi抑制胶质瘤细胞c-jun的表达,结果显示c-jun表达受抑制后,U251、U87及LN229细胞miR-221与miR-222的表达水平均明显降低。上述结果表明放射诱导c-jun激活介导miR-221与miR-222的转录。在明确了放射如何诱导miR-221与miR-222的表达后,本研究进一步探讨miR-221与miR-222如何影响DDR。实验中通过虫荧光素酶活性报告试验本实验证实了PTEN 是miR-221/222的靶基因,然而 miRNA-221/222不仅增强了LN229 (PTEN野生型)细胞的放射抗性,也增强了U251 (PTEN突变型)和U87 (无PTEN)细胞的放射抗性,这表明miRNA-221/222不依赖PTEN 增强恶性胶质瘤细胞放射抗性。PTEN通过抑制PI3K信号通路来下调pAkt的表达[14],而Akt通路与肿瘤的放疗耐受机制相关[15]。生物信息学分析发现miR-221/222可通过PTEN及非PTEN靶基因调节pAkt表达,并且本实验中证实了miR-221/222可上调pAkt表达。分别通过Akt RNAi 和 LY294002抑制pAkt的表达,发现miR-221/222过度表达并没有增加胶质瘤细胞的放射抗性。这表明miR-221/222通过Akt通路调节DNA的损伤修复过程。有研究发现DNA-PKcs在DNA损伤修复及调控恶性胶质瘤细胞放射敏感性方面起重要作用[18,19]。生物信息学分析发现miR-221/222可通过PTEN及非PTEN靶基因调节pAkt表达,并且本实验中证实了miR-221/22。Western blot检测发现在敲低miR-221/222的胶质瘤细胞中,GSK3β表达上调而DNA-PKcs 表达下降,这表明miR-221/222下调了GSK3β表达而上调了DNA-PKcs 表达。以上实验结果表明,放射激活的c-jun介导了miR-221和miR-222转录,之后miR-221和miR-222通过PTEN或非PTEN的方式激活Akt来上调DNA-PKcs表达从而修复DNA损伤。 同时,体内实验的结果显示,敲低胶质瘤细胞miR-221/222的表达联合放射治疗可显著抑制胶质瘤的生长,免疫组织化学结果显示,放射后,胶质瘤细胞内pAkt与DNA-PKcs表达上调,GSK3β表达下调,反义miR-221/222共转染组结果与体外实验一致。Real-time PCR证实放射后胶质瘤细胞内miR-221/222的表达增加,进一步验证了体外实验的结论。
总之,本实验发现,miR-221和 miR-222在恶性胶质瘤细胞的放射抗性方面起着重要作用,并且探明了其增加胶质瘤细胞放射抗性的机制。这对于理解恶性胶质瘤的放射抗性,同时,以miR-221和miR-222作为靶点研发新的放射增敏药物具有重要意义。 此外,本实验探讨了DNA损伤修复的新的调控通路,即放射激活的转录因子转录某些直接或间接调控DNA损伤修复蛋白表达的miRNA及其相关通路。而这些 miRNA调控DNA损伤修复具体过程,还需要大量的基础研究来证实。
| [1] | Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol,2012,14 (Suppl 5): v1-49. |
| [2] | Ho J, Ondos J, Ning H, et al. Chemoirradiation for glioblastoma multiforme: the national cancer institute experience[J]. PLoS One, 2013, 8(8): e70745. |
| [3] | Van Meir EG, Hadjipanayis CG, Norden AD, et al. Exciting new advances in neuro-oncology: the avenue to a cure for malignant glioma[J]. CA Cancer J Clin, 2010, 60 (3): 166-193. |
| [4] | Wan G, Zhang X, Langley RR, et al. DNA-damage-induced nuclear export of precursor microRNAs is regulated by the ATM-AKT pathway[J]. Cell Rep, 2013, 3(6): 2100-2112. |
| [5] | Curtin NJ. DNA repair dysregulation from cancer driver to therapeutic target[J]. Nat Rev Cancer, 2012, 12 (12): 801-817. |
| [6] | Chaudhry MA, Sachdeva H, Omaruddin RA. Radiation-induced micro-RNA modulation in glioblastoma cells differing in DNA-repair pathways[J]. DNA Cell Biol, 2010, 29 (9): 553-561. |
| [7] | Niemoeller OM, Niyazi M, Corradini S, et al. MicroRNA expression profiles in human cancer cells after ionizing radiation[J]. Radiat Oncol, 2011, 6 (1): 29. |
| [8] | Wang Y, Taniguchi T. MicroRNAs and DNA damage response: implications for cancer therapy[J]. Cell Cycle, 2013, 12 (1): 32-42. |
| [9] | Zhang C, Kang C, Wang P, et al. MicroRNA-221 and -222 regulate radiation sensitivity by targeting the PTEN pathway[J]. Int J Radiat Oncol Biol Phys, 2011, 80(1): 240-248. |
| [10] | 康春生,浦佩玉,张志勇,等. 反义表皮生长因子受体RNA对U251胶质瘤细胞生长的抑制作用[J].中华实验外科杂志, 2006, 23(1):75-77. |
| [11] | Galardi S, Mercatelli N, Farace MG, et al. NF-κB and c-Jun induce the expression of the oncogenic miR-221 and miR-222 in prostate carcinoma and glioblastoma cells[J]. Nucleic Acids Res, 2011, 39 (9):3892-3902. |
| [12] | 张春智,康春生,杨卫东,等. 反义miR221/222上调p27kip1抑制胶质母细胞瘤U251细胞生长的体外研究[J]. 中华神经外科杂志, 2009, 25(2):128-131. |
| [13] | 孙梅珍,赵澎,王红云,等. 一种G422胶质母细胞瘤瘤株标准化动物模型的建立[J]. 中华实验外科杂志, 2006, 23(1):101-102. |
| [14] | Alam R, Schultz CR, Golembieski WA, et al. PTEN suppresses SPARC-induced pMAPKAPK2 and inhibits SPARC-induced Ser78 HSP27 phosphorylation in glioma[J]. Neuro Oncol,2013, 15 (4): 451-461. |
| [15] | Schuurbiers OCJ, Kaanders JH, van der Heijden HF, et al. The PI3-K/AKT-pathway and radiation resistance mechanisms in non-small cell lung cancer[J]. J Thorac Oncol, 2009, 4 (6) :761-767. |
| [16] | Deng Z, Sui G, Rosa PM, et al. Radiation-induced c-Jun activation depends on MEK1-ERK1/2 signaling pathway in microglial cells[J]. PLoS One, 2012, 7 (5): e36739. |
| [17] | Garofalo M, Di Leva G, Romano G, et al. miR-221&222 regulate TRAIL resistance and enhance tumorigenicity through PTEN and TIMP3 downregulation[J]. Cancer Cell,2009, 16 (6): 498-509. |
| [18] | Jiang N, Shen Y, Fei X, et al. Valosin-containing protein regulates the proteasome-mediated degradation of DNA-PKcs in glioma cells[J]. Cell Death Dis, 2013, 4 (5): e647. |
| [19] | Kang KB, Zhu C, Wong YL, et al. Gefitinib radiosensitizes stem-like glioma cells: inhibition of epidermal growth factor receptor-Akt-DNA-PK signaling, accompanied by inhibition of DNA double-strand break repair[J]. Int J Radiat Oncol Biol Phys, 2012, 83 (1): e43-52. |
 2015, Vol. 35
2015, Vol. 35