2. 南京医科大学附属常州市第二人民医院病理科;
3. 南京医科大学附属南京第一医院肿瘤外科
脂肪来源干细胞(ASCs)是由Zuk等[1]首次从脂肪抽吸物中分离得到的一种起源于中胚层的间质干细胞,具有自我更新与多向分化的潜能,并可作为组织工程学的种子细胞参与皮肤放射损伤的修复[2]。组织器官的纤维化是放射治疗最常见的损伤结果之一,其组织学改变包括成纤维细胞的过度增生和胶原纤维的沉积[3]。目前,国内外对于放射性纤维化的治疗以抗炎、高压氧舱、抗氧化剂等方法为主[4],少有见利用ASCs治疗骨骼肌放射性纤维化的报道。本研究通过骨骼肌放射损伤组织的ASCs局部移植治疗,分析ASCs移植对兔骨骼肌放射性纤维化的影响,为骨骼肌放射性损伤的修复寻找可能的途径。
1.实验动物及主要试剂:选用南京市青龙山实验动物公司提供的健康新西兰白兔 [许可证号SCXK(苏)2007-0008,合格证号0004282],雌雄各半。实验动物置于恒温、恒湿的动物房内分笼饲养,每日光照12 h。实验中对动物的处置符合动物伦理学标准。荧光标记抗体CD 90-FITC/IgG-FITC购自美国Abcam公司;荧光标记抗体IgG-RBITC/CD 34-RBITC/ CD 31-FITC及Rabbit Anti-TGFβ1购自北京博奥森公司;CM-Dil活细胞染色剂购自美国Invitrogen公司;EliVision plus试剂盒、DAB Kit购自福州迈新公司;全蛋白抽提试剂盒、SDS-PAGE凝胶电泳试剂盒、CL检测试剂盒、Western blot 检测试剂盒、Braford蛋白含量检测试剂盒购自南京凯基公司。
2.ASCs的分离和培养:取26周龄新西兰兔,体重(3000±500)g,经戊巴比妥钠麻醉后固定,切取腹股沟及颈背部皮下脂肪,用含有100 U/ml青霉素及链霉素的PBS液冲洗数次后充分剪碎,加入等体积0.1%的Ⅰ型胶原酶,37℃恒温条件下消化90 min,过滤,离心半径10 cm,1 500 r/min离心10 min,取上清,用含有10% FBS的DMEM培养基(美国GIBCO公司)重悬细胞并计数,以2×105/ml的密度将细胞接种于培养瓶。24 h后首次换液,以后每2~3天换液1次。待贴壁细胞生长达80%~90%融合时用0.25%胰蛋白酶消化后以1∶3传代。
3.ASCs的鉴定、标记和扩增:取第3代处于对数生长期的细胞,消化后制备细胞密度为1×106/ml的细胞悬液,利用与兔组织存在交叉反应的抗体进行CD31、CD34、CD90检测,所有单抗均设IgG同型对照。取第2代细胞,经消化、离心后利用PBS缓冲液重悬细胞,按照CM-Dil染色试剂说明书进行染色。标记后的ASCs置于避光环境下继续培养。
4.动物分组及照射方式:选取64只8周龄新西兰兔,雌雄不限,体重(1 500±250)g,采用随机数字表法随机分为ASCs组和PBS组,每组32只。参照文献[5]建立骨骼肌放射性损伤的模型,两组动物均经腹腔注射戊巴比妥钠麻醉后俯卧位固定,采用德国SIEMENS直线加速器9 MeV电子线对单侧臀部进行1次性80 Gy照射,源皮距100 cm,剂量率300 cGy/min,最大剂量深度约为2 cm,未照射一侧作为各组的正常对照。
5.ASCs移植及标本取材:照射后24 h,ASCs组照射部位局部肌肉注射1 ml含5×107经CM-Dil标记的ASCs的PBS悬液;PBS组照射部位局部肌肉注射1 ml PBS。各组局部照射后1、4、8和26周,各处死8只实验动物,取照射区域皮下约2 cm处肌肉组织3块,分别进行冰冻切片,观察ASCs植入骨骼肌后的分布及迁移情况,用10% 中性甲醛固定,常规包埋、切片,进行Masson染色及IHC染色和置于液氮中保存,以行Western blot检测。
6.Masson染色图像采集:每张Masson染色切片在高倍镜下(×200)选取5个视野,使用Image-Pro plus 6.0软件圈出Masson染色呈绿色的胶原纤维,测量胶原纤维面积及各视野中总细胞面积,计算各切片中胶原纤维占视野总面积的百分比。
7.IHC染色及图像采集:切片经过组织固定、脱蜡、水化、抗原修复后利用3%H2O2消除内源性超氧化物歧化酶,加山羊血清封闭抗原后滴加兔抗TGF-β1,37℃湿盒孵育2 h后PBS浸洗3次,滴加通用型IgG抗体-Fab段-HRP多聚体进行一抗二抗反应,加DAB溶液进行显色后苏木精复染,利用乙醇脱水后中性树胶封固。同时以PBS代替一抗作为阴性对照,以胞质染成棕黄色作为阳性判定标准。每张切片在高倍镜下(×200)选取5个视野,使用Imange-Pro plus 6.0图像分析软件行积分光密度(integral optical density,IOD)测量[6],评估TGF-β1的表达情况。
8.Western blot测定肌组织TGF-β1蛋白表达:取液氮中保存的肌肉组织约200mg制备组织匀浆后按照蛋白抽提试剂盒说明书进行蛋白提取,SDS-PAGE电泳分离出目的条带并转膜,利用5%脱脂牛奶封闭1.5 h后加入Rabbit Anti-TGFβ1,4℃孵育过夜,TBST清洗后加入相应二抗,室温下孵育1.5 h,TBST 漂洗3次后用ECL 法进行显影。
9.统计学处理:计量资料均以x ±s表示,实验结果采用SPSS 16.0统计学软件包进行分析,组间比较采用t检验,P<0.05为差异有统计学意义。
1.ASCs形态学观察:光镜下可见ASCs为梭形贴壁细胞,呈成纤维状,细胞核饱满居中(图 1A);进行CM-Dil标记后,细胞置于激发波长为553 nm的荧光显微镜下观察,可见细胞膜及胞质均呈现均匀的红色荧光,荧光形状与细胞形状基本一致,细胞核未染色(图 1B)。
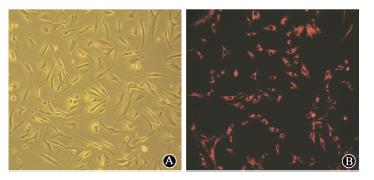 | 图 1 ASCs细胞形态A.倒置相差显微镜下观察 ASCs形态 未染色 ×100;B. 荧光显微镜下 CM-Dil标记后的ASCs形态 CM-Dil染色 ×100 |
2.ASCs细胞表面抗原检测:ASCs特异性抗原CD90呈高表达,阳性率93.1%,内皮细胞特异性抗原 CD31和造血干细胞特异性抗原 CD34呈低表达,阳性率分别为0.3%和0.2%。
3.CM-Dil标记示踪ASCs:正常对照组及PBS组骨骼肌冰冻切片中均未见荧光;ASCs组中见CM-Dil标记的ASCs呈红色荧光,随时间延长,标记的ASCs从针道向四周迁移,荧光强度逐渐减弱(图 2)。
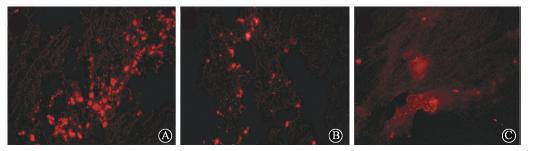 | 图 2 ASCs组骨骼肌ASCs的分布、迁移CM-Dil染色 ×200 A. 1周时,ASCs沿针道分布于骨骼肌中; B.4周时,ASCs在骨骼肌中弥散分布;C. 8周时,ASCs分布较前弥散,荧光强度衰减 |
4.骨骼肌中胶原纤维含量的变化:Masson染色中肌细胞胞质呈红色,胶原纤维呈蓝绿色。正常对照组肌纤维排列整齐、无明显肌细胞萎缩,肌细胞间有少量胶原纤维。照射后1周,ASCs组及PBS组中胶原纤维表达增加,照射后4、8和26周,ASCs组骨骼肌中胶原纤维占视野中总面积比例较PBS组降低,差异有统计学意义(t=4.615、5.994和10.477,P<0.05,图 3,表 1)。
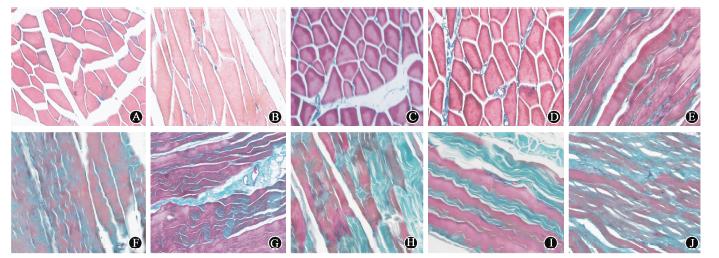 | 图 3 各组骨骼肌组织照射后不同时间纤维化程度的变化染色 ×200 A、B分别为正常对照组横切面及纵切面;1周时ASCs组(C)和PBS组(D)肌细胞稍肿胀,肌细胞间见少许胶原纤维增生;4周时ASCs组(E)与PBS组(F)相比骨骼肌细胞肿胀不明显,肌细胞间增生的胶原纤维较PBS组少;8周时ASCs组(G)与PBS组(H)比较,骨骼肌细胞变性、坏死,胶原纤维增生明显减少;26周时ASCs组(I)较PBS组(J)肌细胞坏死明显减少,增生的胶原纤维中见较多的残存骨骼肌细胞 |
| 表 1 各组照射后不同时间骨骼肌组织中胶原纤维占总面积的比值(x ±s) |
5.IHC测定骨骼肌组织中TGF-β1变化:TGF-β1主要表达于骨骼肌细胞质内,阳性表达呈棕黄色,正常组织中TGF-β1较少表达。照射后1周, [LL]ASCs组及PBS组TGF-β1的IOD值较正常对照组升高,照射后4、8和26周,ASCs组肌肉组织中TGF-β1的IOD值低于PBS组(t=3.787、16.454和15.171,P <0.05,图 4,表 2)。
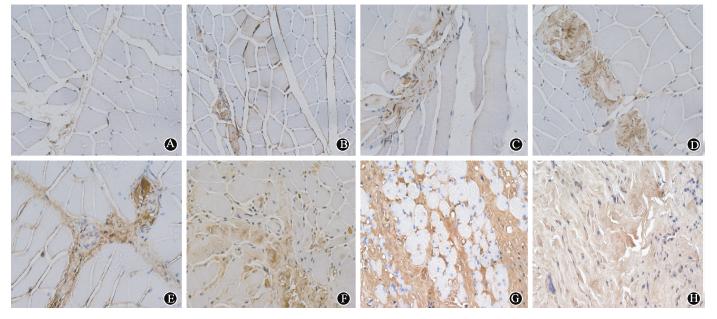 | 图 4 各组骨骼肌组织照射后不同时间TGF-β1的变化IHC染色×200 1周时ASCs组(A)与PBS组(B)肌组织中TGF-β1无明显表达;ASCs组4周(C)、8周(E)和26周(G)TGF-β1表达逐渐增强,但仍分别弱于同时间点PBS组4周(D)、8周(F)和26周(H)TGF-β1表达 |
| 表 2 各组骨骼肌组织照射后不同时间TGF-β1的IOD值变化(x ±s) |
6.ASCs移植对放射损伤骨骼肌组织中TGF-β1蛋白表达的影响:Western blot检测结果显示,ASCs组肌组织中TGF-β1蛋白表达水平在1、4、8和26周较PBS组有降低趋势,见图 5。
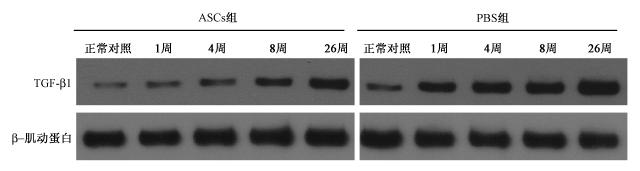 | 图 5 Western blot 检测照射后不同时间各组骨骼肌组织中 TGF-β1 蛋白表达 |
肿瘤患者接受放射治疗后可出现正常组织的放射损伤。骨骼肌放射损伤可导致患者出现张口困难[7]、吞咽障碍甚至大便失禁等症状影响患者生活质量[8, 9]。Tedla等[8]给予患者喉部60~66 Gy照射后仅发现受照射组织中肌肉纤维含量减少,与未照射组相比胶原纤维含量未见明显改变。Hsu等[10]发现,给予鼠腓肠肌80 Gy照射发生骨骼肌放射性损伤,肌肉纤维之间胶原纤维增生明显。本研究中,单次照射80 Gy后随着时间的延长,ASCs组及PBS组骨骼肌组织中胶原纤维不断增加,表明高剂量照射能导致骨骼肌发生放射性纤维化。
目前临床上常用的物理疗法和手术疗法治疗放射损伤均不理想[4]。近年来随着组织工程学的发展,间质干细胞的应用为治疗放射性损伤提供新的思路。在一系列间质干细胞中,ASCs具有组织来源丰富、易于取得、取材过程损伤较小、获取效率高等优势[11],正获得越来越多的关注。目前已证实,ASCs移植对治疗肝硬化、特发性肺纤维化有一定的效果[12, 13],Kojima等[14]证实ASCs能减轻放射性唾液腺损伤,Akita等[2]研究表明ASCs能促进放射性皮肤损伤的修复。本研究成功提取兔ASCs,并发现照射后24 h ASCs移植能减轻肌组织纤维化程度,表明早期给予ASCs干预能减轻骨骼肌放射性纤维化,减轻骨骼肌放射性损伤。
虽然放射性纤维化的机制尚不明确,但相关研究表明TGF-β1在多种组织器官放射性纤维化过程中起到了关键作用[15],在骨骼肌的纤维化级联反应中,TGF-β1能够下调肌原蛋白的表达、启动骨骼肌纤维化相关蛋白的形成[16],此外,在促进大量细胞外基质沉积的同时诱导成纤维细胞向成肌纤维细胞分化,进一步增加胶原纤维和细胞外基质的生成,加重纤维化[17]。多项研究表明,在接受照射的皮肤[18]、咀嚼肌[19]、肝脏[20]等组织中均可检测到明显升高的TGF-β1蛋白表达,并且升高程度与纤维化的程度相关[20]。在本研究中,PBS组受照射后骨骼肌组织中胶原纤维逐渐增加,肌组织中TGF-β1蛋白表达随照射后时间的延长逐渐增强,提示高剂量照射后骨骼肌放射性纤维化与TGF-β1升高相关。Yang等[21]研究发现,ASCs能够通过降低受损心肌组织中TGF-β1的表达保护受损心肌。本研究中,Western blot结果示1周时,ASCs组TGF-β1的表达低于PBS组,但IHC结果显示1周时两组见未见明显差异,考虑与两种检测方法的灵敏度不同有关;4周开始Western blot 及IHC检测均发现ASCs组骨骼肌组织中TGF-β1的表达明显低于PBS组,表明ASCs能降低放射损伤骨骼肌组织中TGF-β1蛋白的表达,结合两组骨骼肌组织中胶原纤维的含量变化,提示ASCs可通过抑制组织中TGF-β1的表达,减轻骨骼肌放射性纤维化。
综上所述,ASCs局部移植能减轻骨骼肌组织放射性纤维化,这可能与ASCs抑制放射损伤骨骼肌组织中TGF-β1的表达有关,具体机制有待于进一步研究。
| [1] | Zuk PA, Zhu M, Ashjian P, et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295. |
| [2] | Akita S, Akino K, Hirano A, et al.Noncultured autologous adipose-derived stem cells therapy for chronic radiation injury[J].Stem Cells Int,2010,2010:532704. |
| [3] | Rodemann HP, Bamberg M. Cellular basis of radiation-induced fibrosis[J].Radiother Oncol,1995,35(2):83-90. |
| [4] | Delanian S,Lefaix JL.Current management for late normal tissue injury: radiation-induced fibrosis and necrosis[J].Semin Radiat Oncol,2007,17(2):99-107. |
| [5] | 孙威, 倪新初,孙苏平.高剂量照射兔骨骼肌放射损伤的超微病理研究[J].中华放射医学与防护杂志,2012,32(6):593-596. |
| [6] | Guo JH, Lou WH, Ji Y, et al.Effect of CCR7, CXCR4 and VEGF-C on the lymph node metastasis of human pancreatic ductal adenocarcinoma[J].Oncol Lett,2013,5(5):1572-1578. |
| [7] | Gokhale AS, McLaughlin BT, Flickinger JC, et al.Clinical and dosimetric factors associated with a prolonged feeding tube requirement in patients treated with chemoradiotherapy (CRT) for head and neck cancers[J].Ann Oncol,2010,21(1):145-151. |
| [8] | Tedla M, Valach M, Carrau RL, et al.Impact of radiotherapy on laryngeal intrinsic muscles[J].Eur Arch Otorhinolaryngol,2012,269(3):953-958. |
| [9] | Smeenk RJ, Hoffmann AL, Hopman WP, et al.Dose-effect relationships for individual pelvic floor muscles and anorectal complaints after prostate radiotherapy[J].Int J Radiat Oncol Biol Phys,2011,83(2):636-644. |
| [10] | Hsu HY, Chai CY,Lee MS.Radiation-induced muscle damage in rats after fractionated high-dose irradiation[J].Radiat Res,1998,149(5):482-486. |
| [11] | Albersen M, Kendirci M, Van der Aa F, et al.Multipotent stromal cell therapy for cavernous nerve injury-induced erectile dysfunction[J].J Sex Med,2012,9(2):385-403. |
| [12] | Seki A, Sakai Y, Komura T, et al.Adipose tissue-derived stem cells as a regenerative therapy for a mouse steatohepatitis-induced cirrhosis model[J].Hepatology,2013,58(3):1133-1142. |
| [13] | Tzouvelekis A, Paspaliaris V, Koliakos G, et al.A prospective, non-randomized, no placebo-controlled, phase Ib clinical trial to study the safety of the adipose derived stromal cells-stromal vascular fraction in idiopathic pulmonary fibrosis[J].J Transl Med,2013,11:171. |
| [14] | Kojima T, Kanemaru S, Hirano S, et al.Regeneration of radiation damaged salivary glands with adipose-derived stromal cells[J].Laryngoscope,2011,121(9):1864-1869. |
| [15] | Pohlers D, Brenmoehl J, Loffler I, et al.TGF-beta1 and fibrosis in different organs-molecular pathway imprints[J].Biochim Biophys Acta,2009,1792(8):746-756. |
| [16] | Li Y, Foster W, Deasy BM, et al.Transforming growth factor-beta1 induces the differentiation of myogenic cells into fibrotic cells in injured skeletal muscle: a key event in muscle fibrogenesis[J].Am J Pathol,2004,164(3):1007-1019. |
| [17] | Smith CA, Stauber F, Waters C, et al.Transforming growth factor-beta following skeletal muscle strain injury in rats[J].J Appl Physiol,2007,102(2):755-761. |
| [18] | Martin M, Lefaix JL, Pinton P, et al.Temporal modulation of TGF-beta 1 and beta-actin gene expression in pig skin and muscular fibrosis after ionizing radiation[J].Radiat Res,1993,134(1):63-70. |
| [19] | 沈宗泽,郑建金,贾暮云,等.放射性咀嚼肌损伤模型软组织病理改变及转化生长因子β1的表达[J].中国组织工程研究与临床康复,2011,15(15):2842-2846. |
| [20] | Anscher MS, Crocker IR,Jirtle RL.Transforming growth factor-beta 1 expression in irradiated liver[J].Radiat Res,1990,122(1):77-85. |
| [21] | Yang JJ, Zhang HX, Zhao L, et al.Human adipose tissue-derived stem cells protect impaired cardiomyocytes from hypoxia/reoxygenation injury through hypoxia-induced paracrine mechanism[J].Cell Biochem Funct,2012,30(6):505-514. |
 2015, Vol. 35
2015, Vol. 35