2. 武汉市第一医院ICU室
放疗是治疗食管癌主要的、有效的、安全的手段之一,但是食管癌放疗效果仍不尽如人意[1]。因此,增加放射敏感性是改善放射治疗效果的关键。
自噬是一种进化上高度保守的分解代谢途径,以胞质内出现双层膜结构包裹蛋白和细胞器的自噬体为特征的细胞"自我消化"的一系列生化过程,是细胞克服不利压力环境的"权宜"之举。目前有报道,在某些肿瘤细胞中抑制自噬能增加放射敏感性[2],但自噬和食管癌放射治疗之间联系的报道还很少[3]。因此,本研究以食管鳞癌细胞Eca-109为研究对象,选取自噬抑制剂3-甲基腺嘌呤抑制自噬体的形成,探讨了3-甲基腺嘌呤增强食管癌放射敏感性的作用和分子机制,现报道如下。
1.细胞培养及放疗方式:人食管鳞癌Eca-109细胞株购自中国典型培养物保藏中心。Eca-109细胞培养采用含10%小牛血清的RPMI1640培养液(美国GIBCO公司),培养于37℃、5%CO2的培养箱,用0.25%胰酶消化传代,取对数生长期的细胞用于实验。实验中照射细胞采用6 MV(瑞典,Elekta PRECISE)X射线照射,源靶距=100 cm,剂量率400 cGy/min,照射剂量6 Gy。
2.主要试剂:自噬抑制剂3-甲基腺嘌呤购自美国Sigma-Aldrich公司;微管相关蛋白1轻链3B(LC3B)兔抗人一抗和HRP羊抗兔二抗购自美国CST公司;Annexin V-FITC 凋亡试剂盒购自美国eBioscience公司;Hoechst33342染液购自北京索莱宝公司;质粒pBABEpuro GFP-LC3购自美国addgene公司;转染试剂盒MACSfectin Reagent购自德国Miltenyi公司。
3.实验分组:实验分为对照组,5 mmol/L给药组,10 mmol/L 给药组,单纯照射组,照射+5 mmol/L组,照射+10 mmol/L组。3-甲基腺嘌呤在照射前1 h加入,6 Gy照射结束24 h后收集细胞。
4.Western blot检测自噬标志物LC3B表达水平:以LC3B亚型LC3BⅡ的蛋白表达以及LC3BⅡ和其未被酯化的LC3BⅠ的比值(LC3BⅡ/LC3BⅠ)作为观察食管癌细胞Eca-109自噬水平的指标。Eca-109细胞2×105个在6孔板中培养24 h后,经不同处理后收集,加入裂解液100 μl,4℃,离心半径5.5 cm,12 000 r/min离心5 min取上清,BCA法蛋白定量。各组样品取25 μg,经12%SDS-PAGE电泳,300 mA湿转1 h至0.22 μmPVDF膜,封闭1 h,LC3B一抗1∶1 000稀释后4℃孵育过夜,TBST洗3次,每次5 min后,HRP二抗孵育1 h。BIO-RAD凝胶成像系统成像,IMAGE J软件进行灰度分析。
5.细胞转染:质粒抽提参照TaKaRa 试剂盒方法。取5 ml培养菌液,离心半径5.5 cm,12 000 r/min离心2 min,弃上清后,按照步骤洗脱质粒DNA到EP管中,经分光光度计测纯度A260/A280=1.8~2.0后,用SnaBI进行酶切,经1%琼脂糖凝胶电泳后,在紫外线下鉴定。按照转染试剂盒MACSfectin Reagent的步骤进行转染。将3 μgGFP-LC3 质粒与6 μl MACSfectin分别溶于100 μl无血清的DMEM 培养液中,将以上两种液体轻轻混匀后加入每孔中,总体系为2 ml,置于标准培养条件下。24 h后在倒置荧光显微镜下观察转染效率,之后用嘌呤霉素筛选。转染成功后按照实验分组进行处理,24 h后倒置荧光显微镜观察自噬体的形成。使用IMAGE J软件计数绿色荧光斑点,细胞中超过10个荧光斑点为阳性细胞,100个细胞中阳性细胞数代表自噬水平。
6.MTT法检测细胞活力:将对数期细胞接种于96孔培养板中(200 μl/孔),贴壁24 h后按照实验分组(对照组、5 mmol/L给药组、10 mmol/L给药组、单纯照射组、照射+5 mmol/L组、照射+10 mmol/L组)进行处理,每组设8个复孔,处理后24 h,加入5 g/LMTT 20 μl,37℃继续孵育4 h后弃上清终止培养;每孔加入DMSO 150 μl,振荡10 min,待甲臜完全溶解后,用酶标仪测定490 nm处的吸光度(A)值,计算各组细胞活力。细胞存活率=(实验组平均A490值/对照组平均A490值)×100%。
7.细胞凋亡形态学观察:将对数生长期的细胞接种于6孔板,细胞贴壁24 h后按照实验分组(对照组、5 mmol/L给药组、10 mmol/L给药组、单纯照射组、照射+5 mmol/L组、照射+10 mmol/L组)进行处理,处理后24 h,加入1 ml Hoechst33342染液,37℃继续孵育30 min后用PBS洗两次,置荧光显微镜下观察细胞核形态。
8.流式细胞术检测细胞周期和细胞凋亡:将对数期细胞接种于6孔板中,待细胞贴壁24 h后按照实验分组(对照组、5 mmol/L给药组、10 mmol/L给药组、单纯照射组、照射+5 mmol/L组、照射+10 mmol/L组)进行处理,处理后24 h用0.25% 胰蛋白酶消化,收集细胞,PBS洗涤离心后吹打成单细胞悬液,控制细胞数在1×106/ml。对于细胞凋亡检测,收集的细胞重悬于200 μl 结合缓冲液中,加入 5 μl AnnexinV-FITC 混匀,室温避光孵育15 min后,再加入5μl PI,室温避光孵育 5 min,立即上流式细胞仪检测细胞凋亡率。对于细胞周期检测,收集的细胞用70%的乙醇固定,4℃过夜,离心半径5.5 cm,1 000 r/min,离心5 min,去上清后,沉淀物重悬于1 mlPI染液(50 μl/ml)中,孵育后上流式细胞仪检测细胞周期。分别通过ModFitLT和CellQuest software软件分析细胞周期和细胞凋亡的结果。
9.克隆形成实验:取对数生长期的细胞,用6孔板接种,每孔接种2×105细胞,用琼脂糖凝胶培养,分为3组(Eca-109细胞组、含5 mmol/L 3-甲基腺嘌呤Eca-109细胞组,含10 mmol/L 3-甲基腺嘌呤Eca-109细胞组),用6 MV X射线照射,照射剂量分别为1、2、4和6 Gy,每组3个样本,照射后培养14 d,出现肉眼可见的克隆,终止培养。弃去上清液,PBS浸洗两次。加4%多聚甲醛固定细胞5 mmol/L固定15 min然后去固定液,加适量姬姆萨染色液染10~30 min,然后用流水缓慢洗去染色液,在显微镜下计数大于50个细胞的克隆数。以每次实验的0 Gy组计算克隆形成率。克隆形成率=(克隆数/接种细胞数)×100%。存活分数(SF)=照射后细胞形成的克隆数/(接种细胞数×未照射细胞克隆形成率)。在SigmaPlot 12软件中使用线性二次模型计算放射生物学参数并拟合剂量存活曲线。
10.统计学处理:用SPSS 17.0统计软件对结果进行单因素方差分析,实验结果用x ±s表示,各组之间差异的两两比较用LSD检验。P<0.05为差异有统计学意义。
[JP+1] 1.自噬抑制后自噬标志物LC3B的表达水平:Western blot结果显示,照射前对照组、5 mmol/L给药组和10 mmol/L给药组食管癌Eca-109细胞自噬水平均低;照射后LC3BⅡ的水平及LC3BⅡ/LC3BI比值均明显升高,两组比较差异有统计学意义(F=109.21,P<0.05),说明辐照可以诱导自噬水平升高;照射+5 mmol/L组和照射+10 mmol/L组与单纯照射组比较,差异有统计学意义(F=37.34、25.64,P<0.05),说明3-甲基腺嘌呤有效的抑制了放疗诱导的自噬,而且照射+10 mmol/L组比照射+5 mmol/L组下降更明显,呈剂量依赖性,更进一步说明3-甲基腺嘌呤可以有效抑制自噬(图 1,表 1)。
| 表 1 各组细胞的LC3BⅡ/LC3BI比值、G2/M期、存活率及凋亡率的变化(%,x ±s) |
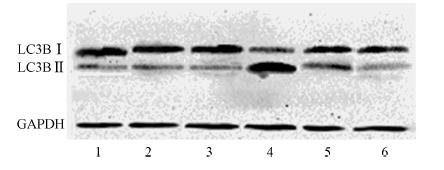 | 图 1 Western blot法检测不同处理组LC3BⅠ和LC3BⅡ的表达1.对照组; 2. 5 mmol/L给药组; 3. 10 mmol/L给药组; 4. 单纯照射组; 5. 照射+5 mmol/L组; 6. 照射+10 mmol/L组 |
2.GFP-LC3转染后监测自噬体数量变化:根据不同处理组自噬体的荧光图,计数自噬阳性细胞。结果显示,与对照组比较,单纯照射组GFP荧光斑点明显增多,对照组自噬阳性细胞率为(5±0.5)%,单纯照射组为(22±1)%,两组比较差异有统计学意义(F=134.71,P<0.05),说明放疗诱导自噬体增多;,与单纯照射组相比,照射+5 mmol/L组和照射+10 mmol/L组的GFP荧光斑点明显减少,照射+5 mmol/L组自噬阳性细胞率为(7±0.7)%,与单纯照射组比较差异有统计学意义(F=112.49,P<0.05);照射+10 mmol/L组自噬阳性细胞率为(3±0.4)%,与单纯照射组比较差异有统计学意义(F=127.36,P<0.05),而且照射+10 mmol/L组与照射+5 mmol/L组比较,照射+10 mmol/L组自噬体减少更明显,差异有统计学意义(F=132.75,P<0.05),更进一步证明3-甲基腺嘌呤有效抑制了放疗诱导的自噬。
3.MTT法检测细胞增殖与存活情况:结果显示,与对照组比较,5 mmol/L给药组和10 mmol/L给药组存活率差异无统计学意义,说明3-甲基腺嘌呤对细胞毒性很小,不影响细胞的增殖;单纯照射组和照射+5 mmol/L组存活率比较差异有统计学意义(F=101.28,P<0.05);照射+10 mmol/L组存活率(10.7±5)%,与单纯照射组相比差异有统计学意义(F=129.54,P<0.05),见表 1。并且3-甲基腺嘌呤浓度越高,存活率越低,说明3-甲基腺嘌呤协同放疗明显抑制肿瘤细胞活力,促进细胞死亡。
4. 抑制自噬后食管癌细胞Eca-109流式细胞术凋亡检测:Annexin V-FITC/PI 双染结果显示,对照组、5 mmol/L给药组和10 mmol/L给药组,总凋亡率比较差异无统计学意义,进一步证明3-甲基腺嘌呤对细胞毒性很小。单纯照射组,照射+5 mmol/L组和照射+10 mmol/L组总凋亡率增加,且3-甲基腺嘌呤高浓度组总凋亡率也最高,是单纯照射组凋亡率的2.38倍,差异有统计学意义(F=110.29,P<0.05),见表 1。不论早期凋亡还是晚期凋亡,在3-甲基腺嘌呤协同放疗时凋亡率都增加,且3-甲基腺嘌呤浓度越高凋亡率越高,进一步证明放疗时抑制自噬可明显增加肿瘤细胞凋亡。
5.抑制自噬后食管癌细胞Eca-109细胞周期检测:通过流式细胞仪检测3-甲基腺嘌呤抑制自噬后食管癌Eca-109细胞周期变化。结果显示,加入3-甲基腺嘌呤或放疗后G2/M期阻滞细胞增多。照射+5 mmol/L组G2/M期细胞比是(28.81±2.5)%,与单纯照射组比较,差异有统计学意义(F=86.19,P<0.05);照射+10 mmol/L组G2/M期细胞比是(38.77±1.3)%,与单纯照射组比较,差异有统计学意义(F=74.76,P<0.05);说明抑制自噬后,G2/M期阻滞更明显,其被阻滞细胞是单纯照射组2~3倍。
6. 抑制自噬后食管癌细胞Eca-109凋亡形态学检测:通过hoechst染色凋亡小体检测细胞凋亡情况。结果显示,倒置荧光显微镜观察,对照组染色质分布均匀,紫外光下显蓝色荧光,而单纯照射组,照射+5 mmol/L组和照射+10 mmol/L组的细胞呈现出明显强于对照组的颗粒状蓝色荧光,细胞核致密浓染,有的呈碎块状,出现凋亡小体,且随3-甲基腺嘌呤浓度增加,凋亡小体数量也增多(图 2)。
 | 图 2 不同处理组食管癌细胞Eca-109凋亡形态学检测 ×40A.对照组;B.5 mmol/L给药组; C.10 mmol/L给药组;D.单纯照射组;E.照射+5 mmol/L组;F.照射+10 mmol/L组 |
7.克隆形成实验拟合剂量存活曲线:为了评估抑制自噬对食管癌细胞Eca-109的放射增敏效果,使用线性二次模型拟合剂量存活曲线,并计算平均致死剂量(D0)和2 Gy照射的细胞存活分数(SF2)。结果显示,单纯照射组,照射+5 mmol/L组和照射+10 mmol/L组D0值分别为(2.75±0.26)Gy,(2.19±0.18)Gy和(1.6±0.05)Gy,抑制自噬后D0值下降明显;SF2值分别为(61±5)%,(48±4)%和(38±5)%,抑制自噬后 SF2值下降明显。3-甲基腺嘌呤联合照射作用于食管鳞癌细胞,存活分数下降,而且3-甲基腺嘌呤浓度越高,下降越明显(图 3)。与单纯照射组相比,3-甲基腺嘌呤处理后照射增加了食管鳞癌细胞Eca-109的放射敏感性,证明了抑制自噬能增加食管鳞癌细胞的放射敏感性。
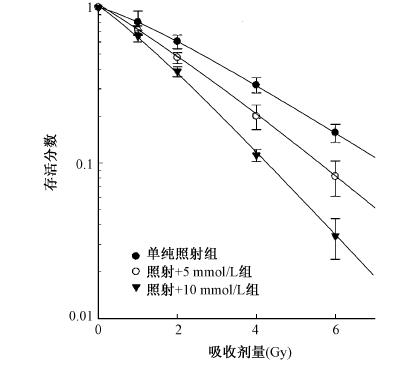 | 图 3 单纯照射与不同浓度3-甲基腺嘌呤处理后照射食管鳞癌细胞Eca-109的剂量存活曲线 |
自噬在肿瘤治疗中的作用充满争议[4, 5]。Qu等[6]报道,自噬相关基因的缺乏能促进肿瘤形成,肿瘤增殖加速。例如自噬相关基因beclin-1在小鼠中敲除,会增加小鼠肺癌、肝癌、淋巴瘤的发生率[7],暗示自噬可以抑制肿瘤的发生和发展。然而,近来的研究显示自噬可以清除毒素,降解多余的、损伤的蛋白和细胞器,并且提供的前体,如氨基酸、脂肪酸和核苷酸等,能被再循环合成新的大分子,提供肿瘤细胞营养[8, 9]。因此自噬能保护肿瘤细胞,促进肿瘤细胞存活,并且与肿瘤耐药和治疗抗拒有重要的关系。
虽然Liang等[10]报道耐药的卵巢癌细胞SKVCR放射治疗时联合自噬抑制能提高癌细胞放疗的杀伤力,而且Apel等[11]也报道通过干扰RNA抑制自噬基因的表达,增加了放射抗拒细胞的放疗不良反应,提高了其放射敏感性,但是自噬在食管癌放射治疗中作用的研究还很少。自噬发生标志性形态学改变是自噬泡的形成,而自噬体的特异性标记蛋白——微管相关蛋白1轻链蛋白3(MAP1LC3)是自噬泡主要的组成蛋白。LC3经过翻译后修饰形成主要位于细胞质的LC3I和主要位于体和自噬溶酶体膜上的 LC3Ⅱ。Karim等[12]发现通过检测细胞内LC3Ⅱ的表达量和LC3Ⅱ/LC3I比值,可以判断其自噬是被诱导还是被抑制,而且LC3B是LC3家族中最能反映细胞自噬水平的分子标志物[13]。但此方法只能通过蛋白表达间接反映自噬水平,为了进一步直接反映自噬体的变化,本研究把GFP-LC3转染进食管癌细胞,通过GFP的荧光斑点数量体现细胞的自噬水平,直接监测其自噬体变化。GFP结合于LC3的N端,正常状态下GFP-LC3位于细胞质,自噬激活后结合于自噬体膜上,此时GFP荧光可显示自噬体,通过计数GFP荧光斑点反映自噬体变化,这更清楚反映了自噬水平,而且可以动态观察自噬体变化。本研究显示,照射时食管癌Eca-109细胞自噬的LC3蛋白表达增加,LC3BⅡ/LC3BI比值增大,自噬体数量增多,表明照射可以诱导自噬;而用3-甲基腺嘌呤抑制自噬后,LC3蛋白表达减少,LC3BⅡ/LC3BI比值减小,自噬体数量也减少,表明自噬能被有效抑制。自噬被有效抑制后,照射诱导的食管癌Eca-109细胞存活率下降,远低于单纯照射组,这提示自噬能保护食管癌细胞在放疗环境下存活,而抑制自噬协同照射能更有效的杀伤食管癌细胞。
自噬与凋亡之间有着复杂的联系。有研究证明,自噬抑制后能增强肿瘤细胞的凋亡。Boya等[14]报道营养缺乏条件下的乳腺癌细胞进行自噬抑制后,细胞的死亡方式主要是凋亡;Amaravadi等[15]也报道了在淋巴瘤模型中,自噬的抑制增强了治疗诱导的凋亡。本研究也显示,自噬有助于肿瘤细胞的存活,而抑制自噬协同放疗后细胞凋亡率增加。放疗诱导肿瘤细胞死亡的主要方式是凋亡,而抑制自噬增加了这种凋亡率,促进了肿瘤细胞的大量死亡。本研究还进一步探索发现,照射6 Gy组的G2/M期阻滞明显高于对照组,而且抑制自噬协同放疗后食管鳞癌Eca-109细胞G2/M期阻滞更加明显,这提示抑制自噬增加食管癌细胞凋亡的可能机制之一是更有效的形成细胞G2/M期阻滞。G2/M期阻滞后,细胞会进入凋亡模式。
放射生物学理论认为,射线照射后尚存活的细胞更值得关注,只有那些失去增殖能力并且无法形成有效克隆的细胞才不会引起肿瘤复发。本研究中克隆形成实验证实了抑制自噬与放疗有明显的协同作用,同单纯放疗相比,肿瘤细胞平均致死剂量和存活分数明显下降,抑制自噬能有效的提高食管癌细胞Eca-109的放射敏感性。
综上所述,抑制自噬能提高食管鳞癌细胞的放射敏感性,协同杀伤肿瘤细胞,这为提高食管癌放射治疗效果提供了新思路,但还有待于进一步的动物实验和临床实验进行验证。
| [1] | Siegel R, Naishadham D,Jemal A. Cancer statistics 2012 [J]. CA Cancer J Clin, 2012, 62(1):10-29. |
| [2] | Tseng HC, Liu WS, Tyan YS, et al. Sensitizing effect of 3-methyladenine on radiation-induced cytotoxicity in radio-resistant HepG2 cells in vitro and in tumor xenografts [J]. Chem Biol Interact, 2011, 192(3):201-208. |
| [3] | White E. Deconvoluting the context-dependent role for autophagy in cancer [J]. Nat Rev Cancer, 2012, 12(6):401-410. |
| [4] | Yang ZJ, Chee CE, Huang S, et al. The role of autophagy in cancer: therapeutic implications [J]. Mol Cancer Ther, 2011, 10(9):1533-1541. |
| [5] | Wu WK, Coffelt SB, Cho CH, et al. The autophagic paradox in cancer therapy [J]. Oncogene, 2012, 31(8):939-953. |
| [6] | Qu X, Yu J, Bhagat G, et al. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene [J]. J Clin Invest, 2003, 112(12):1809-1820. |
| [7] | Yue Z, Jin S, Yang C, et al. Beclin 1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor [J]. Proc Natl Acad Sci USA, 2003, 100(25):15077-15082. |
| [8] | Mah LY, Ryan KM. Autophagy and cancer [J]. Cold Spring Harb Perspect Biol, 2012, 4(1):a008821. |
| [9] | Maycotte P, Aryal S, Cummings CT, et al. Chloroquine sensitizes breast cancer cells to chemotherapy independent of autophagy [J]. Autophagy, 2012, 8(2):200-212. |
| [10] | Liang B, Kong D, Liu Y, et al. Autophagy inhibition plays the synergetic killing roles with radiation in the multi-drug resistant SKVCR ovarian cancer cells [J]. Radiat Oncol, 2012, 7:213. |
| [11] | Apel A, Herr I, Schwarz H, et al. Blocked autophagy sensitizes resistant carcinoma cells to radiation therapy [J]. Cancer Res, 2008, 68(5):1485-1494. |
| [12] | Karim MR, Kanazawa T, Daigaku Y, et al. Cytosolic LC3 ratio as a sensitive index of macroautophagy in isolated rat hepatocytes and H4-Ⅱ-E cells [J]. Autophagy, 2007, 3(6):553-560. |
| [13] | Barth S, Glick D,Macleod KF. Autophagy: assays and artifacts [J]. J Pathol, 2010, 221(2):117-124. |
| [14] | Boya P, Gonzalez-Polo RA, Casares N, et al. Inhibition of macroautophagy triggers apoptosis [J]. Mol Cell Biol, 2005, 25(3):1025-1040. |
| [15] | Amaravadi RK, Yu D, Lum JJ, et al. Autophagy inhibition enhances therapy-induced apoptosis in a Myc-induced model of lymphoma [J]. J Clin Invest, 2007, 117(2):326-336. |
 2015, Vol. 35
2015, Vol. 35