1. 试剂及仪器:DMEM细胞培养基(美国Hyclone公司)、胎牛血清(美国GIBCO公司)、磷酸盐缓冲液(PBS,美国HyClone公司),细胞增殖及细胞毒性检测试剂盒(cell counting kit-8,日本Dojindo公司),一抗兔抗人anti-phospho-Histone H2AX(美国Epitomics公司),二抗Alexa Fluor 488标记山羊抗兔、二抗辣根过氧化物酶标记山羊抗兔、DAPI(江苏碧云天生物技术研究所),高速双转盘活细胞共聚焦成像系统(型号UltraView Vox,美国PerkinElmer公司),流式细胞仪(型号FACSVerse,美国BD公司)。
2. 细胞培养:人脐静脉血管内皮细胞,本实验室保存。细胞培养于含10%胎牛血清的DMEM培养基。于37℃、5%CO2培养箱中培养。选择对数生长期细胞进行实验。
3. 照射条件:苏州九龙医院,西门子直线加速器(德国)6 MV X射线垂直照射,剂量率为2 Gy/min,源靶距100 cm,照射野10 cm×10 cm。
4. 筛选合适的工作浓度:取对数期生长的细胞,胰酶消化,吹打均匀,制备单细胞悬液,调整细胞浓度,以每孔2 000个细胞接种于96孔板,设立调零孔(不接种细胞)。实验中每个组别设5个复孔。常规培养24 h待细胞贴壁,弃培养基,PBS漂洗,加入0、1.25、2.5、5.0、6.25、12.5 mg/ml硫酸镁细胞培养液100 μl,不同浓度药液以含10%的胎牛血清的DEME培养基稀释。细胞培养1、2、3 d后弃培养基,加入100 μl含1/10 CCK-8的培养基(1∶9),37℃培养3 h,用酶标仪检测450 nm处的吸光度(A)值,重复实验3次,取平均值。并根据以下公式统计细胞存活率:细胞存活率(%)=(加药组A值-调零孔A值)/(未加药组A值-调零孔A值)×100%。
5. 实验分组:实验分空白对照组、单纯照射组、照射加药组。空白对照组为含10%的胎牛血清的DMEM培养基处理,单纯照射组为单纯照射4 Gy,加药组为细胞预先用 1.25 mg/ml硫酸镁细胞培养液培养0.5 h后再照射4 Gy。
6. 硫酸镁对照后HUVEC存活率的影响:取对数期生长的细胞,调整细胞浓度,以每孔2 000个细胞接种于96孔板,设立调零孔(不接种细胞)。常规培养24 h待细胞贴壁,照前0.5 h弃培养基,PBS漂洗,加入100 μl终浓度为1.25 mg/ml的硫酸镁细胞培养液。细胞培养1、2、3 d后弃培养基,加入100 μl含1/10 CCK-8的培养基(体积比为1∶9),37℃培养3 h,用酶标仪检测450 nm处的吸光度(A)值,重复实验3次,取平均值。并根据以下公式统计细胞存活率:[JP3]细胞存活率(%)=(实验组A值-调零孔A值)/(空白对照组A值-调零孔A值)×100%。
7. 细胞免疫荧光染色:取处于对数生长期的细胞,制成悬液混合均匀后置于有盖玻片的6孔板内,37℃、5%CO2培养箱中培养24 h,照前0.5 h弃培养基,PBS漂洗,加入1.25 mg/ml MgSO4细胞培养液继续培养,在规定时间内收集细胞,PBS快速洗2次,3.7%多聚甲醛固定15 min;PBS洗3次,每次5 min,加入事先预冷的1%Triton X-100,4℃15 min;PBS洗3次,每次5 min,加入封闭液(1%Triton X-100,5%BSA),室温1 h;加入一抗(1∶1 000)4 ℃过夜;PBS洗4次,每次5 min,加入Alexa Fluor标记的二抗,暗室室温孵育1 h;PBS洗4次,每次5 min,避光以DAPI复染细胞核,5 min;PBS洗3次,每次5 min,以抗荧光淬灭封片液封片,用指甲油周围封片。激光共聚焦显微镜成像,放大倍数为100倍,将每个时间点的细胞截留几个视野,使各个时间点的细胞总数>100个,人工计数γ-H2AX的焦点(foci)个数(foci取舍标准为肉眼可辨的绿色颗粒,并且在细胞核内)。
8.流式细胞术检测:X射线照射细胞后规定时间收集细胞,PBS洗2次,加入1%多聚甲醛100 μl,摇匀,室温静置15 min;PBS洗2次,离心弃上清,加入事先预冷的1%Triton X-100,4℃ 5 min;加入50 μl的一抗,4℃ 45 min;PBS洗2次,离心弃上清,加入Alexa Fluor标记的二抗50 μl,4℃ 45 min;PBS洗2次,离心弃上清,加入0.5 ml PBS,混匀,用流式细胞仪检测荧光强度,并根据以下公式统计相对荧光强度:相对荧光强度(%)=实验组荧光强度/空白对照组荧光强度×100%。
9. Western blot检测:照射后收样,将样品置于冰上,提取细胞总蛋白,取各组等量蛋白进行SDS-PAGE电泳并转膜,5%BSA封闭1 h后加入一抗(1∶1 000)4℃摇床过夜,二抗为辣根过氧化物酶标记山羊抗兔(1∶1 000),用超敏ECL化学发光试剂盒检测蛋白表达。
10. 统计学处理:数据采用x ±s表示,利用SPSS 19.0统计学软件,组间差异采用t检验进行比较。P<0.05为差异有统计学意义。
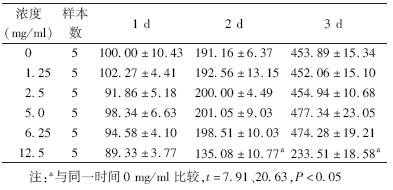
1. 筛选合适的工作浓度:硫酸镁作用细胞1、2、3 d后细胞存活情况见表 1。1.25~6.25 mg/ml浓度范围内的硫酸镁对HUVEC细胞生长无明显影响。但是当硫酸镁浓度升高至12.5 mg/ml时,作用细胞2、3 d后,HUVEC细胞存活率与不加药组相比明显下降(t=7.91、20.63,P<0.05),提示12.5 mg/ml及以上浓度对HUVEC细胞有毒性作用,不适于实验。后续实验选用无毒性作用的低浓度硫酸镁即1.25 mg/ml作为干预措施来观察硫酸镁对HUVEC是否具有保护作用。
| 表 1 不同浓度硫酸镁作用后不同时间对HUVEC细胞存活率的影响(%,x ±s) |
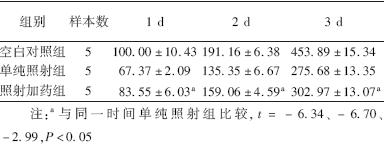
2.硫酸镁对照后HUVEC存活率的影响:1.25 mg/ml硫酸镁作用于受照细胞后HUVEC存活情况见表 2。1.25 mg/ml浓度的硫酸镁在照后1、2、3 d均能提高照后细胞的存活率(t=-6.34、-6.70、-2.99,P<0.05)。
| 表 2 1.25 mg/ml硫酸镁对照后不同时间HUVEC细胞存活率的影响(x ±s) |
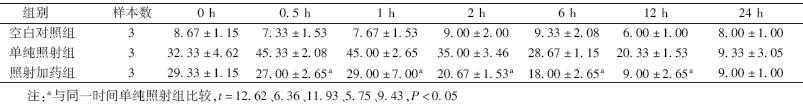
3.激光共聚焦显微镜检测γ-H2AX foci的形成:HUVEC经X射线照射后即有foci的形成,并在0.5~1 h 达到高峰,且0.5与1 h所测的foci数差异无统计学意义(P>0.05),在照后24 h foci数回到基线水平;与单纯照射组相比,照射加药组在照后0.5、1、2、6、12 h foci形成数降低,差异有统计学意义(t=12.62、6.36、11.93、5.75、9.43,P<0.05),见表 3。
| 表 3 4 Gy照射后不同时间细胞核内γ-H2AX foci形成数比较(个/细胞,x ±s) |
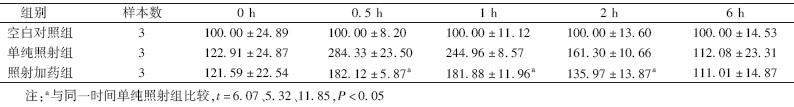
4.流式细胞仪检测γ-H2AX表达情况:照射后0.5 h γ-H2AX表达量即增加,且随时间逐渐降低,在照后6 h回到空白对照组水平。与单纯照射组相比,照射加药组的γ-H2AX表达量均降低(表 4),其中,照后0.5、1、2 h差异有统计学意义(t=6.07、5.32、11.85,P<0.05)。
5.Western blot检测γ-H2AX蛋白表达:为了验证前两种方法检测出的结果,继续采用Western blot方法对照后HUVEC的γ-H2AX蛋白表达量进行检测,结果显示,使用了硫酸镁的照射加药组γ-H2AX蛋白表达量较单纯照射组明显降低,见图 1。
| 表 4 X射线照射后不同时间各组细胞γ-H2AX表达相对荧光值(%,x ±s) |
 | 图 1 硫酸镁对照后不同时间HUVEC γ-H2AX蛋白表达的影响 |
近年来,镁离子以其安全有效的特点成为神经科学研究的热点之一,及时补充镁剂不仅能对脑外伤、急性缺血缺氧脑病、急性代谢性脑功能障碍等方面起保护作用,对放射性脑损伤也有某些方面的改善作用。前期实验证明,早期应用硫酸镁可以减轻脑组织钙超载[2]、抑制脂质过氧化[3]、阻断神经炎症[4]、维持神经细胞正常代谢[5]。本实验证明,1.25 mg/ml硫酸镁能够降低X射线引起的foci数的增加,减少γ-H2AX蛋白的表达。对DNA损伤进一步研究发现,该过程还可以激活ERK途径,引起细胞凋亡等[6],而应用硫酸镁则可以抑制ERK的激活[7]。射线引起H2AX的磷酸化主要是通过ATM催化[8],应用硫酸镁是否可以阻断ATM的磷酸化仍有待继续研究。
血管内皮细胞能敏感地感知血流动力、炎性分子以及血液循环中激素水平的变化,可以对各种刺激做出反应,对维持机体内环境稳定具有重要作用。研究照后内皮细胞的变化对于探究放射性脑损伤的机制至关重要,实验证明,硫酸镁能够提高照后人脐静脉血管内皮细胞的存活率,缓解细胞G2/M期阻滞,改善辐射诱发的细胞损伤[9]。
辐射引起DNA损伤后,H2AX可以迅速磷酸化并且在DSB处簇集,形成焦点(foci),这一过程在照后几分钟就已经开始[10]。γ-H2AX形成焦点的数量与DNA双链断裂数量存在对应关系[11],这也是选用计数焦点数来观测DNA损伤程度的依据。γ-H2AX形成焦点后,募集损伤修复相关蛋白如BRCA1、53BP1和MDC1等,协同定位于DSBs处进行修复[12]。
[JP+1] 目前,检测γ-H2AX主要通过3种方法:细胞免疫荧光染色、免疫荧光流式细胞术以及Western blot,由于检测灵敏度较高,操作步骤简便,细胞免疫荧光染色和免疫荧光流式细胞术这两种方法应用比较普遍。本实验通过以上3种方法研究硫酸镁对细胞DNA损伤修复的影响,并对比不同方法在实验结果、操作难易方面的差异,为研究γ-H2AX表达提供更加丰富的实验基础。与激光共聚焦和Western blot方法得出结论不同,流式细胞术显示在照后0 h单纯照射组与空白对照组差异无统计学意义,分析原因可能是激光共聚焦显微镜和Western blot检测γ-H2AX的灵敏度高于流式细胞术。
综上所述,硫酸镁可以减轻射线引起的γ-H2AX的表达,表明硫酸镁可以减轻射线引起DNA的双链断裂。DSB的形成可以促使下游蛋白(如H2AX)磷酸化、乙酰化,激活细胞内NF-κB通路[13],而硫酸镁很可能是通过下调NF-κB的表达,来实现降低γ-H2AX的表达。
| [1] | Shrivastav M,De Haro LP,Nickoloff JA.Regulation of DNA double-strand break repair pathway choice[J].Cell Res,2008,18(1):134-147. |
| [2] | 涂彧,周菊英,王利利.MgSO4对大鼠急性放射性脑损伤后钙超载的抑制作用[J].中华放射医学与防护杂志,2005,25(4):339-341. |
| [3] | 王利利,涂或,周菊英,等.硫酸镁对大鼠急性放射性脑损伤后脂质过氧化的抑制作用[J].国际放射医学核医学分册,2007,31(1):37-39. |
| [4] | 张玮,涂彧,王利利,等.MgSO4对放射性脑损伤大鼠脑组织早期炎症反应的影响[J].辐射研究与辐射工艺学报,2009,27(4):234-238. |
| [5] | 周菊英,涂或,王利利,等.MgSO4对大鼠急性放射性脑损伤后NSE和S-100蛋白表达的影响[J].中华放射医学与防护杂志,2007,27(5):421-424. |
| [6] | Tang D,Wu D,Hirao A,et al.ERK activation mediates cell cycle arrest and apoptosis after DNA damage independently of p53[J].J Biol Chem,2002,277(15):12710-12717. |
| [7] | Enomoto T,Osugi T,Satoh H,et al.Pre-Injury magnesium treatment prevents traumatic brain injury-induced hippocampal ERK activation, neuronal loss, and cognitive dysfunction in the radial-arm maze test[J].J Neurotrauma,2005,22(7):783-792. |
| [8] | Stiff T,O'Driscoll M,Rief N,et al. ATM and DNA-PK function redundantly to phosphorylata H2AX after exposure to ionizing radiation[J].Cancer Res,2004,64(7):2390-2396. |
| [9] | 封士成,崔凤梅,涂彧.硫酸镁对人脐静脉血管内皮细胞辐射防护的作用[J].辐射研究与辐射工艺学报,2014,32(2):23-27. |
| [10] | Rogakou EP,Pilch DR,Orr AH,et al.DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139[J].J Biol Chem,1998,273(10):5858-5868. |
| [11] | Rothkamm K,Lbrich M.Evidence for a lack of DNA double-strand break repair in human cells exposed to very low X-ray doses[J].Proc Natl Acad Sci USA,2003,100(9):5057-5062. |
| [12] | Goldberg M,Stucki M,Falck J,et al.MDC1 is required for the intra-S-phase DNA damage checkpoint[J].Nature,2003,421(6926):952-956. |
| [13] | Harper JW,Elledge SJ.The DNA damage response: ten years after[J].Mol Cell,2007,28(5):739-745. |
 2015, Vol. 35
2015, Vol. 35