2. 中日友好医院放射治疗科;
3. 中国医学科学院肿瘤医院放疗科
放射性粒子组织间植入近距离放疗作为治疗头颈部涎腺恶性肿瘤的一种方法,具有局部控制率高、微创、不良反应小的优点,目前已在腮腺、颌下腺、舌下腺等大唾液腺及口腔内小唾液腺恶性肿瘤的治疗中得到应用[1, 2, 3]。使用125I放射性粒子进行近距离放疗,具有剂量分布高度适形的优点,可提高肿瘤内照射剂量,而周围正常组织受照剂量很小[4]。单独使用125I放射性粒子植入治疗涎腺恶性肿瘤及治疗术后残存肿瘤组织的设计剂量为100~160 Gy[1, 5]。文献报道,腮腺恶性肿瘤术后辅助125I粒子植入放疗的设计剂量为60~80 Gy[2, 5, 6],应用125I粒子永久植入治疗头颈部涎腺恶性肿瘤的剂量范围为50~160 Gy,且相对集中在较高剂量范围120~160 Gy[7, 8]。目前尚缺乏针对舌下腺恶性肿瘤的放射剂量分布的研究。临床上对于125I放射性粒子治疗的剂量数据主要依靠治疗计划系统计算获得。为了获得组织吸收剂量的真实数据,本研究利用头颈部仿生模型,将125I放射性粒子置入,使用热释光剂量计测量口底靶区的剂量分布,为临床治疗舌下腺恶性肿瘤提供客观依据。
1. 实验材料:头颈部仿生人体模型由四川大学人机工程及医疗设备研究所提供,采用国际辐射单位与测量委员会(International Commission on Radiation Units and Measurements,ICRU) 44 号报告规定的全能谱人体组织等效材料。LiF(Mg,Cu,P)热释光剂量计(TLD),由中国医学科学院肿瘤医院提供,圆形,直径3 mm,厚度0.2 mm。BR2000D-ⅢC型热释光剂量读出器由北京博创特科技发展有限公司生产,依据个人和环境监测用热释光剂量测量系统,Philip X射线浅层治疗机(型号Hilips Metalix)由中国医学科学院肿瘤医院提供。125I放射性粒子6711型(国药准字H20045969,直径0.8 mm,长4.5 mm,镍钛合金壳)由北京原子高科股份有限公司提供,粒子活度为29.6、25.9 MBq/粒2种,半衰期为59.4 d。 计算机三维治疗计划系统(treating planning system,TPS)由北京天航科霖科技发展有限公司提供。辐射自显影胶片(Gafchromic EBT)由北京中日友好医院提供,36 cm×43 cm,剂量范围1~800 cGy。
2. TLD能量响应和剂量标定:对TLD进行编号,在同一批探测器中,简单随机抽样法抽取8枚,1枚为测量本底用,另外7枚用Philip X射线浅层治疗机进行照射,照射剂量分别为85、170、255、345、525、700、875 cGy。然后,用BR2000D-ⅢC型热释光剂量读出器进行读数。通过SPSS 12.0软件进行分析,得出BR2000D-ⅢC型热释光剂量读出器读数y与LiF(Mg,Cu,P)吸收剂量x的线性相关关系,即y=a+bx。
3.125I放射性粒子布源:体模行螺旋CT(美国GE公司,64排螺旋CT)扫描,并将CT影像资料导入TPS。模拟左侧舌下腺肿瘤的近距离放疗,利用TPS在CT图像上勾勒出左侧口底的区域为靶区,靶区以左下颌骨内侧边缘为前外界,下颌中切牙与舌系带连线及延长线所对应的中线为内界,咽腔前壁为后界。左侧下颌升支内侧区域被勾画为第2靶区。
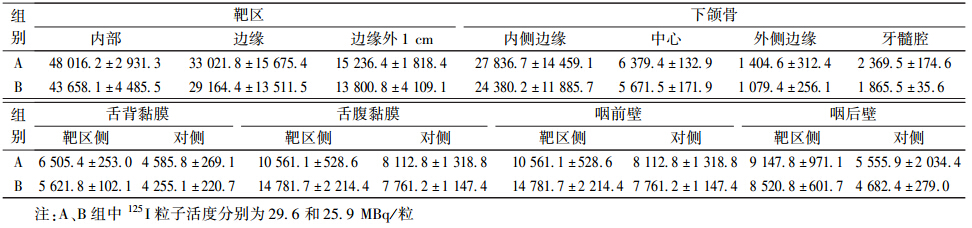
在靶区内进行125I放射性粒子的布源,将粒子等距平行排列,粒子各层间距及粒子之间间距1 cm,共设计植入125I 粒子31粒,计划处方剂量(即匹配周缘剂量)120 Gy。 利用TPS计算靶区内剂量分布、D100、D90、剂量体积直方图(DVH)和适形度等指标。将125I粒子置于体模内设计的相应位置。根据临床常用的放射性粒子活度,分别选择29.6、25.9 MBq/粒的2种活度的125I放射性粒子,分为A组、B组置入体模。放射性粒子放置位置如图 1。
 | 注:箭头所示为放射性粒子位置,圆点为热释光图 1 放射性粒子位置示意图 |
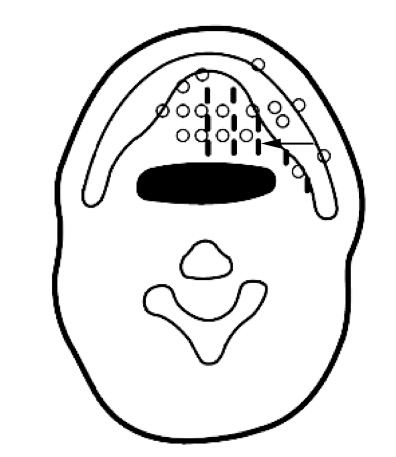
4.放置热释光探测器及EBT胶片:本研究选择靶区内部4点、靶区边缘4点、靶区外1 cm(软组织范围)4点;靶区侧下颌骨体部中心2点、外侧3点;咽腔前后壁共9个点;靶区侧下颌磨牙牙髓腔2点;舌背与舌腹黏膜各6个点;患侧下颌升支内侧1点;颌下区皮肤共5个点。放置共46个热释光剂量探测器于上述这些位置,具体见图 2。放射性粒子与热释光探测器的位置关系见图 1。
 | 图 2 左侧舌下腺恶性肿瘤热释光探测器放置示意图 左侧口底为靶区,A.箭头示靶区内部TLD放置点、箭头左侧为靶区边缘、靶区外1 cmTLD放置点,体模下颌骨处可见靶区侧下颌骨体部中心、外侧TLD放置点,所示体模层面放置EBT胶片; B.舌腹黏膜TLD放置点; C.舌背黏膜TLD放置点 |
全部实验装置置于独立隔离空间内,于第1天取出EBT胶片,扫描绘制剂量分布曲线。于1.5、4.5、9.5 d分批取出热释光探测器。利用BR2000D-ⅢC型热释光剂量读数器读取热释光探测器读数,由热释光探测器读数y与其接受剂量x之间线性回归方程y=a+bx计算出相应时间内实际吸收剂量x=(y-a)/b。 根据125I粒子的衰减规律,经过时间t照射后的累积剂量Dc(t)应为:
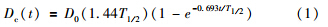
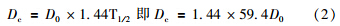
不同热释光探测器在其测量时间t内的吸收剂量x即为Dc(t),可求出D0。计算出125I放射性粒子近距离治疗结束时,各个热释光探测器的吸收剂量Dc。
5. 统计学处理:结果采用x±s形式表示。采用SPSS 12.0软件进行分析。对热释光探测器读数与其接受剂量进行线性回归分析。P<0.05为差异有统计学意义。
1. 热释光探测器的响应和标定结果:对管电压为45 kV的X射线,BR2000D-ⅢC型热释光剂量读出器读出数据y,与热释光探测器接受剂量值x(cGy),线性回归方程为y=2 165.9x(R2=0.997 2,t=80.51,P<0.01),认为热释光剂量探测器读数与其所接收剂量呈线性关系。
2. 体模靶区及周围组织的125I粒子剂量分布:各个测量点所吸收的剂量,具体数据见表 1。A组中125I粒子活度为29.6 MBq/粒、B组中125I粒子活度为25.9 MBq/粒。
患侧下颌骨升支内侧测量点的剂量,A组为7 813 cGy,B组为7 802 cGy。靶区侧颌下区皮肤各个测量点的剂量,A组为2 664.5~8 030.9 cGy,B组为2 524.6~8 115.4 cGy。从颌后区至颏下区由后向前剂量递减。
| 表 1 靶区内部及周围组织测量点的剂量值(cGy,x±s) |
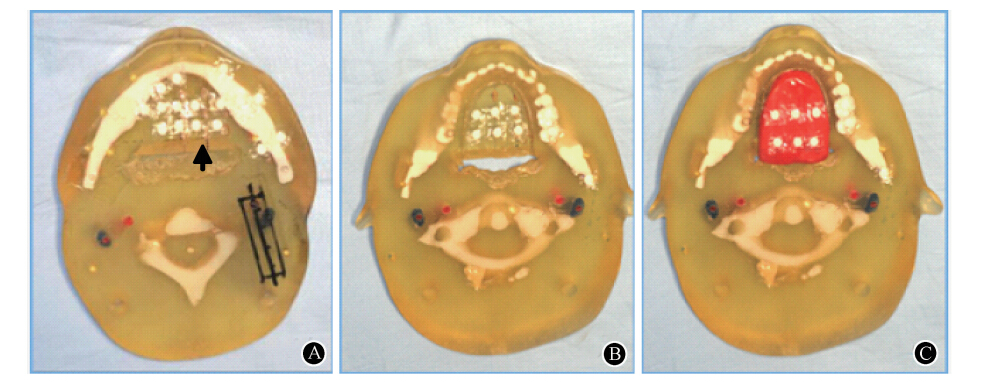
3. 体模靶区内的125I粒子剂量分布曲线:依据EBT胶片成像的灰度值不同,绘制靶区内部及周边组织的等剂量曲线,灰度值越大,颜色越深,代表吸收剂量越大。图 3中,80%等剂量线的左侧边缘,约为靶区内部边缘范围,其内部为术前计划所勾画的靶区范围。60%等剂量线的下方及右侧边缘,约为靶区前外侧边缘,即下颌骨内侧边缘。下颌骨的外侧边缘约位于10%等剂量线的外侧。
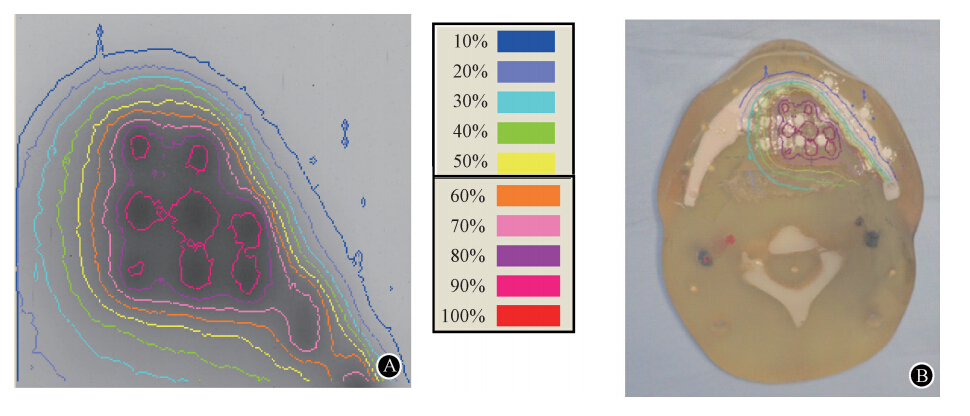 | 图 3 靶区内部选取的单个平行层面靶区剂量曲线分布图 A. 等剂量曲线;B. 等剂量曲线与体模的位置关系 |
对于原发于舌下腺的恶性肿瘤,目前仍以手术切除原发灶为主要治疗手段。切除范围应根据肿瘤大小和病理性质决定[9]。肿瘤扩大切除的范围常包括口底组织、部分舌体、舌神经、舌下神经和部分下颌骨。使用125I放射性粒子永久植入的方式作为唾液腺恶性肿瘤的术后放疗,可以控制手术后的残余病灶,以提高局部控制率[10]。
125I放射性粒子治疗恶性肿瘤,其靶区及周围正常组织的受照剂量直接与粒子源的分布和距离相关,局部的剂量分布是保证疗效的关键因素。在TPS下设计粒子源的植入位置,准确合理地布放每颗放射性粒子源,是临床评价近距离治疗肿瘤剂量分布的前提。
本研究利用的头颈部仿生模型,真实地反映了中国人的参数体征及多个不同解剖器官在体模中的真实分布,仿生模型使用的放射等效材料,其特征谱线对剂量能谱的干扰与人体组织的等效误差<3%,不均匀性误差<1.5%[11]。采用TLD及EBT胶片测量靶区及周围组织的实际125I放射性粒子剂量分布(组织的吸收剂量),为临床治疗提供客观依据。此种标定方法已在体模上进行过验证试验,被证明是可靠的,测量相对准确[12, 13]。
结合TLD测得的数据可以看出,靶区内部、靶区边缘、靶区外1 cm的放射剂量依次递减。周围组织剂量明显低于靶区中心剂量,这与放射性粒子治疗剂量和放射源距离的平方呈反比的分布特点相符合。靶区中心、靶区边缘范围的剂量在135.46 Gy以上,达到了临床设计要求(匹配周缘剂量为120 Gy),靶区内部粒子所在位置的剂量较高,最高可达496 Gy,这与TPS计算值基本一致。靶区边缘外1.0 cm范围的剂量在101.53 Gy以上,剂量随距离增大则迅速下降,低于处方剂量。EBT胶片所描绘的剂量分布图也显示,在靶区范围内的剂量分布无放射冷点存在。而周围组织的剂量分布迅速下降为靶区内最大剂量的20%~60%,减小了正常组织所受到的剂量。放射性粒子治疗这一剂量学特点,可以在不增加正常组织损伤的前提下,给予肿瘤组织高剂量的照射。
舌下腺恶性肿瘤中,腺样囊性癌最为常见[9, 14, 15]。由于腺样囊性癌具有沿神经转移的特点[16],舌下腺的腺样囊性癌易沿舌神经侵犯至颅底及颅内。舌神经沿下颌骨内斜线向后上至下颌骨升支内侧的翼外肌走形,由卵圆孔与颅内相连,在神经走形分布区域勾画附加靶区,并设计植入125I放射性粒子,局部的剂量可达78 Gy,达到预防性放疗剂量,减少了因舌神经受侵的复发因素。
实验中,靶区的前外侧边缘即紧邻下颌骨内侧边缘的位置同样处于高剂量分布区,放射剂量达130 Gy以上,高于处方剂量。临床上常可见舌下腺肿物紧贴下颌骨边缘,或与下颌骨内侧缘粘连,手术切除肿瘤后通过125I粒子组织间近距离治疗可以使下颌骨内侧边缘达到放疗的处方剂量,提高局部控制率,减少肿瘤术后复发,可以不必行下颌骨截骨手术,体现了现代手术治疗中功能外科和微创外科的理念。但125I粒子源所释放的射线在软组织中的射程仅为1.7 cm,而骨组织的密度要明显高于软组织,低能γ射线对其穿透力更低。在下颌骨中心与下颌骨外侧边缘的剂量迅速降低,下颌骨中心的剂量为55~65 Gy左右,下颌骨外侧边缘仅为8~15 Gy,远低于处方剂量,因此大大减小了放射性骨髓炎的概率。同时也可以推断,利用125I粒子组织间近距离放疗不能达到对下颌骨病变有效的放疗。
靶区周围的咽腔黏膜、舌黏膜所接受的放射剂量不均等。舌腹黏膜由于邻近靶区,所受剂量患侧为100~170 Gy,健侧为88~95 Gy。舌背黏膜所受剂量为40~68 Gy。经典外照射情况常采用最小的损伤剂量(TD5/5)及最大的损伤剂量(TD50/5)评价正常组织的耐受程度。TD5/5和TD50/5分别为在所有用标准治疗条件的肿瘤患者中,治疗后5年,因放射治疗造成严重放射损伤的患者不超过5%和50%的剂量。口腔黏膜的TD5/5值为60 Gy,TD50/5值为75 Gy[17]。本研究中,舌体接受的剂量高于正常黏膜组织能耐受的最大剂量。患者在接受治疗后可自觉疼痛等不适,黏膜充血,口底黏膜也可见瘢痕化或纤维化的发展过程。口咽部黏膜所接受的剂量为45~150 Gy,尤以患侧口咽前壁黏膜所受的剂量最大,患者可能会感觉咽干不适。但由于组织间近距离照射为长期低剂量率持续照射,给予了正常组织更多的修复时间,降低了放射性损伤。
综上所述,125I放射性粒子组织间植入治疗口底区舌下腺恶性肿瘤,可以最大限度地提高靶区内剂量值,同时减少对周围组织的放射剂量。因为照射模式的特点,下颌骨接受的放射剂量较小,减少了放射性骨损伤的概率。
| [1] | 张杰,郑磊,黄明伟,等. 放射性粒子组织间植入治疗口腔颌面-头颈部腺源性恶性肿瘤近期疗效分析[J]. 北京大学学报(医学版), 2011, 43(2):272-275. |
| [2] | Zhang J, Zhang JG, Song TL, et al. 125I seed implant brachytherapy-assisted surgery with preservation of the facial nerve for treatment of malignant parotid gland tumors[J]. Int J Oral Maxillofac Surg, 2008, 37(6):515-520. |
| [3] | Glaser MG, Leslie MD, Coles I, et al. Iodine seeds in the treatment of slowly proliferating tumours in the head and neck region[J]. Clin Oncol (R Coll Radiol),1995,7(2):106-109. |
| [4] | Brenner DJ. Radiation biology in brachytherapy[J]. J Surg Oncol, 1997, 65(1): 66-70. |
| [5] | 张杰,张建国,蔡志刚,等. 放射性粒子组织间植入近距离治疗腮腺复发癌初步报告[J]. 中华口腔医学杂志, 2009, 44(1):2-4. |
| [6] | 张建国,张杰,宋铁砾,等. 125I放射性粒子组织间植入治疗面神经受侵的腮腺恶性肿瘤初步临床观察[J]. 中华口腔医学杂志, 2008, 43(3):132-135. |
| [7] | Stannard CE, Hering E, Hough J, et al. Post-operative treatment of malignant salivary gland tumours of the palate with iodine-125 brachytherapy[J]. Radiother Oncol, 2004, 73(3):307-311. |
| [8] | Le QT, Birdwell S, Terris DJ, et al. Postoperative irradiation of minor salivary gland malignancies of the head and neck[J]. Radiother Oncol, 1999, 52(2):165-171. |
| [9] | Spiro RH. Treating tumors of the sublingual glands, including a useful technique for repair of the floor of the mouth after resection[J]. Am J Surg,1995,170(5):457-460. |
| [10] | Vikram B, Mishra S. Permanent iodine-125 implants in postoperative radiotherapy for head and neck cancer with positive surgical margins[J]. Head Neck,1994,16(2):155-157. |
| [11] | 林大全,宋锦平,王远萍,等. 调强放射治疗头-颈部仿生模型及临床应用[J]. 中国医学物理学杂志, 2003, 20(2):75-77. |
| [12] | Johansson B,Persson E,Westman G, et al. Phantom study of radiation doses outside the target volume brachytherapy versus external radiotherapy of early breast cancer[J]. Radiother Oncol, 2003, 69(1):107-112. |
| [13] | Gambarini G, Borroni M, Grisotto S, et al. Solid state TL detectors for in vivo dosimetry in brachytherapy[J]. Appl Radiat Isot, 2012, 71(Suppl):48-51. |
| [14] | Eveson JW, Cawson RA. Salivary gland tumors. A review of 2410 cases with particular reference to histological types, site, age and sex distribution[J]. J Pathol, 1985, 146(1):51-58. |
| [15] | Anderson JN Jr, Beenken SW, Crowe R, et al. Prognostic factors in minor salivary gland cancer[J]. Head Neck,1995,17(6):480-486. |
| [16] | Andersen LJ, Therkildsen MH, Ockelmann HH, et al. Malignant epithelial tumors in the minor salivary glands, the submandibular gland, and the sublingual gland. Prognostic factors and treatment results[J]. Cancer,1991,68(11):2431-2437. |
| [17] | 殷蔚伯, 谷铣之. 肿瘤放射治疗学[M]. 3版. 北京: 中国协和医科大学出版社, 2002:307-315. |
 2015, Vol. 35
2015, Vol. 35