调强放疗技术已广泛应用于临床,能有效地保证靶区的剂量分布并保护危及器官[1]。靶区和危及器官的勾画工作费时费力,在勾画过程中,同样的器官,不同医师的勾画结果不同[2],且自适应放疗(ART)过程需要快速、准确地勾画轮廓。因此,越来越多的研究聚焦于危及器官甚至靶区的自动勾画工作[3, 4, 5]。一些基于图谱库自动勾画靶区危及器官的软件应运而生,如瑞典医科达公司的ABAS软件、美国瓦里安公司的Velocity软件及美国MIM公司的MIM软件等。国内外有文献报道了该方面的研究,文献研究显示这些软件对头颈部自动勾画器官准确性高,勾画时间少,且可降低勾画误差[6, 7],但关于宫颈癌器官勾画的研究少有报道。本研究探讨ABAS系统在宫颈癌器官勾画中的应用。
1. 患者资料:选取2014年1—3月本院收治的宫颈癌患者21例。中位年龄54岁(43~70岁),Ⅱa期1例,Ⅱb期7例,Ⅲa期4例,Ⅲb期8例,Ⅳa期1例。所有患者术前都是采用综合性治疗。
2. ABAS软件:瑞典Elekta公司产品,版本2.01。非刚性的形变自动勾画轮廓工具,要求至少有1组已勾画轮廓的CT图像作为模板,另一组准备勾画轮廓的CT图像作为目标。
3. 靶区勾画:患者取仰卧位,采用体部固定架及真空垫、热塑膜固定,阴道内置入标记物,并告知患者,扫描前1 h将直肠与膀胱排空后服入200 ml纯净水。扫描范围:第2腰椎下缘至坐骨结节下缘,包括整个盆腔。勾画器官包括直肠、股骨头、膀胱、髂骨、小肠、肿瘤区(GTV)以及肿瘤临床靶区(CTV)。
4. ABAS软件自动勾画流程:分别将每例患者已勾画器官的CT图像(第1程)和未勾画器官的CT图像(第2程)以DICOM格式传输至ABAS系统,前者作为模板图像,后者作为目标图像。两种图像进行刚性配准、变形和边缘调整等处理后,将模板图像的器官轮廓移植到目标图像上,即器官自动勾画完成。将ABAS软件自动勾画和手工勾画的靶区、危及器官通过网络以DICOM格式传输至飞利浦Pinnacle计划系统,对两组结果进行评估。
5. 自动勾画评估指标:将两组图像进行对比,运用DSC指标评价重合度。DSC相似度方法已经广泛使用于形变图像的分割与配准评估中。
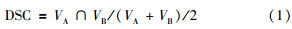
6. 统计学处理:计量值以x±s形式表示,采用SPSS 17.0软件进行分析。对两种勾画方式进行配对t检验。P<0.05为差异有统计学意义。
表 1列出了ABAS软件自动勾画和手工勾画器官的比较结果。勾画轮廓中CTV和左右股骨头的DSC>0.85,GTV、直肠、膀胱、左右髂骨和小肠的DSC>0.72,其中CTV的DSC值最大为(0.89±0.08),GTV的最小为 (0.72±0.16)。两种方式勾画的器官体积差异最大的是膀胱,达到14.7%,推测与定位时患者器官充盈情况不同有关。结合各器官的体积变化值得出,DSC值低于85%的轮廓器官,一般体积较小,层面较少,修改比较容易。
| 表 1 宫颈癌患者ABAS软件自动勾画与手工勾画的器官体积与DSC值比较(x±s) |
图 1是某患者的自动勾画和手工勾画比较图,可以看出大部分器官的自动勾画和医生手工勾画一致,但有些器官边缘或层面差别较大,需认真修改。
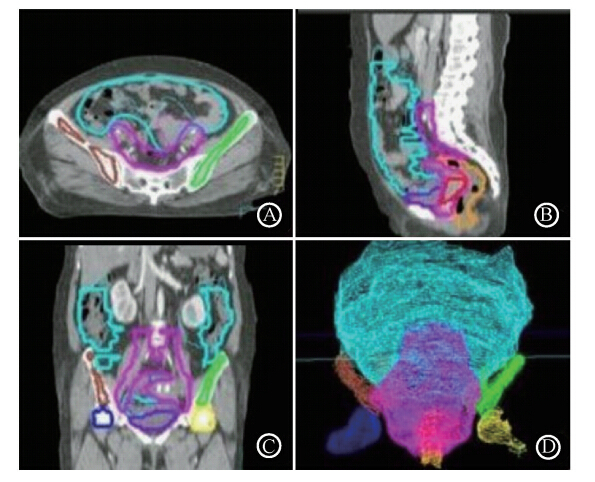 | 注:粗线为自动勾画,细线为手工勾画;各种器官中,红色代表GTV,粉色代表CTV,橙色代表直肠,紫色代表膀胱,绿色代表左股骨头,棕色代表右股骨头,黄色代表左髂骨,深蓝色代表右髂骨,天蓝色代表代表小肠图 1 靶区及危及器官的相似性指标(DSC)比较 A. 横断面图;B. 矢状面图;C. 冠状面图;D. 靶区三维空间图 |
不借助ABAS软件时,医生手工勾画轮廓估计约为90~120 min,ABAS软件自动勾画宫颈癌靶区及危及器官所用时间大约为10 min,结合两种手段,医生在自动勾画图像基础上进行修改,时间大约为15 min,实现了节省时间和提高勾画准确度的结合。
文献报道的ABAS自动勾画软件在放疗中的研究应用多集中在头颈部肿瘤,究其原因是头颈部解剖接近刚性,危及器官相对易配准,可得到较好的自动勾画结果。国内外对ABAS在宫颈癌靶区勾画的应用研究文献报道不多,蒋晓芹等[7]评估了13种器官中有7种的DSC系数超过了0.9,临床上关注的腮腺、脊髓、脑干分别为0.91、0.93和0.94;La Macchia等[8]报道了前列腺癌的勾画比较,除CTV1略低外(DSC=0.88),直肠、膀胱、小肠、左右股骨头平均值分别为0.9、0.95、0.89、0.94、0.94。
本研究中,CTV、左右股骨头的DSC值均在0.85以上,GTV、直肠、膀胱、左右髂骨、小肠的DSC值均在0.72以上。在两种方式勾画器官体积上差异不大,其中最大的为膀胱,达到了14.7%,推测与两次定位时患者充盈情况不同。Zijdenbos等[9]认为DSC>0.7代表重合较好。本研究的DSC值(>0.72)略低,究其原因可能是:与文献相比,本研究的自动勾画后未作任何处理,一般情况下,临床医生自动勾画的结果是在ABAS自动勾画基础上外加修改而来的;可参考的模板图像较少,在宫颈癌放疗中,靶区及危及器官变化比较大,如提供的模板图像仅基于第一程的CT图谱,就欠考虑。为了更好地运用ABAS软件满足临床需要,下一步将考虑自动勾画后进行适当修改的研究,与手工勾画更吻合。同时,进行模板数据库的建立,以提高各器官的自动勾画精确性和勾画效率。
Yan等[10]于1997年正式提出了ART的概念。ART技术是根据图像信息和剂量累计等反馈信息了解患者各种情况的变化,及时调整靶区范围及处方剂量,修改治疗计划以便改进后续分次治疗,使放疗更加精确化。本研究与La Macchia等[8]报道 结果相仿。因此,ABAS软件大大提高了同一患者多次器官勾画效率,降低了多次计划设计的器官勾画工作量,有利于ART技术的开展。
综上,基于图谱库的ABAS勾画软件,在宫颈癌放疗过程中,实际表明可以为临床器官勾画工作节省大量时间,同时加强自动勾画后的轮廓修改,并建立患者模板数据库,能够达到更满意的重合结果,也为开展ART提供强有力支持。
| [1] | Huang D, Xia P, Akazawa P, et al. Comparison of treatment plans using intensity-modulated radiotherapy and three-dimensional conformal radiotheray for paranasal sinus carcinoma [J]. Int J Radiat Oncol Biol Phys, 2003, 56(1): 158-168. |
| [2] | Steenbakkers RJ, Duppen JC, Fitton I, et al. Observer variation in target volume delineation of lung cancer related to radiation oncologist-computer interaction: a 'Big Brother' evaluation [J]. Radiother Oncol, 2005, 77(2): 182-190. |
| [3] | Zhang T, Chi Y, Meldolesi E, et al. Automatic delineation of on-line head-and-neck computed tomography images: toward on-line adaptive radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2007, 68(2): 522-530. |
| [4] | Teguh DN, Levendag PC, Voet PW, et al. Clinical validation of Atlas-based auto-segmention of multiple target volumes and normal tissue (swallowing/mastication) structures in the head and neck[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): 950-957. |
| [5] | Stapleford LJ, Lawson JD, Perkins C, et al. Evaluation of automatic atlas-based lymph node segmentation for head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 959-966. |
| [6] | Tsuji SY, Hwang A, Weinberg V, et al. Dosimetric evaluation of automatic segmentation for adaptive IMRT for head and neck cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 707-714. |
| [7] | 蒋晓芹,段宝风,艾平,等. 基于图谱库的自动勾画软件(ABAS)在鼻咽癌放疗中的应用[J]. 中国医学物理学杂志, 2013, 30(2): 3997-4000. |
| [8] | La Macchia M, Fellin F, Amichetti M, et al. Systematic evaluation of three different commercial software solutions or automatic segmentation for adaptive therapy in head-and-neck, prostate and pleural cancer[J]. Radiat Oncol, 2012, 7(1): 160-176. |
| [9] | Zijdenbos AP, Dawant BM, Margolin RA, et al. Morphometric analysis of white matter lesions in MR images: method and validation[J]. IEEE Trans Med Imaging, 1994, 13(4): 716-724. |
| [10] | Yan D, Lockman D, Brabbins D, et al. An off-line strategy for constructing a patient-specific planning target volume in adaptive treatment process for prostate cancer[J]. Int J Radiat Oncol Biol Phys, 2000, 48(1): 289-302. |
 2015, Vol. 35
2015, Vol. 35