重离子对人体的辐射生物学效应研究受到人们的关注,但对重离子照射后细胞损伤的生物学效应的研究远远少于对电子、X射线和γ射线的研究,重离子独特的能量沉积过程,使其产生与其他低LET射线不同的生物学效应。如高LET辐射在诱导真核细胞周期的G1、S和G2期延迟的分子事件上与低LET有差异[1, 2]。本实验通过观察重离子辐射对人淋巴细胞的增殖、凋亡和周期的影响,初步了解重离子辐射对人淋巴细胞的生物效应。
1. 试剂:Annexin V-FITC/PI染料细胞凋亡试剂盒、PI染料细胞周期试剂盒(南京凯基生物科技公司),MTS法细胞活力检测试剂盒(美国Promega公司),RPMI 1640(美国GIBCO公司),胎牛血清(上海依科赛生物制品有限公司),青、链霉素(南京凯基生物科技公司)。
2. 主要仪器:酶标仪(美国Biorad公司),Cytomics FC500流式细胞仪(美国Beckman Coulter公司),生物倒置显微镜(日本Olympus公司)。
3. 照射条件:中国科学院近代物理研究所兰州重离子研究装置辐照终端引出,能量为165 MeV/u,吸收剂量率为0.3~0.5 Gy/min,吸收剂量为0(对照组)、0.5、2.0 Gy,源靶距2.5 cm。
4. 细胞培养:人淋巴细胞系Peng-EBV购于中国科学院昆明动物研究所。采用含20%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的RPMI 1640培养液,在体积分数为5%的CO2、37℃、饱和湿度条件下培养细胞。细胞生长到一定数目,用血细胞计数板计细胞数目。取第3~4代细胞用于实验。传代后培养24 h进行照射,照射前细胞浓度为1×106/ml。
5. MTS法检测细胞活力:将状态良好的人淋巴细胞PEN-EBV接种于96孔培养板中,接种数量分别为5 000、10 000、20 000、40 000、80 000、100 000、160 000、200 000/孔,设3个重复样本。按照MTS一步法细胞活力检测试剂盒说明书操作。
6. 流式细胞术检测细胞周期:照射后4、8、12、16、20、24、48 h,30 d分别取受照0、0.5、2.0 Gy的细胞,用流式细胞仪检测细胞周期,细胞周期结果用Multicycle 32-bit软件分析G0/G1、S、G2/M期细胞含量。参照细胞周期试剂盒说明书操作,每个样品设3个平行样,上机检测。
7. 流式细胞术检测细胞凋亡:照射后12、24、48 h和20、30 d,分别取受照不同剂量的细胞,用流式细胞仪检测细胞凋亡率。采用Annexin V/PI 法[2],区分正常细胞(Annexin-PI-)、损伤细胞(Annexin-PI+)、死细胞(Annexin+Pl+)、凋亡细胞(Annexin+PI-)。每个样品设3个平行样,参照凋亡试剂盒说明书操作。
8. 统计学处理:实验数据均以x±s表示,用 [LL]SPSS 18.0软件进行统计学分析。重复样本符合正态分布,符合t检验要求,组间比较采用t检验。P<0.05为差异有统计学意义。
1. 12C重离子照射对人淋巴细胞活力的影响:淋巴细胞的MTS活性具有剂量依赖性,即在不同的时间点,随着辐射剂量的增加,细胞活力活性下降。与0 Gy组相比,0.5 Gy组在12、48、72 h细胞数量差异有统计学意义(t=2.66~14.45,P<0.05),2.0 Gy组在24、48、72 h细胞数量差异有统计学意义(t=7.65~64.45,P<0.05)。受照细胞在4~48 h内,随着时间的增加,细胞活力呈增加趋势,但在照后72 h,细胞数量呈下降趋势,且小于48 h时细胞数量,见表 1。
| 表 1 重离子照射后不同时间点人淋巴细胞活力的变化[吸光度(A),x±s] |
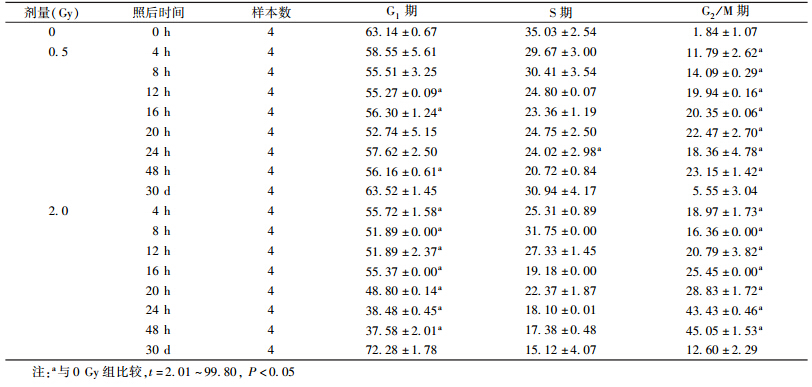
2. 12C重离子照射对人淋巴细胞周期的阻滞作用:人淋巴细胞接受重离子照射后G1、S和G2/M期细胞比例的变化,如表 2所示。在4~48 h范围内,剂量组G2/M期与0 Gy组相比较,差异均有统计学意义(t=2.01~99.8,P<0.05),且2.0 Gy组G1细胞明显减少,与0 Gy组比较,差异均有统计学意义(t=7.81~69.1,P<0.05);2.0 Gy组的G2/M期阻滞明显高于0.5 Gy,且在48 h达到最高,约为0.5 Gy组的2倍。重离子照射后30 d,G1、S、G2/M期细胞比例,与0 Gy组比较,差异均无统计学意义,即G2/M期周期阻滞恢复到正常水平。人淋巴细胞受重离子照射后,G1和S期细胞比例呈下降趋势,G2/M期呈明显的上升趋势,且随着剂量的增加,G2/M期阻滞增加。
| 表 2 各组细胞照射后不同时间细胞周期分布(%,x±s) |
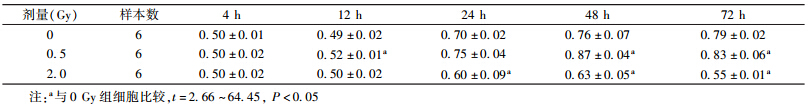
3. 12C重离子照射后人淋巴细胞凋亡率的分析:流式细胞术分析的结果如表 3。人淋巴细胞受重离子照射后12、24、48 h发生凋亡,与0 Gy组比较,差异均有统计学意义(t=-3.05~-1.05,P<0.05)。2.0 Gy组比0.5 Gy组的凋亡率略高,剂量组细胞凋亡率均在24 h达到最高,48 h凋亡率明显下降,随后随时间的延长,凋亡率呈下降趋势,30 d均恢复到对照水平,即与0 Gy组比较,差异均无统计学意义。
| 表 3 各组细胞照射后不同时间细胞凋亡率(%,x±s) |
细胞的各种活动,如细胞增殖、分化和凋亡,是相互联系、高度协调的过程。电离辐射可直接损伤细胞膜和DNA分子,另外,产生的自由基还可间接破坏细胞的生物学功能。电离辐射能诱发细胞周期阻滞,因细胞种类、细胞周期时相和射线种类不同而出现不同的周期阻滞 [3, 4]。本实验结果显示,人淋巴细胞接受12C重离子照射后,发生明显的G2/M期阻滞,在48 h时阻滞最大,且存在明显的剂量依赖性。高LET照射诱发细胞G2/M期阻滞,与DNA双链断裂达到一定的阈值有关,当DNA双链断裂10~20个,细胞能快速启动G2/M期检查点[5]。Wu等[6]用3 Gy剂量(剂量率1.35 Gy/min)的56Fe重离子照射大鼠表皮细胞,发现照后24 h G2/M期阻滞约为对照的6倍。不同低剂量12C离子辐射小鼠胸腺细胞,发现G1、S期细胞减少,促进G2/M期累积[7]。G2期阻滞被认为与放射敏感性相关,有研究证实高LET比低LET辐射可以导致更长的G2期阻滞[8, 9]。本实验中发现受照2.0 Gy的细胞在照后4 h发生明显的G2/M期阻滞,与受照0.5 Gy的细胞在照后12 h的G2/M期阻滞水平相当,这可能与细胞周期检查点的激活需要DNA损伤积累到一定水平有关[10]。
细胞凋亡可发挥阻止未修复或错误修复的损伤细胞继续增殖的作用[11]。本实验中,12C重离子照射人淋巴细胞后,凋亡率在24 h达到最高,在48 h显著下降,可能与周期阻滞诱导的凋亡通路相关,与Ma等[12]的结果一致,他用12C离子束和X射线辐照人肝癌SMMC-7721细胞,细胞凋亡率在24和48 h呈增加趋势,细胞周期发生G2/M期阻滞,细胞增殖受抑制。G2期阻滞可能与电离辐射引起DNA损伤、微管蛋白、有丝分裂纺锤体的形成和结合有关,细胞发生G2期周期检查,有利于DNA损伤的修复,保证基因组的遗传稳定性。当损伤不能被有效修复时,细胞周期检查点不能通过,则可引起细胞凋亡[13]。
哺乳动物细胞的生长增殖依赖于细胞周期的正常运行。本实验结果显示,重离子影响人淋巴细胞增殖,0.5 Gy组细胞增殖活力高于对照组,2.0 Gy组低于对照组,可能是0.5 Gy剂量激活了介导细胞增殖的基因,具体原因有待进一步分析、验证。MTS结果显示,在72 h时,剂量组细胞数量明显下降,可能与受照48 h后细胞失去自身检测和修复DNA损伤的能力和调节细胞周期进展和凋亡的能力,发生有丝分裂死亡。
大量的研究表明,细胞生长、周期和细胞凋亡之间相互耦联,主要表现在细胞内许多重要蛋白质的参加,如p53、c-Myc、Caspase等[14, 15]。本研究证实12C离子束辐射诱导人淋巴细胞发生明显的G2/M期阻滞,促进细胞凋亡,影响人淋巴细胞的增殖。G2期阻滞有利于细胞修复,调控细胞的凋亡和增殖,从而调整重离子辐射细胞效应。对于重离子生物效应的深入研究,可为重离子临床治疗提供基础信息。
| [1] | 刘建香,苏旭. 重离子辐射生物效应的研究进展[J].中华放射医学与防护杂志,2003,23(1):65-67. |
| [2] | Gridley DS, Pecaut MJ. Genetic background and lymphocyte populations after total-body exposure to iron ion radiation[J]. Int J Radiat Biol, 2011, 87(1):8-23. |
| [3] | Hwang A,Muschel RJ.Radiation and the G2 phase of the cell cycle[J].Radiat Res,1998,150(5 Suppl):S52-S59. |
| [4] | Durocher D, Jackson SP.DNA-PK,ATM and ATR as sensors of DNA damage:variations on a theme[J].Curr Opin Cell Biol,2001,13(2):225-231. |
| [5] | Deckbar D, Jeggo PA, Löbrich M.Understanding the limitations of radiation-induced cell cycle checkpoints[J]. Crit Rev Biochem Mol Biol,2011,46(4):271-283. |
| [6] | Wu F, Zhang R, Burns FJ. Gene expression and cell cycle arrest in a rat keratinocyte line exposed to 56Fe ions [J].J Radiat Res, 2007,48(2):163-170. |
| [7] | 赵卫平,张红,王燕玲,等. 12C6+离子预辐射对小鼠胸腺脾脏细胞周期进程的影响[J]. 原子核物理评论,2009,26(2):158-162. |
| [8] | Rödel F, Hoffmann J, Distel L, et al. Survivin as a radioresistance factor,and prognostic and therapeutic target for radiotherapy in rectal caneer[J]. Cancer Res,2005,65(11):4881-4888. |
| [9] | Cheong N,Zeng ZC,Wang Y,et al.Evidence for factors modulating radiation-induced G2-delay:potential application as radioprotectors[J]. Phys Med,2001,17(Suppl 1):S205-S209. |
| [10] | 蒋满荣.DNA损伤对哺乳动物细胞周期和凋亡的影响[D].上海:中国科学院上海生命科学研究院生物化学与细胞生物学研究所,2004. |
| [11] | Knehr S, Zitzelsberger H, Braselmann H, et al.Analysis for DNA-proportional distribution of radiation-induced chromosome aberrantions in various triple combinations of human chromosomes using fluorescence in situ hybridization[J]. Int J Radiat Biol,1994,65(6):683-690. |
| [12] | Ma J, Ye L, Da M, et al.Heavy ion irradiation increases apoptosis and STAT-3 expression, led to the cells arrested at G2/M phase in human hepatoma SMMC-7721 cells[J].Mol Cell Biochem,2009,328(1-2):17-23. |
| [13] | Pawlik TM, Keyomarsi K.Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys,2004,59(4):928-942. |
| [14] | Packham G, Cleveland JL. The role of ornithine decarboxylase in c-Myc-induced apoptosis[J]. Curr Top Microbiol Immunol,1995,194:283-290. |
| [15] | Liao DJ, Dickson RB. c-Myc in breast cancer[J].Endocr Relat Cancer,2000,7(3):143-164. |
 2015, Vol. 35
2015, Vol. 35