1. 实验动物:健康日本雄性大耳兔3只,4月龄,体重1.5~2.0 kg;健康昆明小鼠24只,8周龄,雌雄各半,体重20~22 g,均由第三军医大学实验动物中心提供,大耳兔合格证号:SCXK (渝)2012-0003; 小鼠合格证号:SYXK (渝)2012-0002。
2. 试剂及主要仪器:由上海强耀生物科技有限公司合成HER-2模拟肽B2-S22-AFA及N4结构的双功能螯合剂Gly-Ala(D)-Gly-Gly-Aba[甘氨酸-丙氨酸(D)-甘氨酸-甘氨酸-γ氨基丁酸,简称(G-A(D)GG-Aba)],并将模拟肽氨基末端与此双功能螯合剂耦联,对氨基末端进行G-A(D)GG-Aba修饰,同时对多肽羧基端酪氨酸进行酰胺化,得到产物G(D)AGG-Aba-YCFPDEEGACY-NH2(相对分子质量为1 622.73,简称TP1623),经HPLC纯化,质谱鉴定,化学纯度>95%。99Mo-99Tcm发生器(裂变型,Na99TcmO4的放化纯> 98%),北京原子高科股份有限公司提供;氯化亚锡(美国Sigma公司);氮气(纯度>99%),重庆朝阳气体有限公司提供;3MM色谱层析纸(英国Whatman公司);Sephadex G50(上海化学试剂厂);其余试剂均为国产分析纯。MillenniumTM MPR SPECT仪(美国GE公司),配低能高分辨率准直器,能峰140 keV,窗宽20%,矩阵128×128,放大倍数1;RM-905a型活度计(中国计量科学研究院);GC-911型γ免疫计数仪(合肥中佳光电仪器公司)。
3. 99Tcm标记TP1623: 采用间接标记法,根据文献[9, 10]的标记条件,对TP-1623用量、氯化亚锡浓度进行多次实验,筛选出最高标记率时的最佳反应条件。标记方法如下:室温下2.5 ml细胞冻存管中依次加入双蒸水溶解的TP1623(15 μg/15 μl)、50 mmol/L HCl现配制的氯化亚锡溶液[JP](22.5 μg/15 μl)、67 mmol/L磷酸钠溶液300 μl、新鲜淋洗的 99TcmO4- 100 μl(222 MBq),总反应体积430 μl,pH 10,充分混匀,通氮气、密封,室温下振荡(200次/min),30 min完成标记;加入1 mol/L NaH2PO4 35 μl调节标记溶液pH至7.0~7.2。
4. 99Tcm-TP1623标记率与比活度测定:取标记混合物经3MM色谱纸上行层析,流动相分别为丙酮(展开剂Ⅰ)和V(质量分数30%氨水)∶V(无水乙醇)∶V(双蒸水)=1∶2∶5(展开剂Ⅱ)。在展开剂Ⅰ层析中 99Tcm-TP1623与放射性胶体(水解锝 99TcmO2·xH2O)位于原点,99TcmO4- Rf值为0.9~1.0;在展开剂Ⅱ中,放射性胶体仍位于原点,99Tcm-TP1623和 99TcmO4-的Rf分别为0.8~0.9和0.7~0.8。将层析纸分段裁剪,γ计数仪测定各段放射性(计数/min)。分别按公式计算标记率及比活度:标记率(%)=展开剂Ⅰ原点放射性计数率(%)-展开剂Ⅱ原点放射性计数率(%); 比活度(TBq/mmol)=加入 99Tcm活度(TBq)×标记率/ [TP1623化学量(mg)×化学纯度/ TP1623的相对分子质量]。
5. 99Tcm活度最大结合实验:标记反应液中除加入的 99Tcm4O-活度分别增至370和740 MBq外,其余条件不变,观察标记率的变化,确定标记率>90%时TP1623结合 99Tcm的最大活度。
6. 放化纯度测定:用1%PBS溶液平衡SephadexG-50层析柱(125 mm×10 mm)。取100 μl标记溶液(74 MBq),用PBS溶液稀释到200 μl混匀,室温下取100 μl行柱层析,分部收集洗脱液,每管0.5 ml,测定每管放射性计数,绘制洗脱液时间-放射性曲线(T-A曲线)。按公式计算放化纯度: 放化纯度(%)=标记产品峰的总计数率/所有收集管的总计数率×100%。
7. 体外稳定性实验:将标记溶液室温下密封放置,分别于0、4、6 h取样进行3MM色谱纸层析(方法同上),测定各时相点 99Tcm-TP1623的放化纯度。
8. 血清蛋白结合实验:按文献[10]方法,取100 μl(74 MBq)标记溶液与100 μl正常人血清混合,37℃水浴箱中温育2 h。室温下,取100 μl该混合液行Sephadex G-50柱(125 mm×10 mm)层析,柱平衡及洗脱均用1%PBS溶液,分部(0.5 ml/管)收集洗脱液,γ计数仪测定每管放射性,作出洗脱液T-A曲线。取相同活度的标记溶液用0.1 mol/L PBS(pH 7.2~7.4)稀释到200 μl,取100 μl同上法进行柱层析,设为对照。
9. 油/水分配实验[10]:室温下将10 μl(74 MBq) 99Tcm-TP1623、400 μl 0.1 mol/L PBS、500 μl辛醇充分混匀;12 000 r/min,离心半径15 cm,离心4 min,静置分层,分别从有机相和水相溶液中移取10 μl和100 μl至试管中,γ计数仪测定放射性。经体积校正后按公式计算油/水分配系数(lg P):lg P=lg(有机相放射性计数/水相放射性计数)。
10. 99Tcm-TP1623注射液与参考源的制备:取 99Tcm-TP1623标记液,加生理盐水稀释至0.1 mCi/100 μl(1 Ci=3.7×1010 Bq)的注射液,供小鼠体内分布实验用。取3.7 MBq标记溶液稀释至500 ml,充分混匀,分别取1 ml加入至21支γ放免分析用试管中,测得放射性,计算平均值,结果乘以500作为参考源。
11. 正常小鼠体内分布实验:24只昆明小鼠随机数字表法分为6组,每组5只。每只经尾静脉注射100 μl(3.7 MBq) 99Tcm-TP1623,分别于注射后1、5、10、30、60和120 min断颈处死,收集血液、心、肺、肝、肾、肠、肌肉、骨骼和脑,称重并测量放射性,结果经参考源校正后,换算为每克组织百分注射剂量(%ID/g)=(标本放射性计数×100)/(标本重量×参考源计数)
12. 健康家兔显像实验:将兔仰卧位固定于木制实验台,探头视野中心对准兔胸腹部。经耳缘静脉注射经生理盐水稀释的 99Tcm-TP1623标记液200 μl(74 MBq),立即以1帧/s采集1 min,1帧/min,采集60 min,并于2.0、3.5 h经时间衰减校正后各预置计时2 min采集1帧图像,利用感兴趣区(ROI)技术,分析注射显像剂 99Tcm-TP1623后各组织器官的T-A曲线,并定性观察健康兔体内主要器官的放射性分布变化。
1. 标记率与比活度:99Tcm-TP1623在纸层析展开剂Ⅰ中位于原点,在展开剂Ⅱ中Rf值为0.8~0.9,计算得到标记率为96.13%~96.49%,平均(96.4±0.1)%,比活度为24.30~24.40 TBq/mmol,[JP]平均(24.35±0.06)TBq/mmol。最大结合实验显示,10 μg TP1623用740 MBq 99Tcm标记,99Tcm-TP1623的平均标记率为(94.5±0.9)%,平均比活度为(95.62±1.32)TBq/mmol。
2. 理化性质:标记溶液室温放置4 h和6 h,99Tcm-TP1623的平均放化纯度分别为(95.0±1.0)%和(94.9±0.7)%。 99Tcm-TP1623的油/水分配系数lg P为-(2.51±0.15)。血清蛋白结合实验显示,Sephadex G-50柱层析洗脱液T-A曲线仅见两个峰:前面的第1个峰为蛋白结合峰(图 1),占总放射性的18.5%(即标记产品蛋白结合率)。第2个高峰位置与对照组 99Tcm-TP1623高峰相当,表明为未与血清蛋白结合的标记多肽峰,占总放射性的81.5%。
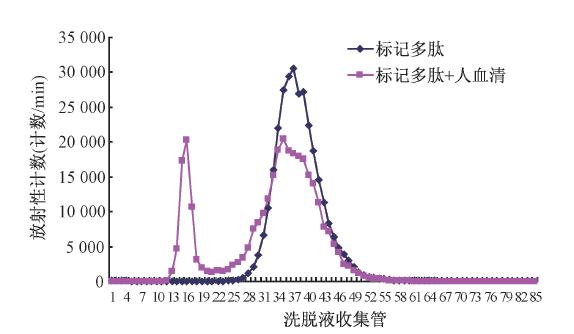 | 图 1 血清蛋白结合实验的Sephadex G-50柱层析洗脱液T-A曲线 |
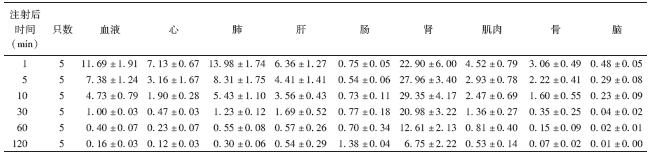
3. 99Tcm-TP1623在小鼠体内分布:该标记模拟肽早期主要分布于肾、肺、心脏、血液和肝,其次是肌肉和骨;5 min后,肺、心脏、血液、肝、肌和骨放射性随时间逐渐减低,60 min后放射性呈明显低水平;脑放射性始终呈最低水平。血液中清除迅速,60 min时放射性仅为1 min时的3.42%。通过肾脏排泄快,10 min时肾脏放射性最高达29.4%ID/g,120 min后下降了77.0%;肠道放射性则随时间缓慢增加,120 min时增加了63.14%(表 1)。
| 表 1 99Tcm-TP1623注射后不同时间在正常小鼠体内的生物分布(%ID/g,x±s) |
4. 99Tcm-TP1623在家兔体内显像:静脉注射 99Tcm-TP1623后,1 min内心脏与大血管影清晰,肝脏、双肺和双肾显影;10 min时心脏、肺影明显减淡,肝脏继续显影,双肾影清晰,膀胱影明显;1 h时肝影基本消退,胆囊影出现,肠道影隐约可见,双肺影消失,双肾影减淡,膀胱影增加;2 h肠道放射性增加,胆囊影无明显变化,肾、膀胱影继续减淡。整个显像过程中颈部甲状腺区及胃区始终放射性缺损,脑始终呈本底水平(图 2)。注射显像剂后60 min内,部分脏器动态显像的ROI半定量分析显示:心脏曲线在注射后即呈下降趋势,肝脏曲线高峰出现时间快,下降迅速;双肾曲线高峰约为15 min,随时间逐渐下降;膀胱曲线随时间快速上升,40 min后因尿液排泄开始下降(图 3)。
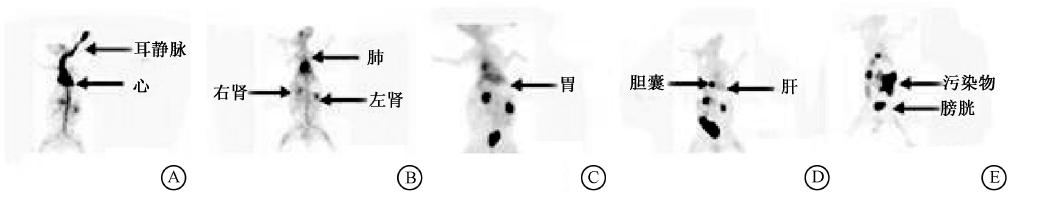 | 图 2 健康家兔静脉注射 99Tcm-TP1623后不同时间SPECT平面前位显像图 |
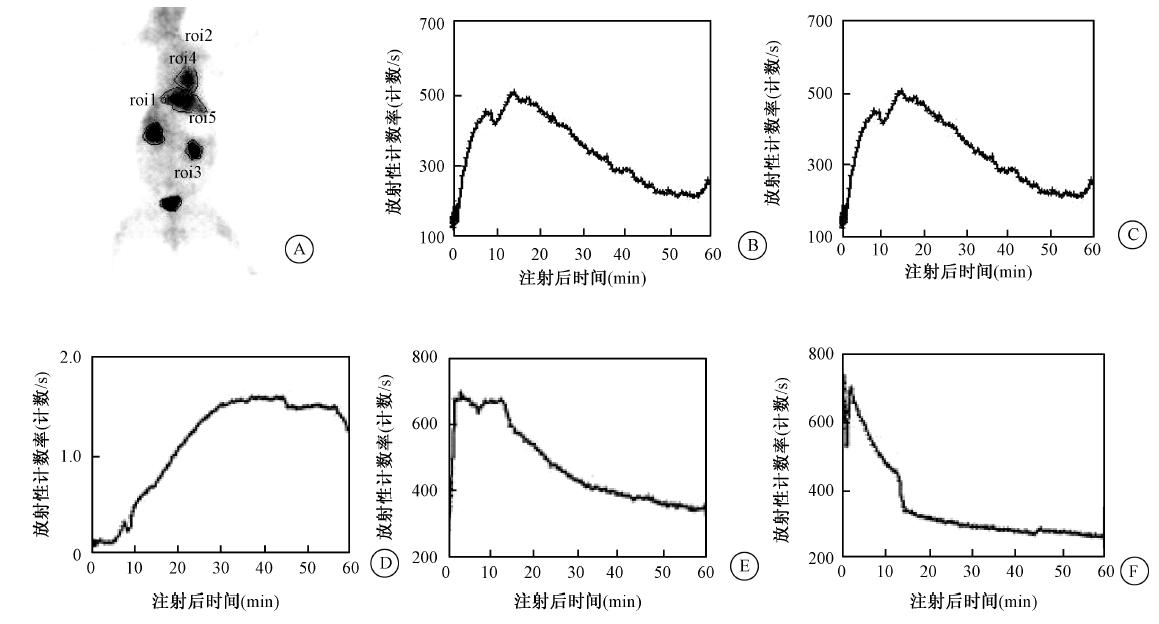 | 图 3 99Tcm-TP1623在健康大耳兔体内部分器官动态分布的T-A曲线 A. 1 min 内放射性分布主要集中在心脏、肝脏和双肾,并出现在膀胱; B.右肾; C.左肾; D.膀胱; E.肝脏; F.心脏 |
寻找疾病特异、高水平表达的靶分子,制备与靶分子具有高选择性及高亲和力结合的分子探针,是分子影像的前沿和发展方向[11]。目前,常用于受体显像剂标记的核素有 99Tcm、131I、18F、188Re和64Cu等,其中 99Tcm可由钼-锝发生器产生,来源方便,价廉易得,半衰期短(6.02 h),患者所受辐射剂量低,图像质量高,在目前核医学显像诊断用放射性药物中,99Tcm标记的显像剂占80%[12],是核医学显像最常用的放射性核素。
99Tcm标记小分子多肽有直接标记法和间接标记法两种。直接法是 99Tcm与多肽中的含N或S基团通过非共价键络合结合,其对多肽结构的影响往往较大,结合通常不牢固,容易发生 99Tcm脱落,而且标记制备时间长、易于影响多肽的生物结合活性等[13]。更常用的是间接标记法,通过双功能螯合剂(bifunctional chelating agents,BFCA)将 99Tcm与被标记多肽耦联起来。BFCA一端连接待标记的化合物如多肽,另一端络合 99Tcm,技术成熟,键合牢固,并可避免对被标记物的损伤,一般不干扰被标记多肽与受体的高亲和力结合。
本研究中,通过在HER-2模拟肽B2-S22-AFA的氨基端进行Gly-Ala(D)-Gly-Gly-Aba修饰及羧基端酪氨酸(Tyr)进行酰胺化,以Gly-Ala(D)-Gly-Gly作为双功能螯合剂,与 99Tcm形成4个配位键牢固键合,Aba则与B2-S22-AFA连接,有助于最大限度地减少GA(D)GG与 99Tcm螯合后可能对B2-S22-AFA与HER-2受体结合亲和力及特异性的影响。
本研究克服了直接法 99Tcm标记多肽反应条件剧烈,需对多肽环中的二硫键还原,制备时间长、易改变多肽生物结合活性等不足,标记方法简便,常温下即可完成,放化产率高(>95%),无需纯化,稳定性好,标记后室温放置6 h时放化纯度为(94.9±0.7)%,产品比活度高达(23.13±0.06)TBq/mmol,能满足HER-2受体显像和示踪研究要求,并可制备成一步法试剂盒便于临床应用。
理想的分子显像剂在体内应具备稳定性好、血液清除快、血池本底低、经泌尿系统排泄等特点。血清蛋白结合实验显示标记多肽的血清蛋白结合率较低(18.5%),提示其在组织中的分布与血液清除速度快,柱层析洗脱液T-A曲线上未见游离 99Tcm峰或 99Tcm标记的产品降解峰,提示 99Tcm与TP1623间的络合力强、稳定,放化纯度高。油/水分配实验显示:标记多肽亲水性较高,提示其在动物体内主要经泌尿系统排泄,有助于加快体内放射性清除速度。
99Tcm-TP1623在小鼠体内分布研究显示:在组织分布与血液清除迅速,通过肾脏排泄较快,60 min后其余组织器官放射性呈明显低水平,与血清蛋白结合实验基本一致,提示静脉注射后短时间内可获得低血池本底影像,使靶器官显像时,正常组织处于低放射性水平,增加靶/非靶组织比值,提高对病灶检出率;肠道放射性缓慢增加,提示 99Tcm-TP1623可从肝胆系统排泄。脑放射性始终呈最低水平,表明 99Tcm-TP1623不能通过正常的血脑屏障,有可能用于评价血脑屏障的完整性。
99Tcm-TP1623在健康家兔体内的显像结果与小鼠体内分布基本一致。其优势在于能够直接观察示踪剂在整体各脏器内的动态分布变化。其结果意义如下:1代表血液示踪剂变化的心脏ROI 的T-A曲线下降1/2时间约10 min,肾脏20 s即显影,其ROI的T-A曲线虽在15 min后开始降低,但放射性始终高于心脏,膀胱10 min清晰可见且ROI的T-A曲线5 min后持续增浓,进一步证实[JP] 99Tcm-TP1623在血液分布和清除迅速,主要通过肾脏排泄且快,符合小分子多肽显像剂血液清除快的特点。2肝脏放射性随时间明显降低,胆囊及肠道放射性随时间有所增加,这与健康小鼠肠道放射性分布缓慢增加一致,与其油/水分配实验结果吻合,表明小部分 99Tcm-TP1623经肝胆系统分泌,提示检查前禁食及注射示踪剂后进食脂肪餐对减低胆囊、肠道放射性很有必要。3整个显像过程中,胃区始终呈放射性缺损区,甲状腺区始终呈软组织本底影,表明 99Tcm-TP1623体内高度稳定,无明显脱 99Tcm现象。上述显像结果与HER-2受体在绝大多数正常组织器官中不表达或极低表达的结论相吻合。
综上,本研究制备 99Tcm-TP1623方法简便,放化产率高(>95%),体内外稳定性好,产品比活度高,体内动力学特性优良,能满足HER-2受体显像和示踪研究要求,为进一步探讨其作为HER-2受体阳性乳腺癌分子显像提供了实验依据。
志谢 本课题研究得到了第三军医大学西南医院核医学科李前伟教授在实验设计及技术方面的热情指导和无私帮助,在此表示衷心感谢| [1] | 李霓, 郑荣寿, 张思维, 等. 中国城乡女性乳腺癌发病趋势分析和预测[J]. 中华预防医学杂志, 2012, 46(8): 703-707. |
| [2] | Grünwald V, Hidalgo M. Developing inhibitors of the epidermal growth factor receptor for cancer treatment[J]. J Natl Cancer Inst, 2003, 95(12):851-867. |
| [3] | Luoh SW, Ramsey B, Newell AH, et al. HER-2 gene amplification in human bresat cancer without concurrent HER-2 over-expression[J]. Springerplus, 2013,2:386-396. |
| [4] | 王继芳,邹存华,赵淑萍. HER-2在子宫内膜样腺癌中的表达及临床意义[J]. 山东医药,2014, 54(1):47-48. |
| [5] | Ponde DE, Su Z, Berezov A, et al. Development of anti-EGF receptor peptidomimetics (AERP) as tumor imaging agent[J]. Bioorg Med Chem Lett, 2011, 21(8):2550-2553. |
| [6] | Xu N, Cai G, Ye W, et al. Molecular imaging application of radioiodinated anti-EGFR human Fab to EGFR-overexpressing tumor xenografts[J]. Anticancer Res, 2009, 29(10):4005-4011. |
| [7] | 钟锦绣,李亚梅,关晏星. 乳腺癌HER-2胞外配体结合区靶点治疗的研究进展[J]. 中国肿瘤临床,2013,4(17):1076-1079. |
| [8] | Berezov A, Chen J, Liu Q, et al. Disabling receptor ensembles with rationally designed interface peptidomimetics[J]. J Biol Chem, 2002, 277(31): 28330-28339. |
| [9] | 查林, 冯世斌, 郑磊, 等. 整合素αVβ3放射性配体 99Tcm-TP1326的制备及其正常兔显像研究[J]. 第三军医大学学报, 2012, 34(3):235-238. |
| [10] | Rao PS, Thakur ML, Pallela V, et al. 99Tcm labeled VIP analog: evaluation for imaging colorectal cancer[J]. Nucl Med Biol, 2001, 28(4): 445-450. |
| [11] | Fani M,Maecke HR.Radiopharmaceutical development of radiolabelled peptides[J]. Eur J Nucl Med Imaging,2012,39(Suppl 1): S11-S30. |
| [12] | Laverman P, Sosabowski JK, Boerman OC,et al.Radiolabelled peptides for oncological diagnosis[J].Eur J Nucl Med Mol Imaging,2012,39(Suppl 1):S78-S92. |
| [13] | Zhou Y, Kim YS, Lu X, et al. Evaluation of 99mTc-labeled cyclic RGD dimers: impact of Cyclic RGD peptides and 99mTc chelates on biological properties[J]. Bioconjug Chem,2012,23(3):586-595. |
 2015, Vol. 35
2015, Vol. 35