2. 江南大学附属医院医学影像科
1. 细胞、动物、仪器与试剂:c(CGRRAGGSC)(美国休斯顿Baylor医学院分子影像研究中心惠赠)。E502 γ计数仪(美国Packard公司),CP224S微量称量仪(德国Sartorius公司),34-061活度计(美国Victoreen公司)。人肝癌细胞系MHCC97-H、MHCC97-L购自中国上海市中国科学院细胞库,前列腺癌细胞系PC-3,乳腺癌细胞系MDA-MB-231、MCF-7,卵巢癌细胞系SKOV3,宫颈癌细胞系HeLa,人正常肝细胞 HHL-5,F12K培养基、Annexin-V-FITC+PI凋亡检测试剂盒均购自中国南京凯基生物有限公司。体积分数2.5%胰蛋白酶(美国Sigma公司),质量分数10%胎牛血清(美国GIBCO公司)。兔抗IL-11Rα、IL-11和羊抗β-肌动蛋白(美国Santa Cruz公司),生物素标记的羊抗兔IgG、辣根酶标记的链亲和素、DAB显色试剂盒、辣根酶标记羊抗兔IgG和兔抗羊IgG(北京中杉金桥生物技术公司),蛋白分子量标志物(北京纽英伦生物技术有限公司),其他试剂均为国产分析纯。BALB/c裸鼠20只,雄雌各10只,4周龄,体质量15~19 g,由扬州大学动物比较中心提供,合格证号SCXK苏2011-0032,在无菌室中饲养。
2. 153Sm-DTPA-c(CGRRAGGSC)的制备与质量控制:参照文献[7, 9]采用间接法合成DTPA-c(CGRRAGGSC),确定最佳标记条件后依次加入153SmCl3 370 MBq/200 μl、DTPA-c(CGRRAGGSC) 20 μg,用0.1 mol/L的盐酸调溶液酸度到pH 8.0,反应体积0.5 ml,室温中反应30 min。HPLC分析纯化及标记物稳定性评价见参考文献[7]。
3. 不同细胞系的IL-11受体表达:采用Western blot方法分析MHCC97-H、MHCC97-L、PC-3、MDA-MB-231、SKOV3、HeLa、MCF-7、HHL-5 8种细胞系IL-11受体表达,步骤参见文献[7],相应蛋白灰度表达值为条带的灰度值除以β-肌动蛋白(1∶1 000,相对分子质量43 000)内参照校正。
4. c(CGRRAGGSC)与MHCC97-H结合的平衡解离常数(Kd)和每个细胞上的最大结合位点数(Bmax) 测定:采用放射性配基结合分析法受体结合多点饱和实验分析。收集常规培养的人肝癌细胞系MHCC97-H,调整细胞密度为5×105/ml。将0.5 ml细胞悬液分别与不同浓度(1×10-7~10×10-7 mol/L,级差1×10-7 mol/L)的153Sm-DTPA-c(CGRRAGGSC) 0.1 ml置于反应管内,补足体积至1 ml,4℃孵育3 h,冰Hank's液中止反应,4℃、3 000 r/min,离心半径10 cm,离心15 min,弃上清液,沉淀与甲酸60℃水浴30 min,然后用放射免疫γ计数器测量沉淀部分的总放射性计数(TB)和非特异性结合(NSB),则特异性结合(SB)=TB-NSB。各水平样品均设3复管,设有总结合管和非特异性结合管。以放射性计数率为纵坐标,加入153Sm-DTPA-c(CGRRAGGSC)的量为横坐标作出饱和曲线。以SB/F为纵坐标(FB为游离标记配体的放射性计数率,T为投入总放射量,F=T-TB,SB/FB代表配基结合量与游离量之比),特异性结合量SB为横坐标,Scatchard作图,用直线回归法求得平衡解离常数(Kd)和受体最大结合容量(Bmax)。
5. 受体结合竞争抑制实验:20只试管分别加入配制好的人肝癌细胞系MHCC97-H细胞悬液70 μl(2.24×10-2 mg),153Sm-DTPA-c(CGRRAGGSC) 6×10-7 mmol/L,未标记c(CGRRAGGSC)10-10~10-1 mmol/L,级差10-1 mmol/L,每级设双管。用0.5%Tris缓冲液补足反应体积至250 μl。NSB组10管,分别加入蒸馏水70 μl,153Sm-DTPA-c(CGRRAGGSC) 6×10-7 mmol/L,未标记c(CGRRAGGSC) 10-10~10-1 mmol/L,级差10-1 mmol/L。用0.5%Tris缓冲液补足反应体积至250 μl。余下步骤同受体结合多点饱和实验,以SB为纵坐标,加入未标记小分子多肽c(CGRRAGGSC)的量为横坐标作出竞争抑制曲线。
6. 肝癌MHCC97-H细胞皮下模型的建立及实验分组:肝癌MHCC97-H细胞系作细胞计数,并调节使活细胞浓度为1×107/ml,于裸鼠右前肢近腋窝皮下接种0.1 ml/只,待肿瘤生长到直径大小约1.0 cm时进行试验。按照随机数字表法随机分为4组,每组5只。分别为对照组(0 MBq,尾静脉注入生理盐水0.2 ml)、低、中、高剂量组[尾静脉分别注入153Sm-DTPA-c(CGRRAGGSC) 5.5、11.0和22.0 MBq],给药后定期观察瘤体局部和全身变化。游标卡尺测量瘤体最长径为x轴,与该轴垂直的最大径为y轴,计算瘤体体积,按照公式绘制各剂量组的瘤体体积随时间变化的肿瘤抑制生长曲线。给药后16 d处死全部小鼠,分离瘤体,称重,计算抑瘤率。瘤体积V=4/3 × π × (x/2)2 × (y/2);抑瘤率(%)=(W1-W2)/W1×100%,其中,W1为对照组瘤体平均质量,W2为各治疗组每只裸鼠瘤体的质量。
7.组织学检测及免疫组织化学检测IL-11受体、Ki-67、Bcl-2的表达:为尽可能减少放射性药物对瘤鼠模型一般状态及生理活性的抑制,以便能顺利观察到实验终点,选取5.5 MBq低剂量组裸鼠作为检测对象。给药后16 d切开裸鼠瘤体表皮,观察瘤体质地,肉眼下取瘤体无坏死的约1 mm3的肿瘤组织若干块,组织学检测及免疫组织化学参见试剂盒说明书。
8. 不同剂量153Sm-DTPA-c(CGRRAGGSC)放射性药物作用肝癌MHCC97-H细胞模型后肿瘤细胞IL-11受体表达:PBS清洗瘤组织,将组织剪碎,加入蛋白质裂解缓冲液及蛋白酶抑制剂。采用Western blot方法分析,具体步骤参照文献[7]。
9. 统计学处理:各实验均重复3次以上。计量数据采用x±s表示。采用SPSS 14.0软件进行数据分析,采用配对t检验及单因素方差分析进行比较。方差齐性采用LSD检验,方差不齐采用Games-howell检验。P<0.05为差异有统计学意义。
1. 153Sm-DTPA-c(CGRRAGGSC)的鉴定:153Sm-DTPA-c(CGRRAGGSC)的标记率﹥85%,放化纯度>95.4%,比活度为1.32×105 MBq/μmol。室温放置,分别于即刻、2、4、8、12、24、36和48 h测定标记物的放化纯度,依序为(99.79±0.23)%、(99.37±012)%、(99.14±0.09)%、(98.73±0.26)%、(97.81±0.35)%、(96.51±0.42)%、(94.22±0.69)%和(89.65±0.74)%。在4℃生理盐水中可以保持32 h稳定,其放化纯度为95.7%。
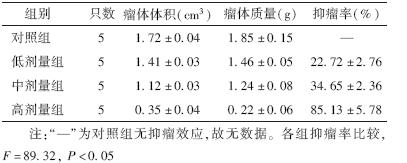
2. 不同细胞系IL-11受体表达Western blot分析:以IL-11R/β-肌动蛋白比值表示IL-11R在各种肿瘤细胞中的相对蛋白表达量,由图 1可见,在正常的人肝细胞(HHL-5)中IL-11受体的相对表达量是0.1,而在肿瘤细胞中其表达不同程度地上调2~5倍,尤其是在具有高转移潜能的肝癌MHCC97-H细胞IL-11受体表达上调更明显,相对表达量为0.5。故选择该细胞进行后续实验。
 | 注: 1. MHCC97-H; 2.MHCC97-L; 3. PC-3; 4. MDA-MB-231;5. SKOV3; 6. HeLa; 7. MCF-7; 8. HHL-5图 1 IL-11R在不同肿瘤细胞和正常人肝细胞 HHL-5中的表达 |
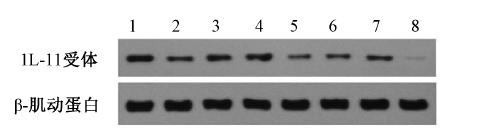
3. MHCC97-H肝癌细胞IL-11受体分析饱和性实验:特异性结合(SB)的结合量随标记物的用量的增加而增加,但增加幅度逐渐降低,呈饱和趋势。非特异性结合(NSB)随标记物用量的增加呈直线上升,无饱和趋势(图 2)。Scatchard作图呈近似一条直线。Kd为(0.38±0.05)nmol/L,Bmax为(768±52)fmol/mg蛋白。
 | 注: NSB.非特异性结合;SB.特异性结合;SB/FB.配基结合量与游离量之比;FB.游离标记配体的放射性计数率图 2 153Sm-DTPA-c(CGRRAGGSC)与MHCC97-H肝癌细胞 IL-11受体结合饱和性曲线(A)和Scatchard作图(B) |
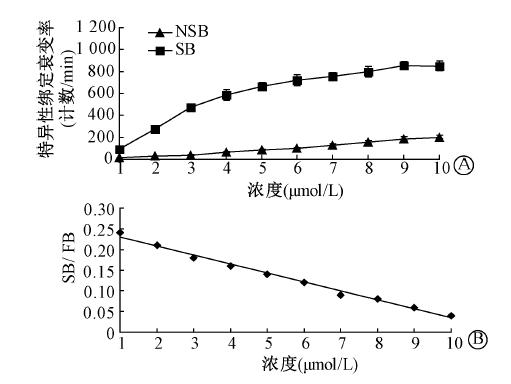
4. 受体分析竞争抑制结合实验:随着非标记c(CGRRAGGSC)在反应体系中的浓度逐渐增加,153Sm-DTPA-c(CGRRAGGSC)与受体的结合逐渐降低,两者的结合活性差异无统计学意义(图 3),IC50为(7.56±0.22)nmol/L,Ki为(3.02±0.19)nmol/L。
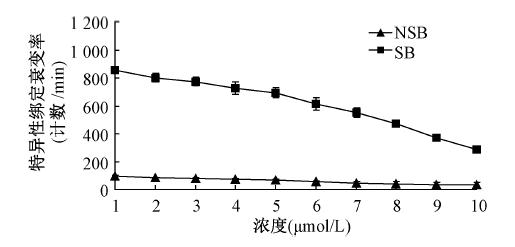 | 注: NSB.非特异性结合;SB.特异性结合图 3 c(CGRRAGGSC)和153Sm-DTPA-c(CGRRAGGSC) 与MHCC97-H肝癌细胞IL-11受体竞争性结合曲线 |
5.模型一般情况及裸鼠模型瘤体生长抑制率评估:各组实验鼠饮食、活动未见明显异常,未触及异常肿大淋巴结,均存活16 d。皮下移植MHCC97-H肝癌模型鼠瘤体生长至0.8~1.0 cm;尾静脉内注 射153Sm-DTPA-c(CGRRAGGSC)后,瘤体边缘局部可出现红肿现象,2 d左右消退。高剂量组较低剂量组瘤体抑制明显,早期瘤体中央可出现坏死、干瘪、结痂,后期又出现坏死周围瘤组织继续增长,较对照组仍生长明显缓慢。各组抑瘤率见表 1。
| 表 1 各治疗组注射后16 d抑瘤效应比较x±s |
6. 裸鼠模型瘤体组织学观测:光镜观察对照组肿瘤组织生长旺盛,肿瘤细胞核大排列紧密,呈小岛状、条索状或巢状分布;低剂量组肿瘤细胞排列疏松,可见大片凝固样坏死及大量纤维结缔组织(图 4)。电镜观察对照组核仁明显,核分裂相多见;治疗组瘤细胞结构破坏明显、核分裂相不明显,核固缩、核碎裂、核溶解多见,胞内出现空泡(图 5)。
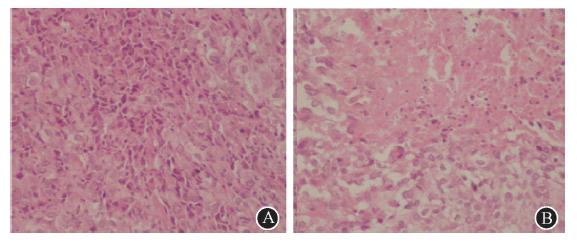 | 图 4 裸鼠模型药物干预后瘤体大体标本光镜观察 HE染色 ×100 A.对照组:可见肿瘤组织生长旺盛,瘤细胞排列紧密,肿瘤细胞排列紧密;B.低剂量组:不同程度瘤组织坏死,发生凝固性坏死时,周围坏死带明显,残存瘤细胞排列松散 |
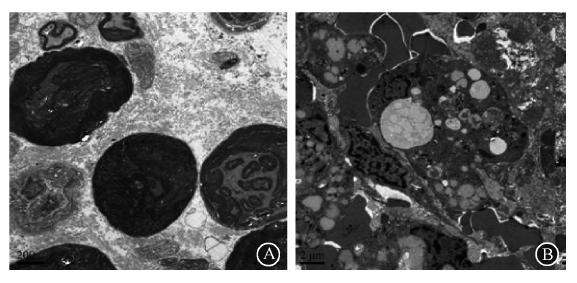 | 图 5 裸鼠模型药物干预后瘤体大体标本电镜观察 A.对照组:瘤细胞生长活跃,染色质均匀分布于核内 ×5 000;B.低剂量组:可见瘤细胞坏死,结构破坏,核膜崩解,细胞内见巨大脂质空泡,线粒体数目减少核仁未见 ×3 000 |
7.裸鼠模型瘤体免疫组织化学检测:IL-11受体阳性表达主要分布在MHCC-97H肝癌细胞壁,胞质内有少量表达,Ki67阳性表达位于细胞核,Bcl-2阳性表达位于胞质或胞膜。对照组肿瘤细胞大小不一,核分裂相多见,明显异型性,IL-11受体表达阳性率(84.13±5.71)%;低剂量组瘤细胞排列相对疏松,细胞内染色数量明显减少,IL-11受体表达阳性率为(61.57±5.98)%,与对照组比较,差异有统计学意义(t=13.62,P<0.05)。而尾静脉注药组的Ki-67、Bcl-2两种蛋白表达水平较空白对照组均明显降低(t=20.91、6.68,P<0.05,图 6)。
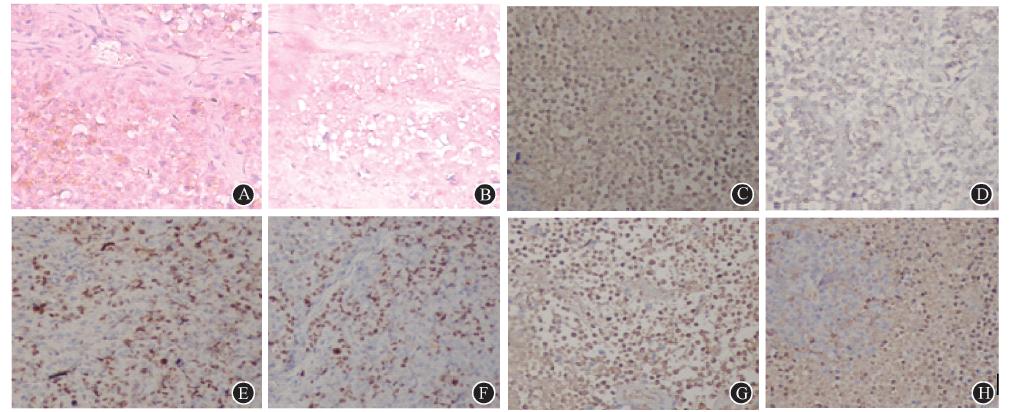 | 图 6 裸鼠模型瘤体免疫组织化学检测 EnVision两步法 ×200 A、B. IL-11受体阳性表达(对照组、低剂量组); C、D. Ki-67阳性表达 (对照组、低剂量组); E、F. Bcl-2阳性表达(对照组、低剂量组); G. Ki-67阴性表达组; H. Bcl-2阴性表达组 |
8. 裸鼠模型瘤体Western blot检测:不同剂量153Sm-DTPA-c(CGRRAGGSC)放射性药物作用MHCC97-H肝癌细胞后IL-11受体表达水平均降低,4组治疗前相对灰度均为4.43±0.17,放射性药物干预后,高、中、低剂量组和对照组相对灰度分别为1.36±0.15、1.89±0.24、2.79±0.32、4.43±0.17,与治疗前比较,各治疗组差异有统计学意义(t=335.63、278.45、131.76,P<0.05),高、中剂量组下调最为明显(图 7)。
 | 注:1.高剂量组; 2.中剂量组; 3.低剂量组; 4.对照组图 7 Western blot检测153Sm-DTPA-c(CGRRAGGSC) 干预后肿瘤组织IL-11受体蛋白的表达 |
IL-11是一种结构独特的细胞因子,在正常体内极少能够检测到,然而在某些病毒感染和肿瘤中,IL-11表达明显增多。与之对应的,某些恶性肿瘤如骨肉瘤、前列腺癌、乳腺癌等细胞IL-11受体显著上调[1, 2, 3, 4]。目前尚未检索到肝癌细胞中IL-11受体表达上调的证据。肝癌是我国高发的恶性肿瘤之一,其复发转移治疗一直是临床治疗难题。人MHCC97-H肝癌细胞是一种具有高转移潜能的细胞系,能够持续传代,生物性状稳定,极易发生转移,其实验动物模型是研究肝癌复发转移的理想平台。在前期对PC-3等细胞进行IL-11受体蛋白印迹分析的基础上,本研究对MHCC97-H肝癌细胞及多种恶性肿瘤细胞进行Western blot分析发现, MHCC97-H肝癌细胞IL-11受体蛋白表达量最高,接近正常肝细胞 HHL-5的5倍,从而提示MHCC97-H肝癌细胞可以作为研究肝癌及复发转移的良好目标。
放射性药物在肝癌及复发转移灶动物模型体内具有较高靶向性是保证疗效的关键。由于放射性核素153Sm具有γ射线诊断显像及β射线治疗的双重优良特性,并且容易获得,故本实验采用153Sm标记环九肽c(CGRRAGGSC)。在前期合成放射性药物153Sm-DTPA-c(CGRRAGG SC并对前列腺癌PC-3细胞进行靶向抑制研究的基础上,本实验探讨153Sm-DTPA-c(CGRRAGGSC)与MHCC-97H肝癌细胞的特异性结合情况,对其生物活性进行检测发现:受体分析饱和性实验和竞争抑制结合实验表明其生物活性并未发生明显改变;其与IL-11受体结合的Kd值(0.38±0.05)nmol/L及Bmax (768±52)fmol/mg蛋白证实二者结合具有足够的亲和力,证明环九肽能与MHCC-97H肝癌细胞表面膜受体进行特异性结合,符合作为配基的要求。
体内抑瘤实验结果显示4组荷瘤裸鼠尾静脉注射相应试剂后,生理盐水对照组和低剂量组肿瘤生长较快,中高剂量组肿瘤生长较慢,16 d后测量肿瘤体积示,153Sm-DTPA-c(CGRRAGGSC)组与对照组间比较,差异有统计学意义,说明153Sm-DTPA-c(CGRRAGGSC)对MHCC-97H肝癌肿瘤组织细胞具有明显的高亲和力,不同剂量放射性药物通过尾静脉注射,均能够比较迅速且长时间地聚集在瘤体位置、血液及其他器官能迅速排空。光镜和电镜观察到低剂量组肿瘤细胞排列疏松,有大片凝固样坏死及大量纤维结缔组织,残存癌灶中可见少数瘤细胞,体积增大,细胞结构破坏,核分裂相不明显,核固缩、核碎裂、核溶解多见,胞内出现空泡。随抑瘤增加,细胞出现坏死改变越显著。结合Western blot检测放射性药物干预后肿瘤组织IL-11受体蛋白情况,表明153Sm-DTPA-c(CGRRAGGSC)通过靶向结合肿瘤细胞的IL-11受体,定位且持久的杀伤肿瘤细胞,机体中的低表达或不表达IL-11受体的细胞则相对受到了保护,抑瘤效应与放射性药物之间存在显著的量效关系,因此,153Sm-DTPA-c(CGRRAGGSC)有着明显的肿瘤组织特异性。[JP+1]
Ki67是一种与增殖细胞紧密相关的核抗原,是能有效评估肿瘤细胞增殖活性的重要标志物[10]。从本研究免疫组织化学相关检测结果显示低剂量组Ki67阳性表达率较对照组明显下降说明153Sm-DTPA-c(CGRRAGGSC)对肿瘤的增殖存在直接抑制作用。不同剂量放射性药物作用各组肝癌细胞IL-11受体表达下调的Western blot结果也证明了放射性药物153Sm-DTPA-c(CGRRAGGSC) 能够特异性结合MHCC97-H肝癌细胞,并发挥靶向抑制作用。Bcl-2是能特异性抑制细胞凋亡的"存活基因",可以保护肿瘤细胞免受各种诱导剂诱发的凋亡,但不影响肿瘤细胞增殖,在凋亡的肿瘤细胞中,Bcl-2表达水平明显下降[11, 12]。本实验前期研究观察到153Sm-DTPA-c(CGRRAGGSC)放射性药物对肿瘤细胞的作用不仅有直接杀伤作用,被作用细胞还表现出凋亡率增加,均阻滞于G或G1期[7]。本研究中,免疫组织化学Bcl-2阳性表达率亦低于对照组,从侧面印证153Sm-DTPA-c(CGRRAGGSC)放射性药物对恶性肿瘤细胞的作用机制比较复杂,能够促进肿瘤组织凋亡增加,即可能存在着直接抑制及促进凋亡的综合作用。
综上所述,153Sm-DTPA-c(CGRRAGGSC)能够直接与MHCC97-H肝癌瘤体的特异性结合,表现出直接抑制及促进凋亡作用,并促进IL-11受体表达下调,为进一步应用于肝癌及复发转移的个体化治疗研究提供了实验依据。
| [1] | Ernst M, Najdovska M, Grail D, et al. STAT3 and STAT1 mediate IL-11-dependent and inflammation-associated gastric tumorigenesis in gp130 receptor mutant mice[J]. J Clin Invest, 2008, 118(5):1727-1738. |
| [2] | Nandurkar HH, Hilton DJ, Nathan P, et al. The human IL-11 receptor requires gp130 for signalling: demonstration by molecular cloning of the receptor[J]. Oncogene,1996,12 (3):585-593. |
| [3] | Campbell CL, Jiang Z, Savarese DM, et al. Increased expression of the interleukin-11 receptor and evidence of STAT3 activation in prostate carcinoma[J]. Am J Pathol,2001,158(1):25-32. |
| [4] | Arap W, Kolonin MG, Trepel M, et al. Steps toward mapping the human vasculature by phage display[J]. Nat Med,2002,8(2):121-127. |
| [5] | Zurita AJ, Troncoso P, Cardó-Vila M, et al. Combinatorial screenings in patients: the interleukin-11 receptor alpha as a candidate target in the progression of human prostate cancer[J]. Cancer Res,2004,64(2):435-439. |
| [6] | 吴清华,刘璐,黄庆娟,等. 99Tcm-DTPA-环九肽用于前列腺癌骨转移白细胞介素11受体显像实验研究[J]. 中华核医学杂志, 2010, 30(6):403-408. |
| [7] | 吴清华,刘璐,杨泽萱,等. 153Sm标记环九肽对人前列腺癌PC-3细胞的直接抑制作用[J]. 中华核医学杂志, 2011,31(4):241-244. |
| [8] | 杨泽萱,刘璐,吴清华,等. 白细胞介素-11类似物c(CGRRAGGSC)与人前列腺癌PC-3细胞的特异性结合研究[J]. 中华实验外科杂志,2011,28(4):303-308. |
| [9] | Wang W, Ke S, Kwon S, et al. A new optical and nuclear dual-labeled imaging agent targeting interleukin 11 receptor alpha-chain[J]. Bioconjug Chem,2007,18(2):397-402. |
| [10] | Jalava P, Kuopio T, Juntti-Patinen L, et al. Ki67 immunohistochemistry: a valuable marker in prognostication but with a risk of misclassification: proliferation subgroups formed based on Ki67 immunoreactivity and standardized mitotic index[J]. Histopathology,2006, 48(6):674-682. |
| [11] | Yang WY, Liu CH, Chang CJ, et al. Proliferative activity, apoptosis and expression of oestrogen receptor and Bcl-2 oncoprotein in canine mammary gland tumours[J]. J Comp Pathol, 2006, 134(1): 70-79. |
| [12] | 朴春南, 田梅, 刘建香, 等. 氡诱发小鼠肺损伤与P53和Bcl-2、Bax蛋白表达的研究[J]. 中华放射医学与防护杂志, 2009,29(2),196-198. |
 2015, Vol. 35
2015, Vol. 35