1. 主要试剂:RPMI 1640培养基(美国GIBCO公司),优质新生牛血清(中美合资民海生物工程有限公司),Calyculin A(CA,美国Sigma公司),秋水仙素(英国Cambia公司),hepes(北京Solarbio公司),植物血凝素(PHA,广州市达辉生物技术有限公司),1号、4号全染色体探针(德国MetaSystems公司)。
2. 血样采集与照射:血样采自3名健康男性自愿献血者(献血者知情同意),年龄28~32岁,平均年龄(28.5±1.5)岁,无烟酒嗜好,近期内未进行过任何医学诊断或治疗,也未接触过有毒有害化学物质,每人采集肘静脉血10 ml,平均分装在0.5 ml的无菌EP管内,肝素抗凝,将抗凝血样放置于固体水的插孔中,在照射样本下面放置5 cm厚的固体水,用直线加速器X射线照射,X射线的能量为6 MV,吸收剂量率为400 cGy/min,源靶距为100 cm,照射野为10 cm×10 cm,吸收剂量为0、1、5、10、15和20 Gy,照后血样立即置37℃培养箱中静置1.5 h以后培养。
3. 细胞培养和收集PCC:将静置后的血样混匀,加入含有20%新生牛血清的5 ml RPMI 1640 培养基中(含0.2 mg/ml PHA、20 mmol/L hepes,培养基预先在37℃培养箱中预热1~2 h)充分摇匀,放于37℃、5%CO2恒温二氧化碳培养箱内培养52 h,培养24 h后加入秋水仙素,终浓度为0.03 μg/ml,继续培养至收获前2 h加入CA,终浓度为40 nmol/L,每个剂量点培养细胞2~3瓶。培养后收获细胞,常规低渗、固定、制备细胞悬液。
4. 荧光原位杂交实验:细胞悬液混匀滴片,避光取1、4号探针各5 μl,充分混匀后加到玻片上,封片,75℃变性2 min,37℃水浴过夜,72℃ pH 7.1的0.4×SSC洗片2 min,室温pH 7.06的2×SSC,0.05%Tween-20洗片30 s,70%的乙醇脱水、晾干,加15 μl DAPI复染,10 min以后荧光显微镜下观察。
5. 镜检:日本Olympus BX 60荧光显微镜镜下观察。选用1、4号组合全染色体探针。1号全染色体探针由异硫氰酸荧光素(FITC)标记,绿色荧光,4号全染色体探针由罗丹明(RHOD)标记,红色荧光,PCC中各个细胞周期的染色体形态不一,G1期的染色体为单线状,S期为粉末状,G2/M期染色体为双线状。单线状染色体正常分裂相含4条红色(4号)和4条绿色(1号)染色体,双线状染色体正常分裂相含2条红色和2条绿色染色体,荧光显微镜下观察S期细胞无法分辨是否有畸变,因此,仅计数G1、G2/M期阳性细胞和断片数。G1期细胞橙色或绿色荧光信号多于4个记为阳性细胞,多余的荧光信号记为断片,G2/M期细胞橙色或绿色荧光信号多于2个记为阳性细胞,多余的荧光信号记为断片,计算阳性细胞率和染色体断片率,阳性细胞率(%)=阳性细胞数/观察细胞数×100%,断片率为每个细胞所含有的断片数。
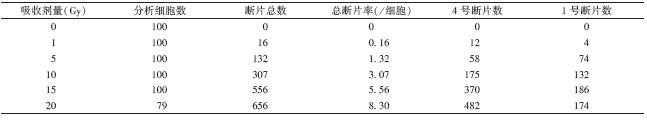
[TP03马娅t01.TIF;S*1;Z1;Y,X,BP#][TS(][HT6SS][HT6H][STHZ]图 1 [STBZ][HTSS] [HT3.][TS)]
1. 染色体畸变阳性细胞数:X射线照射后,CA联合秋水仙素培养收获,1和4号全染色体探针杂交,荧光显微镜下观察,G2/M期细胞的染色体呈双线状存在,2个红色信号,4个绿色信号,表示4号染色体无畸变,1号染色体有畸变,记为阳性细胞(图 1A);G1期细胞,染色体呈单线状存在,着丝粒不能分辨。红色和绿色信号均为5个,表示1和4号染色体均有畸变,记为阳性细胞(图 1B)。X射线照射后,随着照射剂量的增加,1和4号染色体畸变的阳性细胞数和阳性细胞率也随之增加,当照射剂量达到15 Gy时,畸变的阳性细胞率为98%,阳性细胞已经达到饱和,照射剂量大于15 Gy时就不能准确反映畸变情况,因此,剂量范围在0~15 Gy时,阳性细胞和照射剂量呈现良好的剂量-效应关系,Y=0.008+0.065D+1.858×10-5D2(R2=0.994)。
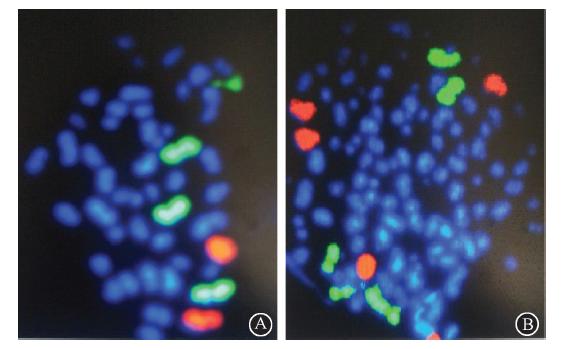 | 图 1 1、4号荧光标记的全染色体探针与早熟凝集染色体 荧光原位杂交 ×100 A. G2/M期阳性细胞,1号染色体有一个 断片;B. G-1期阳性细胞,1、4号染色体各有一个断片 |
2. 染色体断片数:在荧光显微镜下计数荧光信号的个数,正常的G2/M期细胞的标记染色体的荧光信号为两个,G1期细胞的标记染色体荧光信号为4个,超过的信号数记为断片数。把染色体断片数作为观察对象,由表 1可以看出,随着照射剂量的增加,断片数呈增加趋势,分别计数两条染色体的断片数及总断片数,拟合剂量-效应曲线,见图 2,可以看出,3项观察指标拟合的剂量-效应曲线均符合二次多项式模式,剂量-效应关系良好。从表 1可以看出,染色体含量高于4号的1号染色体断片数反而比4号染色体要少,对于这一结果尚需进一步研究。
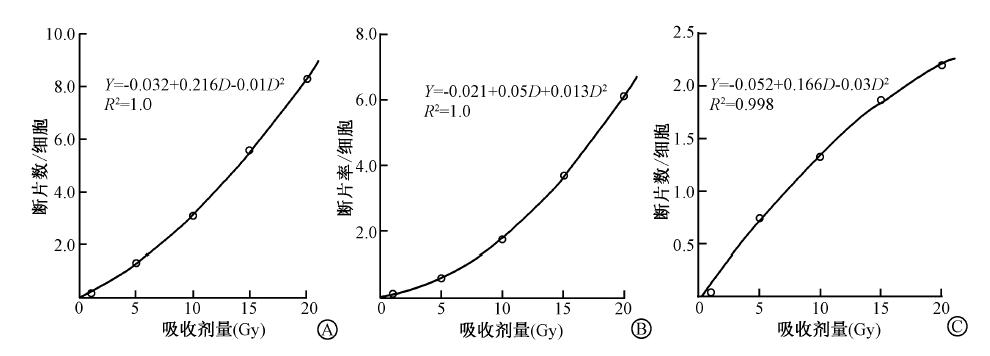 | 图 2X射线照射后荧光显微镜下观察到的染色体断片与照射剂量拟合的剂量-效应曲线 A.1、4号染色体总断片拟合曲线; B.4号染色体断片拟合曲线; C.1号染色体断片拟合曲线 |
| 表 1 不同剂量X射线照射后1、4号染色体 |
PCC技术是近年来不断完善发展的一项技术[2, 3, 4],化学诱导剂CA和OA的出现能够使外周血淋巴细胞在G1、G2/M期发生PCC,即便是在大剂量照射的情况下仍然能够获得足够分析的早熟凝集染色体。因此,可以用于大剂量照射后的染色体畸变分析,弥补常规染色体培养方法在大剂量照射后因为外周血淋巴细胞急剧减少、细胞周期阻滞、细胞死亡等原因所造成的不能获得足够分析的中期分裂相的不足。CA和OA相比较,其诱导活性是OA的20倍[5]。目前,国内外对电离辐射诱导PCC的研究中,观察指标主要有PCC环和PCC断片。Balakrishnan等[6]用OA诱导PCC,在培养48 h后获得PCC,并建立剂量-效应曲线,在0~24.5 Gy剂量范围内,PCC环和PCC断片与照射剂量均呈线性关系。Puig等[7]用CA+秋水仙素诱导PCC,在20 Gy范围内照射9个剂量点,PCC环和PCC断片与照射剂量呈线性关系。Romero等[8]用PCC环估算大剂量局部照射。Lamadrid等[9]用PCC环估算了中子照射后的生物剂量。但显微镜下观察PCC实心环和肾形环不易与染色体断片区分,因此,分析时存在一定的困难,另外,因为化学诱导剂诱导的PCC大部分都呈单体形式存在,因此,在计数PCC断片数的时候也存在一定的难度。全染色体涂染FISH技术能直接、清楚地在荧光显微镜下显示被观察染色体是否存在异常,对于畸变能够快速清楚地识别。本研究把FISH和PCC技术结合,观察大剂量照射后染色体畸变情况,既利用了早熟染色体凝集技术能够诱导足够多的染色体的优点,又克服了普通显微镜下分析困难的不足。本实验选择了在整组染色体中DNA含量较高的1号和4号染色体作为观察对象,以畸变细胞数、断片数作为观察指标,一组染色体中如果观察到多余的荧光信号则视为畸变细胞,在0~15 Gy剂量范围内,畸变细胞数和剂量呈良好的剂量-效应关系,但是在剂量达到15 Gy的时候,畸变细胞数已经接近100%,所以,用阳性细胞作为观察指标的时候,不适用于照射剂量大于15 Gy。而用1、4号染色体断片数作为观察指标的时候则不存在这个问题,本研究分别分析了1、4号染色体断片总数和1、4号染色体断片数与照射剂量之间的关系,1号断片数、4号断片数及断片总数与照射剂量均呈现良好的剂量-效应关系,拟合剂量-效应曲线均符合二次多项式模式,相关系数接近1。男性1号染色体整条染色体的基因组含量百分比为8.28%[10],比4号染色体的6.39%要高,有研究表明辐射诱发的染色体断裂在染色体上的分布是随机的,即每条染色体上发生的染色体断裂的概率与该染色体的DNA含量或物理长度成正比,而本研究发现染色体含量高于4号的1号染色体断片数反而比4号染色体要少,这一问题尚需进一步观察研究。总之,认为FISH技术和PCC相结合,能够直观、快速、准确地观察大剂量照射后染色体畸变情况,为大剂量照射后的剂量估算提供一种新的估算手段。
| [1] | 陈英,骆亿生,曹珍山,等. 特大剂量γ射线照射的染色体畸变剂量效应曲线[J]. 辐射研究与辐射工艺学报,2006,24(4):241-244. |
| [2] | Miura T, Blakely WF. Optimization of calyculin A-induced premature chromosome condensation assay for chromosome aberration studies[J]. Cytometry A,2011,79(12):1016-1022. |
| [3] | Lamadrid Boada AI, Romero Aguilera I, Terzoudi GI, et al. Rapid assessment of high-dose radiation exposures through scoring of cell-fusion-induced premature chromosome condensation and ring chromosomes[J]. Mutat Res,2013,757(1):45-51. |
| [4] | Gotoh E, Tanno Y. Simple biodosimetry method for cases of high-dose radiation exposure using the ratio of the longest/shortest length of Giemsa-stained drug-induced prematurely condensed chromosomes (PCC)[J]. Int J Radiat Biol,2005,81(5):379-385. |
| [5] | Kanda R, Eguchi-Kasai K, Hayata I. Phosphatase inhibitors and premature chromosome condensation in human peripheral lymphocytes at different cell-cycle phases[J]. Somat Cell Mol Genet, 1999, 25(1): 1-8. |
| [6] | Balakrishnan S, Shirsath K, Bhat N, et al. Biodosimetry for high dose accidental exposures by drug induced premature chromosome condensation (PCC) assay[J]. Mutat Res,2010,699(1-2):11-16. |
| [7] | Puig R, Barrios L, Pujol M,et al. Suitability of scoring PCC rings and fragments for dose assessment after high-dose exposures to ionizing radiation[J]. Mutat Res, 2013,757(1):1-7. |
| [8] | Romero I, García O, Lamadrid AI,et al. Assessment of simulated high-dose partial-body irradiation by PCC-R assay[J]. Radiat Res,2013,54(5):863-871. |
| [9] | Lamadrid AI, González JE, García O,et al. Prematurely condensed chromosome rings after neutron irradiation of human lymphocytes [J]. Radiat Res,2011,52(4):531-535. |
| [10] | 白玉书,陈德清.人类辐射细胞遗传学[M]. 北京:人民卫生出版社,2006:161-162. |
 2015, Vol. 35
2015, Vol. 35