2. 中国石油化工股份有限公司青岛安全工程研究院
随着核能和电离辐射源的广泛应用,受到低剂量电离辐射长期慢性照射的职业人员和公众日益增多,低剂量电离辐射对机体的健康效应研究成为国内外众多学者关注的焦点[1]。电离辐射可通过直接作用于DNA分子引起DNA单链或双链断裂损伤或通过产生活性氧自由基(ROS)间接对DNA分子造成损伤[2]。其中ROS对DNA分子的氧化损伤所形成的主要产物是8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)。硫氧还蛋白还原酶(thioredoxin reductases,TrxR)是一类广泛存在于原核和真核生物体内的小分子蛋白质,具有消除生物体内ROS的抗氧化作用,减少体内8-OHdG的产生,在生物体内氧化还原平衡的维持和生物信号传导调控过程中发挥重要作用。目前高剂量电离辐射的生物学效应研究已比较明确和完善,而对于低剂量电离辐射对机体的生物学效应研究仍然存在争议。许多实验证实低剂量电离辐射预处理受试对象后,可产生对随后相对高剂量照射诱发损伤的抗性,对人体的作用可能存在与传统线性无阈理论不同的适应性反应[3]。前期相关研究结果表明,阳江高本底辐射地区居民外周血中六氧甲基鸟嘌呤-DNA-甲基转移酶(MGMT)和人8-羟基鸟嘌呤DNA糖苷酶(hOGG1)表达水平均有所升高,提示低剂量电离辐射可能增强DNA损伤修复能力[4, 5]。本研究选择广东阳江高本底辐射地区人群作为研究对象,探讨长期接受低剂量电离辐射对人群氧化损伤及抗氧化水平的影响,以期为长期低剂量电离辐射对人群健康效应及低剂量电离辐射诱导适应性反应的机制研究提供一定的科学依据和理论基础。
1. 研究对象:选择天然高本底辐射地区(high background radiation area,HBRA)的48名46~60岁男性居民(要求在阳江市阳西县某镇出生并长大,近3年在其他地方居住过≥6个月的除外)作为研究对象(HBRA组),另在对照地区(control area,CA)恩平市某镇选择条件匹配的48名男性居民作为对照人群(CA组)。2组人群的经济、文化水平相当,饮食习惯相同。排除标准为:具有肿瘤家族史、慢性病、阳光过敏者、最近1个月内有服药史、急性感染性疾病者。本研究经广东省职业病防治院医学伦理委员会批准,所有研究对象均知情同意。
2. 仪器和试剂:8-OHdG ELISA试剂盒(武汉华美生物工程有限公司),TrxR ELISA试剂盒(武汉华美生物工程有限公司),热释光剂量读出器Fg-427A1(北京防化研究院),酶标仪MK3(上海科华KHB公司)。
3. 现场调查:采用自行设计的调查问卷,由经过统一培训的调查员采用面对面询问的方式采集研究对象的基本信息,填写调查问卷。问卷调查内容:2组人群的年龄、生活习惯(吸烟、饮酒、喝茶史)、既往患病与服药情况、医疗照射史、居住史和生活应激事件,包括躯体性应激事件如半年内有手术、烧伤、失血等事件和心理性应激事件如半年内有亲人去世、离婚、破产等造成心灵创伤的事件等相关情况。
4.人群年外照射剂量的估算:在HBRA和CA地区各选择48名居民进行个人累积剂量的测量。通过佩戴热释光剂量计(TLD)测定两地人群的外照射剂量,佩戴位置确定在人员的腰部,佩戴时间为90 d,每个月对调查对象的佩戴情况进行检查核实,季度个人外照射累积剂量在广东省职业病防治院放射防护个人剂量室用Fg-427A1型热释光剂量计分析读出,年外照射剂量=90 d外照射剂量×4。
5. 血浆中8-OHdG及TrxR的浓度测定:现场抽取2组人群空腹外周血10 ml,肝素抗凝,低温冷藏运输保存,400×g离心(离心半径为12.4 cm) 10 min,分离上层血浆备用。具体操作方法按照ELISA说明书步骤,分别测定血浆中8-OHdG和TrxR水平,每个样本设置3个复孔。
6. 统计学处理:问卷调查资料利用Epidata 3.02录入数据库,利用SPSS 16.0软件进行分析。计量资料采用x±s描述。2组间均数比较采用完全随机设计成组t检验(方差齐);计数资料的比较采用χ2检验;影响因素分析采用多元线性回归分析。P<0.05为差异有统计学意义。
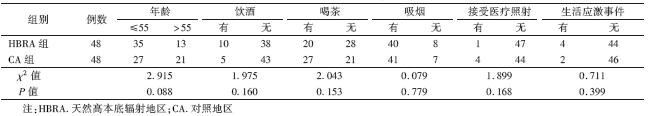
1. 一般情况:HBRA组年龄为46.0~60.0(53.5±3.4)岁;CA组年龄为47~60.0(54.5±3.6)岁。2组人群年龄、饮酒、喝茶、吸烟、接受医疗照射和生活应激事件等构成比分别比较,差异均无统计学意义,具有可比性(表 1)。
| 表 1 2组人群一般情况比较(例数) |
2. 2组人群年外照射剂量测量结果:每组发出TLD各48个,其中CA组回收40个,回收率83.3%,HBRA组回收45个,回收率93.8%;CA和HBRA组人群的年外照射有效剂量分别为0.72~1.96 (1.22±0.34)和1.36~4.84 (3.51±0.78)mSv/年。
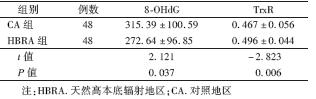
3. 2组人群血浆中8-OHdG和TrxR水平的比较:结果列于表 2。由表 2可知,与CA组相比,HBRA组外周血血浆中8-OHdG水平明显降低, TrxR水平明显升高,差异有统计学意义(t=2.121,-2.823,P < 0.05)。
| 表 2 2组人群外周血血浆中8-OHdG和TrxR(ng/ml,x±s) |
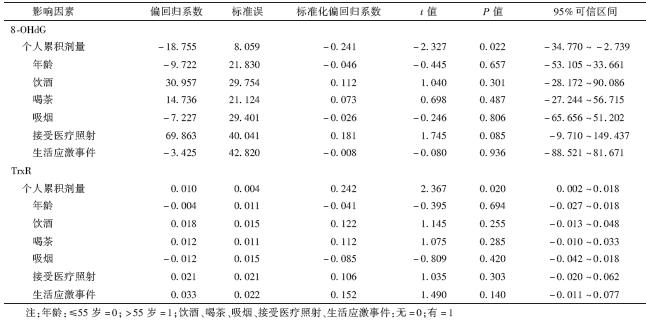
4. HBRA人群血浆中8-OHdG和TrxR水平的影响因素分析:以低剂量电离辐射个人累积剂量、年龄、饮酒、喝茶、吸烟、接受医疗照射、生活应激事件为自变量,分别以8-OHdG和TrxR水平为因变量进行多元回归分析。结果显示,在排除年龄、饮酒、喝茶、吸烟、接受医疗照射、生活应激事件等混杂因素的影响后,低剂量电离辐射个人累积剂量对8-OHdG和TrxR水平均有影响(t=-2.327、2.367,P<0.05),进一步印证了上述表 2中2组人群外周血血浆中8-OHdG和TrxR水平检测结果,具体结果详见表 3。
| 表 3 血浆中8-OHdG和TrxR水平影响的多元线性回归分析结果 |
国内外对于高剂量电离辐射的生物学效应研究较充分和深入,其效应主要包括DNA损伤及其功能与代谢变化、DNA损伤修复及其遗传学控制、RNA结构与功能的变化、染色质的辐射生物效应、蛋白质和酶的辐射生物效应、能量代谢障碍和辐射致癌等方面内容。但低剂量电离辐射对于机体的生物学效应,仍存在着一定的争议。目前,对低剂量电离辐射的生物效应存在两种不同的理论认识,一是随机性效应的线性无阈理论(linear no threshold theory,LNT),二是在低剂量范围内有阈的适应性反应(adaptive response,AR)理论。近年的实验研究发现,小剂量电离辐射对人体作用可能存在与传统线性无阈理论不同的适应性反应。我国阳江天然辐射高本底地区(HBRA)及其邻近恩平对照地区(CA)人群的队列研究结果表明,两地区具有良好的可比性[6]。此外,大规模的人群流行病学研究也发现,高本底地区居民癌症死亡率低于对照地区,认为机体氧化损伤与修复调节在适应性反应机制中起着一定的作用[7]。
电离辐射作用于机体产生的ROS,未被机体及时清除可引起DNA分子的多种氧化损伤,其中主要的损伤形式为碱基修饰,表现为特异性碱基丢失,邻近嘧啶的错读,以及损伤部位腺嘌呤的错误插入,绝大部分碱基受损部位位于dG的C8位置,形成的主要产物是8-OHdG[8]。而8-OHdG还是一种参与DNA合成的强致突变产物,在DNA复制过程导致A:T→C:G以及G:C→T:A颠换,这种颠换与肿瘤的发生发展、机体细胞的老化和某些退行性疾病均有密切的关系[9]。Kasai[10]在早期的研究中认为8-OHdG在体内稳定且生成量大,血浆中的8-OHdG能代表DNA氧化损伤的理想生物标志物。但近期关于氧化应激的研究也出现了其他的观点。Nakajima等[11]研究认为,8-OHdG水平是自由基诱导的DNA损伤中最主要的氧化产物形式,均可在人类组织和血样本中检测出来,但由于尿中8-OHdG水平检测是一种无创的、不涉及技术问题的检测方法,因此,认为尿中8-OHdG水平可作为细胞氧化应激的重要生物标志物。Kocael等[12]进行了一项对病态肥胖患者腹腔镜下胃绑扎术后血清和尿液中8-OHdG水平与体重下降的关联研究,认为尿中的8-OHdG水平由于具有快速检测、简易、花费较少等优点而推荐在临床广泛应用。结合上述的相关研究结果及观点,本研究目前选择外周血血浆中的8-OHdG水平作为研究指标以反映两地居民的DNA氧化损伤水平,同时间接反映机体的DNA氧化损伤修复能力。在后续的研究中,会进一步结合尿液中8-OHdG水平检测进行补充完善。
通常情况下,ROS会很快被体内的抗氧化系统清除,这些抗氧化系统包括酶系统和非酶系统。非酶系统中的硫氧还蛋白(Trx)是一种重要的氧化还原平衡调节蛋白质,TrxR通过清除ROS以及调控一些蛋白质的氧化还原,调节机体氧化还原平衡,在生物机体内的抗氧化胁迫与修复其造成的相关损伤的调控过程中具有重要的作用。Trx还可与硫氧还蛋白还原酶(TrxR)以及NADPH共同构成Trx硫氧还蛋白系统,具有修复被氧化蛋白质、消除生物体内氧自由基的抗氧化作用。
前期的相关研究已对阳江高本底地区居民癌效应、遗传效应、染色体畸变、免疫功能等方面进行了比较系统的研究,但对DNA氧化损伤和抗氧化非酶系统方面的指标研究较少。因此,本研究选择氧化损伤指标8-OHdG和抗氧化指标Trx观察低剂量电离辐射长期接触对人群的氧化损伤水平及抗氧化修复效应。结果发现,与CA组相比,HBRA居民外周血血浆中的8-OHdG表达水平显著降低,血浆中Trx的表达水平显著升高,提示HBRA居民在长期高本底辐射条件下的氧化损伤有所降低,而修复能力可能增强。其可能的原因在于机体氧化损伤修复能力的增强,可及时清除和修复氧化损伤产物8-OHdG,从而使血浆中8-OHdG表达水平降低。本课题组前期选择HBRA地区和CA地区50~59岁男性居民作为研究对象,分别采集其外周血和连续3 d的痰样,检测超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、非特异性过氧化物酶(CAT)、总抗氧化能力(T-AOC)、丙二醛(MDA)、热休克蛋白70(HSP70)、糖基化终产物受体(RAGE)和钙结合蛋白S100A6等表达水平。结果显示,与CA组相比,HBRA组人群SOD活力、GSH-Px活力、T-AOC含量较高,MDA含量较低,以上差异均具有统计学意义,CAT活力略高,但差异无统计学意义[13, 14]。Chen等[15]研究发现,给予8 Gy的γ射线辐照雄性MALB/c小鼠12 h,其血浆中SOD和GSH浓度显著降低,而MDA和8-OHdG水平则显著升高。其研究结果与本研究不同,原因在于该研究采用的是小鼠模型,且辐照剂量高于本研究高本底人群的辐照累计剂量。此外,Yamaoka等[16]也报道低剂量的电离辐射可以增强SOD的活性,抑制脂质过氧化作用。Eken等[17]报道,长期暴露于低剂量电离辐射的职业人群中机体抗氧化活性有所增强。本研究发现高本底地区居民DNA氧化损伤修复能力增强,与上述研究一致,提示天然放射性高本底辐射对机体的抗氧化能力有所增强。
综上所述,尽管国内外研究为探讨低剂量电离辐射诱导机体的适应性反应及其机制做了大量的工作,但目前关于低剂量电离辐射诱导机体出现适应性反应的相关研究依据尚不充分,对其中的机制还需进一步在体内外实验中深入探索。本研究通过初步探讨低剂量电离辐射对高本底地区人群的氧化损伤及抗氧化修复指标表达水平的影响,为低剂量电离辐射诱导机体适应性反应的机制及对人群健康效应研究提供一定的科学依据。
| [1] | Suzuki K,Yamashita S. Low-dose radiation exposure and carcinogenesis[J]. Jpn J Clin Oncol, 2012,42(7):563-568. |
| [2] | Azzam EI,Jay-Gerin JP,Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury[J]. Cancer Lett,2012,327(1-2):48-60. |
| [3] | Esposito G,Campa A,Pinto M,et al. Adaptive response: modeling and experimental studies[J]. Radiat Prot Dosim,2011,143(2-4):320-324. |
| [4] | 苏世标,邹剑明,耿继武,等. 高本底辐射居民DNA损伤修复能力研究[J]. 中国职业医学,2010,37(1):15-17. |
| [5] | 苏世标,靳雅丽,郭强之,等. 阳江高本底地区居民8-羟基脱氧鸟苷及其修复基因8-羟基鸟嘌呤DNA糖苷酶表达水平[J]. 中国职业医学,2012,39(6):467-470. |
| [6] | 查永如,邹剑明,陶祖范. 阳江高本底地区与对照地区调查人群可比性分析[J]. 中华放射医学与防护杂志,1999,19(2):83-86. |
| [7] | 王燕,孟庆勇. 低剂量电离辐射诱导适应性反应机制的研究进展[J]. 中国辐射卫生,2013,22(4):509-512. |
| [8] | William WA,Boris O,Carsten H. Assessing DNA damage and health risk using biomarkers[J]. Mut Res,2002,509(1-2):153-163. |
| [9] | Ide H,Kotera M. Human DNA glycosylases involved in the repair of oxidatively damaged DNA[J]. Biol Pharm Bull,2004,27(4):480-485. |
| [10] | Kasai H. Analysis of a form of oxidative DNA damage,8-hydroxy-2'-deoxyguanosine,as a marker of cellular oxidative stress during carcinogenesis[J]. Mut Res,1997,387(3):147-163. |
| [11] | Nakajima H, Unoda K, Ito T, et al. The relation of urinary 8-OHdG, a marker of oxidative stress to DNA, and clinical outcomes for ischemic stroke[J]. Open Neurol J,2012,6:51-57. |
| [12] | Kocael A, Erman H, Zengin K, et al. The effects on oxidative DNA damage of laparoscopic gastric band applications in morbidly obese patients[J]. Can J Surg,2014,57(3):183-187. |
| [13] | 苏世标,邹剑明,陈建雄,等. 高本高辐射居民机体抗氧化水平研究[J]. 中国职业医学,2009,36(4):278-280. |
| [14] | 耿继武,邹剑明,苏世标,等. 高本底辐射对居民机体外周血SOD和MDA的影响[J]. 中国辐射卫生,2010,19(1):8-9. |
| [15] | Chen C, Chen Z, Xu F, et al. Radio-protective effect of catalpol in cultured cells and mice[J]. J Radiat Res,2013,54(1):76-82. |
| [16] | Yamaoka F,Mitsunobut K,Hanamoto K,et al. Biochemical comparison between radon effects and thermal effects on humans in radon hot spring therapy[J]. J Radiat Res,2004,45(1):85-88. |
| [17] | Eken A,Aydin A,Erdem O. Induced antioxidant activity in hospital staff occupationally exposed to ionizing radiation[J]. Int J Radiat Biol,2012,88(9):648-653. |
 2015, Vol. 35
2015, Vol. 35