立体定向消融放疗(stereotactic ablative radiotherapy,SABR)又称体部立体定向放射治疗(stereotactic body radiation therapy,SBRT),因其肿瘤局部控制率高、安全性好,已广泛应用于不能或不愿手术的早期非小细胞肺癌患者,同时也常用于肺部寡转移灶患者[1, 2]。SABR的特点是单次剂量高(≥10 Gy/次),分次少(1~5次),边缘剂量梯度大,等效生物剂量(biological effective doses,BED)≥100 Gy。前期研究发现,肺癌SABR过程中,肿瘤在第2次照射后开始缩小[3]。为了验证肺癌SABR的靶区和治疗计划是否需要及时修订,设计了本研究进一步探讨。
1. 入组和排除条件:入组条件为经多重检查(病理、增强CT/PET-CT)并结合病史确诊为原发性早期非小细胞肺癌(T1N0M0或T2aN0M0)或肺部寡转移灶(数量≤3个);肿瘤最大直径≤5 cm;参考美国东部肿瘤协作组(ECOG),PS评分≤2或由于肺外因素致PS=3;第1秒用力呼气容积≥40%;患者可保持仰卧位自由呼吸至少15 min;签署放疗知情同意书。排除条件为既往有胸部肿瘤放疗史;出现肺部以外的多发转移,临床评估肺部SABR对控制患者肿瘤进展及延长生存期无意义。
2.一般临床资料:自2011年10月至2014年10月,本院放疗科收治66例拟行SABR的原发或转移性肺肿瘤患者,女25例,男41例;中位年龄66岁(41~86岁);共71枚肿瘤。患者临床资料见表1。
| 表1 66例肺SABR患者临床资料(枚) |
照射剂量40~55 Gy,4~5次/1~2周,每次治疗前经CT-on-rail系统或经锥形束CT(CBCT)系统摆位验证。其中,34枚肺肿瘤行CT-on-rail验证,37枚肺肿瘤行CBCT验证。经CT-on-rail系统摆位验证患者SABR的流程参见文献[3]。经CBCT系统摆位验证患者SABR的流程如下。
(1)体位固定和模拟定位:采用真空负压固定装置(Carlergo)固定患者体位,采用荷兰飞利浦公司大孔径16排螺旋CT模拟机(Phillip Brilliance TM Big Bore CT)于自由呼吸状态下自胸廓入口至肺底行螺旋扫描,先后采集3D和4D-CT图像。模拟机参数:电压120 kV,电流350 mAs,螺距0.938,层厚3 mm。借助带有传感器的弹性腹带记录呼吸周期,并将4D-CT图像按10%递增为1个时相(0~90%),使用呼吸时相融合控制技术,将10个时相的图像重建后得到最大密度投影图像(MIP)和平均密度投影图像(AIP)。所有图像传至美国Varian Eclipse治疗计划系统。
(2)靶区勾画:在Eclipse治疗计划系统中接收患者3D-CT和4D-CT扫描图像,由1名具有5年以上工作经验的放疗科医师进行靶区勾画。在3D-CT图像上选取合适的窗宽/窗位勾画大体肿瘤体积(GTV),即GTV3D,在4D-CT MIP图像上勾画内靶区(ITV)即ITVMIP,融合GTV3D和ITVMIP生成ITVCOMB,即本研究中采用的ITV,计划肿瘤靶区(PTV)由ITV在各方向上外扩5 mm生成[4]。
(3)计划制定:由具有2年以上工作经验的物理师制定放疗计划,要求至少100%的处方剂量包绕95%的PTV,大气管、大血管、胸壁、脊髓等危及器官及肺的剂量限制参考美国肿瘤放射治疗协作组(RTOG)0236号协议[1]。由医师审核确认治疗计划后传至CBCT验证及放疗实施系统(Varian TrueBeam 1407)拟行放射治疗。
(4)摆位验证:采用CBCT系统进行摆位验证,自胸廓入口扫描至肺底,系统重建后获得三维验证图像,采用肿瘤中心配准,头脚、腹背、左右方向上的摆位误差控制在1 mm以内。将每次治疗前验证图像传至Eclipse治疗计划系统。
(5)验证图像上的靶区勾画:由同一名医师在Eclipse治疗计划系统中调取每次CBCT摆位验证图像,选取合适的窗宽/窗位勾画靶区,参考Wang等[5]的研究将CBCT图像上的靶区分别命名为ITV1、ITV2、ITV3、ITV4、ITV5。
3. SABR过程中瘤体变化:在每次验证CT图像上勾画GTV或ITV,以首次验证时GTV或ITV为基准,求得分次间瘤体变化率,即肿瘤体积变化率(%)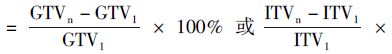 100%,其中,2≤n≤5。
100%,其中,2≤n≤5。
4. 修正计划的临界值设置:Siker等[6]报道在放疗期间肿瘤体积变化超过25%时,即应及时修订治疗计划以避免漏照或过度照射。杀灭肿瘤周围的亚临床病灶所需照射剂量一般为50 Gy[7],即生物等效剂量(BED)=60 Gy。本研究选择BED=60 Gy时肿瘤体积变化超过25%为修订原SABR计划的临界值。
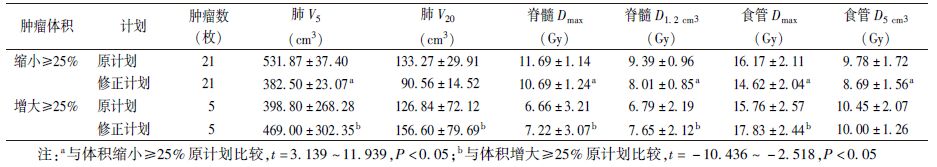
5. 修正计划(M-plan)和原计划(P-plan)危及器官剂量比较:选择照射剂量至BED 60 Gy时体积变化超过25%的肿瘤,回顾性修订其放疗计划,并进行M-plan和P-plan比较。用验证CT勾画靶区并与原计划CT配准,采用与P-plan相同的计划参数,所有计划在P-plan CT图像上完成。危及器官(OAR)选择临床常用的剂量-体积直方图(DVH)评估参数:肺V5、V20;食管Dmax、D5 cm3;脊髓Dmax、D1.2 cm3;胸壁D30 cm3。
6. 统计学处理:数据用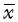 ±s表示。利用SPSS 22.0统计软件,对SABR过程中肿瘤体积进行广义估计方程分析。对体积变化超过25%的肿瘤的直径、位置和病理分型进行χ2检验,对P-plan和M-plan中危及器官的剂量-体积变化进行配对t检验。P<0.05为差异有统计学意义。
±s表示。利用SPSS 22.0统计软件,对SABR过程中肿瘤体积进行广义估计方程分析。对体积变化超过25%的肿瘤的直径、位置和病理分型进行χ2检验,对P-plan和M-plan中危及器官的剂量-体积变化进行配对t检验。P<0.05为差异有统计学意义。
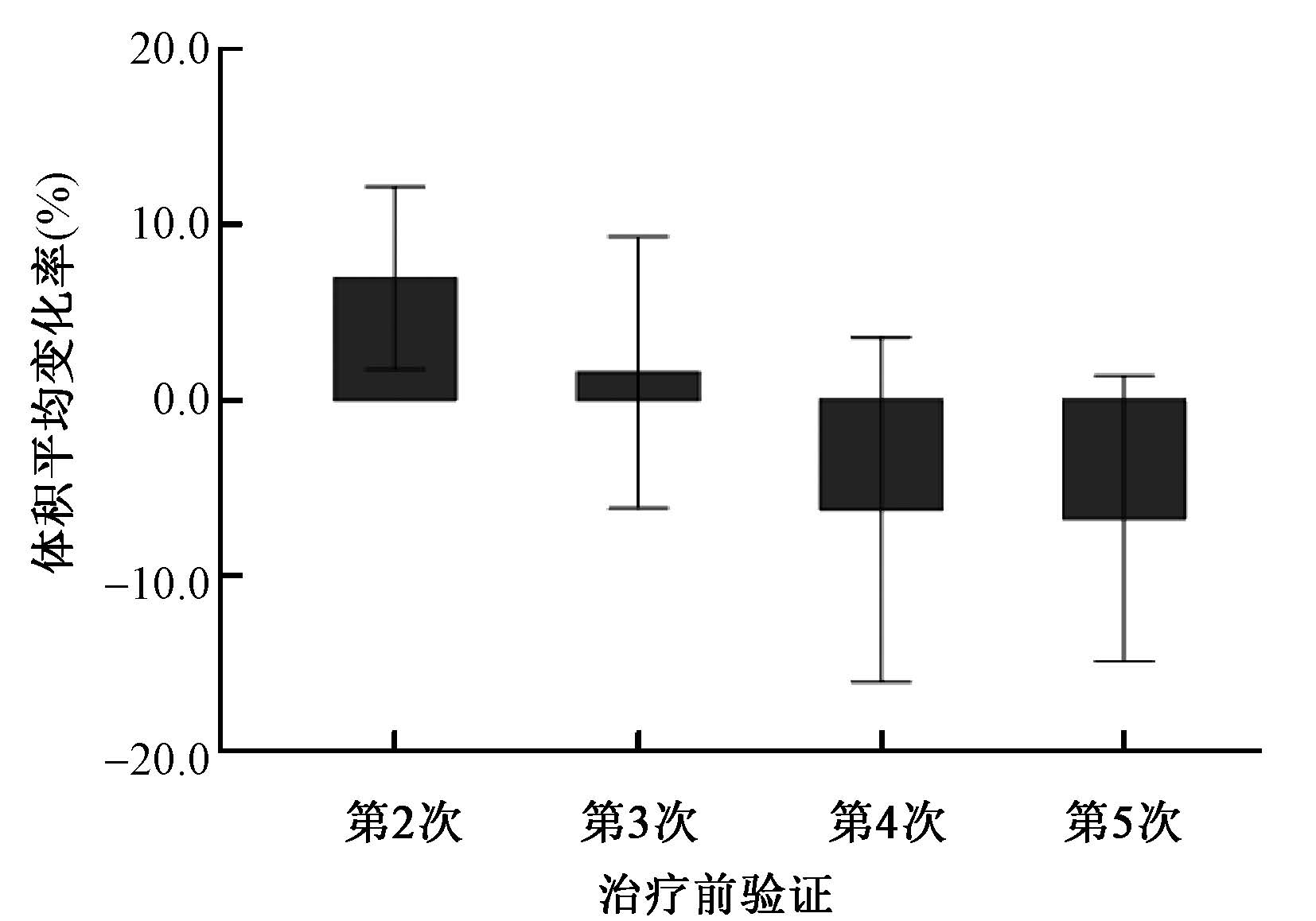
1. SABR过程中瘤体变化及影响因素:1例患者因严重放射性食管炎未能按原计划进行第5次照射,其余患者均顺利完成治疗。除1例患者第3次CT验证图像丢失外,共采集图像316幅(定位CT和验证CT图像)。在SABR过程中有49枚(69%)肿瘤缩小,21枚(30%)肿瘤增大,1枚(1%)肿瘤无明显变化,见图1。广义估计方程分析结果显示,SABR过程中瘤体变化无统计学意义(P=0.281),而直径≤3 cm的肿瘤较直径>3 cm的肿瘤瘤体缩小更明显(χ2=31.703,P< 0.001),肿瘤位置和分类与SABR过程中肺部肿瘤体积变化无明显相关(P>0.05)。
|
注:39枚肿瘤接受4分次照射,32枚肿瘤接受5分次照射 图1 SABR过程中肿瘤体积平均变化率 |
当照射剂量BED至60 Gy时,有26枚肿瘤(36.6%)体积变化超过25%。其中,5枚肿瘤体积增加(2枚增加超过50%),21枚肿瘤体积减小(3枚减小超过50%)。对其直径、位置和病理分型分别行χ2检验,结果显示,SABR过程中肿瘤体积的明显变化与其位置、直径和病理分型无明显相关(P>0.05)。
2. 比较BED为60 Gy时体积变化超过25%的26枚肿瘤OAR的DVH参数:结果见表2。体积缩小的21枚肿瘤的肺V5、脊髓Dmax和D1.2 cm3、食管Dmax和D5 cm3、胸壁D30 cm3差异均有统计学意义(t=3.139~11.939,P<0.05),体积增大的5枚肿瘤的肺V5和V20、脊髓Dmax和D1.2 cm3、食管Dmax、胸壁D30 cm3差异均有统计学意义(t=-10.436~-2.518,P<0.05)。
表2 26枚肿瘤危及器官的DVH参数比较(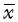 ±s) ±s)
|
尽管SABR提高了早期肺癌的局部控制率和生存率,但是仍面临着剂量提升和减少不良反应的挑战,特别是当肿瘤邻近脊髓、气管、食管和胸壁等重要结构时,靶区微小的变化就可能导致肿瘤的漏照和正常组织的过度照射[8, 9]。肺SABR患者胸壁接受剂量超过30 Gy时,胸壁损伤的发生率为20%~30%[10]。尽管肺SABR分割次数少,疗程短,肿瘤体积随着照射剂量的增加仍然可能发生变化。
本研究发现,在SABR过程中有49枚(69%)肿瘤缩小,21枚(30%)肿瘤增大,广义估计方程分析显示瘤体变化差异无统计学意义,这与Matsugi等[11]的研究结果一致。同时本研究还发现,肿瘤位置和肿瘤类型与瘤体变化亦无明显相关性;直径≤3 cm的肿瘤比直径>3 cm的肿瘤瘤体缩小明显。Dunlap等[12]的研究也发现,在早期肺癌SABR过程中直径≤3 cm的肿瘤较>3 cm者体积缩小迅速,且局部复发率更低。
本研究回顾性地对照射剂量BED=60 Gy,瘤体变化达25%的26枚肿瘤修订治疗计划,分析M-plan和P-plan的DVH参数,结果显示,瘤体缩小超过25%的21枚肿瘤的SABR计划的肺V5、食管Dmax和D5 cm3、脊髓Dmax和D1.2 cm3以及胸壁D30 cm3剂量较P-plan明显减低,而瘤体增大超过25%的5枚肿瘤的SABR计划的肺V5和V20、食管Dmax、脊髓Dmax和D1.2 cm3以及胸壁D30 cm3剂量较P-plan明显增大。由此可见,当肿瘤体积变化较大时,及时修正靶区和放疗计划,可以减少瘤体的漏照和OAR的过度照射。
本研究也存在一些不足之处,由于呼吸运动和呼吸幅度的影响,由CBCT和4D-CT生成的ITV存在一定的偏差[13],而且CBCT软组织对比度差,图像分辨率较低,勾画靶区时可能因肿瘤与周围结构分界不清可能会导致主观偏差。
综上所述,SABR过程中肺肿瘤体积的变化是动态的,但不是所有的患者都需要在治疗过程中修订放疗计划。肿瘤体积变化较大时,及时修订靶区和治疗计划可能使患者受益。
| [1] | Timmerman R,Paulus R,Galvin J,et al. Stereotactic body radiation therapy for inoperable early stage lung cancer [J]. JAMA, 2010, 303:1070-1076. |
| [2] | Rusthoven KE, Kavanagh BD, Burri SH, et al. Multi-institutional phase i/ii trial of stereotactic body radiation therapy for lung metastases[J]. J Clin Oncol, 2009, 27(10):1579-1584. |
| [3] | Sun Y, Lu Y, Cheng S, et al. Interfractional variations of tumor centroid position and tumor regression during stereotactic body radiotherapy for lung tumor [J]. BioMed Res Int, 2014, 2014:372738. |
| [4] | Ge H, Cai J, Kelsey CR, et al. Quantification and minimization of uncertainties of internal target volume for stereotactic body radiation therapy of lung cancer [J]. Int J Radiat Oncol Biol Phys, 2013, 85(2):438-443. |
| [5] | Wang Z, Wu QJ, Yin FF, et al. Cone-beam CT localization of internal target volumes for stereotactic body radiotherapy of lung lesions[J]. Int J Radiat Oncol Biol Phys, 2007, 69(5):1618-1624. |
| [6] | Siker ML, Tomé WA, Mehta MP. Tumor volume changes on serial imaging with megavoltage CT for non-small-cell lung cancer during intensity-modulated radiotherapy: how reliable, consistent, and meaningful is the effect? [J]. Int J Radiat Oncol Biol Phys, 2006, 66(1):135-141. |
| [7] | 殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 4版. 北京:中国协和医科大学出版社,2008. |
| [8] | Matsuo Y, Shibuya K, Nakamura M, et al. Dose-volume metrics associated with radiation pneumonitis after stereotactic body radiation therapy for lung cancer [J]. Int J Radiat Oncol Biol Phys, 2012, 83(4):e545-e549. |
| [9] | Nambu A, Onishi H, Aoki S, et al. Rib fracture after stereotactic radiotherapy for primary lung cancer: prevalence, degree of clinical symptoms, and risk factors[J]. BMC Cancer, 2013, 13:68. |
| [10] | Dunlap NE, Cai J, Biedermann GB, et al. Chest wall volume receiving > 30 Gy predicts risk of severe pain and/or rib fracture after lung stereotactic body radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2010, 76(3): 796-801. |
| [11] | Matsugi K, Narita Y, Sawada A, et al. Measurement of interfraction variations in position and size of target volumes in stereotactic body radiotherapy for lung cancer [J]. Int J Radiat Oncol Biol Phys, 2009, 75(2):543-548. |
| [12] | Dunlap NE, Larner JM, Read PW, et al. Size matters: a comparison of T1 and T2 peripheral non-small-cell lung cancers treated with stereotactic body radiation therapy (SBRT) [J]. J Thorac Cardiovasc Surg, 2010, 140(3):583-589. |
| [13] | Clements N, Kron T, Franich R, et al. The effect of irregular breathing patterns on internal target volumes in four-dimensional ct and cone-beam ct images in the context of stereotactic lung radiotherapy [J]. Med Phys,2013, 40(2):021904. |
 2015, Vol. 35
2015, Vol. 35