2. 300060 天津医科大学肿瘤医院肺部肿瘤科
肺癌是世界上发病率和死亡率最高的恶性肿瘤之一。肺腺癌作为肺癌中最常见的类型,在组织学类型、基因突变及预后方面具有明显的异质性。微乳头结构(micropapillary pattern,MPP)是指游离的中央缺乏纤维血管的细胞簇。伴微乳头型肺腺癌(pulmonary adenocarcinoma with micropapillary pattern,MPPAC)属于一种具有高度恶性潜能的独特组织学亚型[1, 2],具有高度侵袭性,常伴早期淋巴结转移及广泛的淋巴管瘤栓,伴有MPP是肺腺癌患者预后差的一项重要因素[3, 4]。目前,关于MPPAC与术后辅助治疗疗效相关性的研究较少。Warth等[5]的研究发现,辅助化疗可提高Ⅲ/Ⅳ期浸润型肺腺癌总体生存率,但未发现其能够改善MPPAC患者的预后。另外,该研究也未发现术后放疗(PORT)是否可提高MPPAC患者的生存率。本研究通过回顾性分析本院pN2-3期根治术后的MPPAC患者的临床资料,探讨术后辅助治疗与该类肺癌预后之间的关系,以期为MPPAC患者根治术后的临床治疗提供理论依据,达到肺癌个体化治疗的目的。
1.入组与排除标准:入组标准为无术前新辅助化疗;一般状况评分(ECOG评分)为0或1;手术类型为肺内肿物完全切除及系统淋巴结清扫且经术后病理证实为完全切除;术后病理证实为MPPAC;病理分期为pN2-3期。排除标准为术前进行辅助化疗或放疗;术后病理证实为浸润前病变、微浸润性肺腺癌及浸润性肺腺癌;术后病理证实肺内肿物未完全切除;术后病理分期为Ⅰ期、Ⅱ期或Ⅳ期;手术时患有严重的心脏、肝脏、肾脏及精神疾病;术中使用抗肿瘤药物治疗;术后发生重度感染;除肺癌外还患有其他恶性肿瘤。
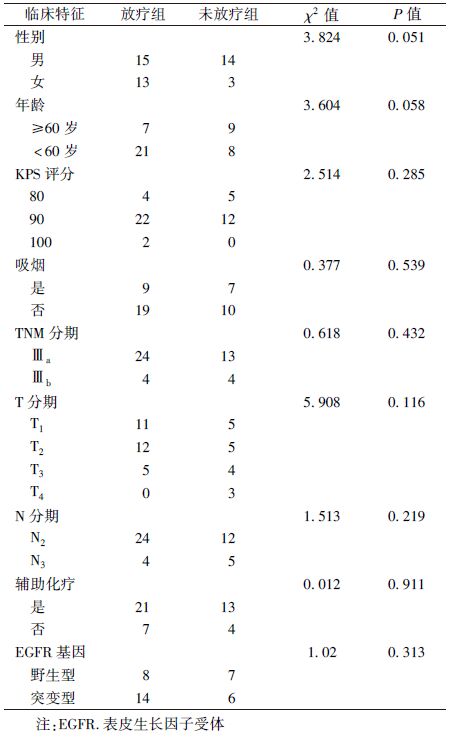
2. 临床资料:选择2012年1月至2014年12月在天津医科大学肿瘤医院收治的根治性切除术后,经细胞学或病理学确诊的伴微乳头结构的Ⅲ期肺腺癌患者45例。所有患者KPS评分80~100,其中男性29例,女性16例,年龄33~74岁(中位年龄58岁)。所有患者均未行术前诱导化疗,手术均为完全切除和系统淋巴结清扫的根治性手术,主要切除方式为肺叶切除,为排除围手术期死亡,生存期<4个月的患者被排除。放疗的总剂量为50~60 Gy。辅助化疗为铂类为基础的双药联合方案,包括培美曲塞、紫杉醇、长春瑞滨联合顺铂或卡铂的方案。靶向治疗药物包括厄洛替尼、吉非替尼及埃克替尼。所有患者均在术前接受胸腹部CT、颅脑MRI、全身骨扫描或PET-CT,以排除远处转移。35例(77.8%)患者接受了基因检测。根据患者术后是否行放射治疗分为放疗组(28例)和未放疗组(17例)。两组患者一般临床资料见表1。
| 表1 2组患者的临床资料 |
3. 治疗方法
(1)放疗:利用Pinnacle3 8.0 m治疗计划系统,在每例患者的定位CT图像上勾画放疗靶区。在纵隔窗勾画纵隔内肿物、纵隔阳性淋巴结及正常器官,在肺组织窗勾画位于肺内的肿物。肿瘤靶区(gross target volume,GTV)包括肺部病灶和纵隔肿大淋巴结,临床靶区(clinical target volume,CTV)在GTV基础上外放0.5 cm,并包括诱导化疗前影像学证实转移的淋巴结所在的整个淋巴引流区,计划靶区(planning target volume,PTV)在CTV基础上向各方向均匀外扩0.5 cm。处方剂量PTV为50~63 Gy/25~30次,单次剂量为1.8~2.1 Gy。95%PTV体积接受大于等于其处方剂量。正常器官限量:脊髓最大剂量<45 Gy;肺V20<30%(同步化疗V20<28%),平均肺剂量<15 Gy;食管V50<50%;心脏V30<40%。10例(35.7%)患者采用3D-CRT技术,18例(64.3%)患者采用IMRT技术。
(2)化疗:34例患者术后行辅助化疗,化疗方案包括培美曲塞+顺铂(51.2%),培美曲塞+卡铂(28.6%),紫杉醇+顺铂(9.2%),紫杉醇+卡铂(4.6%)及其他含铂方案(6.4%),化疗周期为1~4周期(中位2个周期)。15例(53.6%)患者行同步放化疗,化疗方案为培美曲塞+顺铂,周期为1~2周期。
(3)靶向治疗:20例患者术后接受靶向治疗,靶向药物主要包括厄洛替尼、吉非替尼及埃克替尼。
4. 观察终点:总生存期(overall survival,OS):从病理确诊日期开始至患者死亡或末次随访日期;无进展生存期(disease free survival,DFS):从病理确诊开始至肿瘤出现影像学证实的进展复发或死亡或末次随访日期。区域复发包括原发灶及纵隔和锁骨上区域淋巴结的复发,除此之外的转移灶均视为远处转移。
5. 随访:方式主要包括患者的病例资料、电话及门诊复查等。术后前2年每3个月复查1次,其后每半年复查1次。截止2015年3月31日末次随访结束,29例(64.4%)患者已死亡,中位随访时间为22.3个月。
6. 统计学处理:采用SPSS 20.0统计软件进行分析。Kaplan-Meier法进行生存分析,并用Log-rank法比较组间生存率差异,Cox比例风险模型对生存进行多因素分析。P<0.05为差异具有统计学意义。
1.治疗情况:见表1。分析显示,是否放疗与患者的性别、年龄、KPS评分、吸烟状况、TNM分期、T水平、N水平、是否辅助化疗及表皮生长因子受体(epidermal growth factor receptor,EGFR)基因是否突变无明显相关性(P>0.05)。
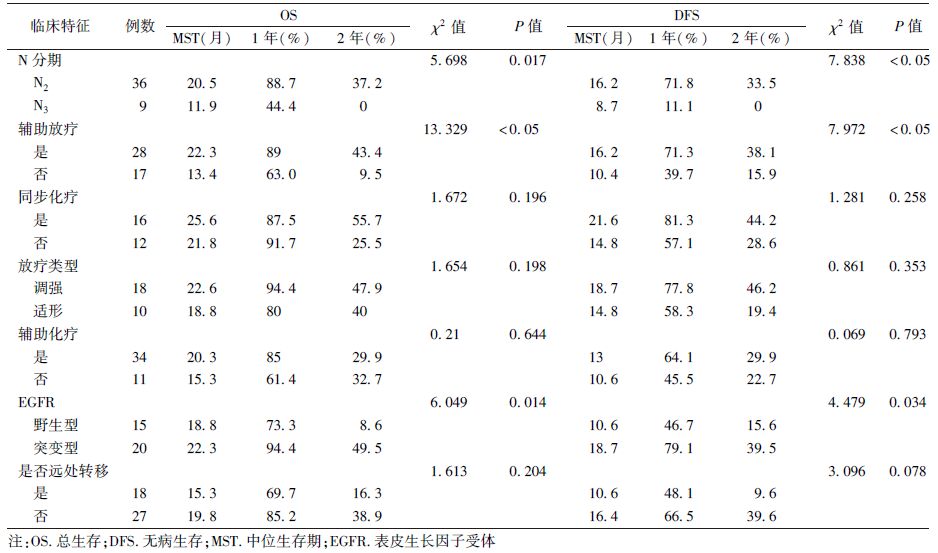
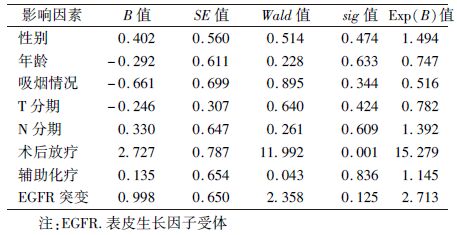
2. 生存分析:全组患者的中位总生存时间为19.8个月(95%CI:18.03~24.49个月),1年及2年总生存率分别为79.4%和30.3%。单因素分析显示,是否行PORT(χ2=13.329,P<0.05)、淋巴结受侵水平(χ2=5.698,P=0.017)及是否存在EGFR突变(χ2=6.049,P=0.014)是影响OS的重要因素(表2)。将可能影响预后的因素纳入Cox多因素分析模型显示,是否行PORT是影响OS的独立因素(P<0.05,表3)。
| 表2 预后因素的单因素分析 |
| 表3 预后因素的多因素回归分析 |
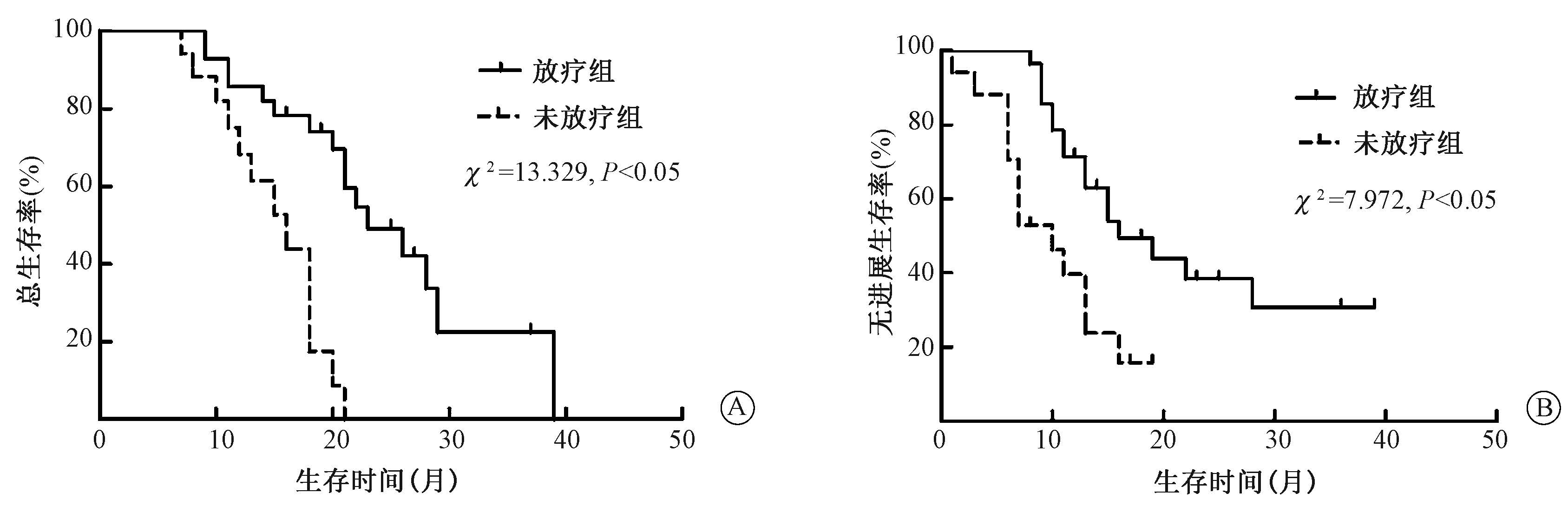
放疗组患者在OS和DFS方面明显好于未放疗组(图1),二者的中位OS分别为22.3和13.4个月(χ2=13.329,P<0.05)。亚组分析发现,放疗组共有21例(75%)患者术后行辅助化疗,化疗患者和未化疗患者中位OS分别为22.3和21.1个月(P>0.05)。另外,放疗组共16例患者行同步放化疗,12例患者行单纯放疗,二者中位OS分别为25.6和21.8个月(P>0.05)。
|
图1 术后放疗对患者预后的影响 A.总生存率;B.无进展生存率 |
全组患者EGFR突变率57.14%(20/35)。亚组分析发现,对于伴有EGFR突变的患者,放疗组和未放疗组中位OS分别为25.6和18.4 个月(χ2=9.268,P=0.002);对于无EGFR突变的患者,放疗组和未放疗组中位OS分别为21.8和10.6个月(χ2=9.595,P=0.002)。
3. 复发情况:患者的中位无病生存时间为13个月(95%CI:10.13~15.87个月),1年及2年无病生存率分别为59.3%和28.9%。单因素分析结果显示,是否行PORT、淋巴结受侵水平及EGFR突变情况是影响DFS的重要因素(χ2=4.479~18.684,P<0.05,表2)。放疗组和未放疗组的中位DFS分别为16.2和10.4个月(χ2=7.972,P<0.05)。亚组分析发现,对于放疗组,行术后化疗患者和未行化疗患者中位DFS分别为16.2和18.7个月(P>0.05)。同步放化疗患者和单纯放疗患者中位DFS分别为21.6和14.8个月(P>0.05)。对于伴有EGFR突变的患者,放疗组和未放疗组患者的中位DFS分别为21.6和12.6个月(P>0.05);对于不伴有EGFR突变的患者,放疗组和未放疗组患者的中位DFS分别为15.2和6.6个月(χ2=4.538,P=0.033)。
全组共有11例(24.4%)患者出现局部复发,18例(40%)患者发生远处转移,7例(15.6%)患者既出现局部复发又发生远处转移。放疗组和未放疗组局部复发率分别为14.3%和41.2%(χ2=4.141,P=0.042),远处转移率分别为35.7%和47.1%(P>0.05)。行术后化疗患者和未行术后化疗患者局部复发率分别为23.5%和27.3%(P>0.05),远处转移率分别为29.4%和72.7%(χ2=6.497,P=0.011)。
2011年,国际肺癌研究协会/美国胸科协会/欧洲呼吸协会(IASLC/ATS/ERS)对肺腺癌进行了新分类,首次提出将MPP为主型肺腺癌作为一独立的组织学类型。之后,来自世界各地的大样本回顾性研究均发现与其他浸润性腺癌相比,MPP为主型肺腺癌预后较差[5, 6, 7, 8, 9]。近期几项以中国人群为对象的研究也得出同样的结论[10, 11, 12]。对于行根治性切除的局部晚期NSCLC,PORT能够降低局部区域复发率[13]。Lally等[14]分析美国监测、流行病学与最终结果数据库(SEER)发现,PORT能够显著延长pN2期患者的生存期。另外,酒石酸长春瑞滨注射液辅助化疗国际试验者协会(ANITA)研究发现,对N2期NSCLC,单纯根治术中位生存期仅1.1年,加用术后化疗后提高至2.0年,如果再加用PORT,中位生存期提高至3.9年[15],提示术后放化疗的联合应用可以进一步提高生存率。
PORT是否同样能够改善pN2期MPPAC患者的预后呢?Warth等[5]研究发现,辅助化疗可提高Ⅲ/Ⅳ期浸润型肺腺癌总体生存率,但未发现其能够改善MPPAC患者的预后,另外,该研究也未发现PORT可提高MPPAC患者的生存率。值得注意的是,只有22例Ⅲ/Ⅳ期MPPAC患者被纳入该研究,且未明确N分期。本研究共包含36例pN2期MPPAC患者,结果显示是否放疗与患者的性别、年龄、KPS评分、吸烟状况、TNM分期、T水平、N水平、是否辅助化疗及EGFR基因是否突变无明显相关性。放疗组较未放疗组有更高的OS及DFS。这可能与MPPAC局部复发率高有关[16, 17]。Nitadori等[16]研究发现,伴有MPP是影响肺腺癌局部切除术后局部复发的独立因素。Hung等[17]分析国内283例根治术后肺腺癌患者,同样发现MPPAC更易发生局部复发。本研究结果显示,放疗组较未放疗组局部复发率明显降低。另外,本研究发现,术后行辅助化疗患者远处转移率明显低于未行术后化疗患者,提示对于MPPAC,术后辅助化疗可以降低患者发生远处转移的风险。
已知EGFR突变更易发生在女性、非吸烟及亚洲人群中。很多研究发现MPPAC患者EGFR突变率显著高于其他类型,其中以东亚人群为对象的研究更加显著[8, 18, 19, 20]。然而,也有研究未发现MPPAC患者EGFR突变率高[21, 22, 23, 24]。本研究共发现20例(57.1%)患者存在EGFR突变,突变率高于一般类型肺腺癌。生存分析发现,伴有EGFR突变患者预后明显好于未突变者。另外,对于MPPAC患者,无论是否伴有EGFR突变,放疗组比非放疗组都有更高的OS及DFS。因此,对于根治术后的MPPAC患者,应进行放射治疗,同时应强调基因检测的重要性,继而通过放疗联合靶向治疗(TKI)的综合治疗达到最好的肿瘤控制。
另外,本研究全组pN2-3期MPPAC患者的中位OS为19.8个月,1年及2年OS分别为79.4%、30.3%。中位DFS为13个月,1年及2年DFS分别为59.3%、28.9%。手术加术后放化疗疗效明显低于国内外文献报道的非手术治疗——同步放化疗。本研究回顾性分析的数据再次表明,手术在此类患者中的作用存疑。
由于MPPAC发病率低,因此,本研究纳入的病例数较少。另外,由于患者放疗剂量及分割模式不一致,也会对结果产生一定影响。但是本研究证实,对于根治术后的局部晚期MPPAC患者,PORT能够改善预后,提高患者生存率,术后辅助化疗能够降低患者远处转移的风险。同时,MPPAC患者EGFR突变率显著高于一般肺腺癌,放疗联合酪氨酸激酶抑制剂(TKI)治疗或许能够提高生存率,但还需要更多临床试验来分析MPPAC患者能否从TKI治疗中获得长期生存。
| [1] | Amin MB, Tamboli P, Merchant SH, et al. Micropapillary component in lung adenocarcinoma: a distinctive histologic feature with possible prognostic significance[J]. Am J Surg Pathol, 2002,26(3):358-364. |
| [2] | Tsutsumida H, Nomoto M, Goto M, et al. A micropapillary pattern is predictive of a poor prognosis in lung adenocarcinoma, and reduced surfactant apoprotein A expression in the micropapillary pattern is an excellent indicator of a poor prognosis[J]. Mod Pathol, 2007,20(6):638-647. |
| [3] | Miyoshi T, Satoh Y, Okumura S, et al. Early-stage lung adenocarcinomas with a micropapillary pattern, a distinct pathologic marker for a significantly poor prognosis[J]. Am J Surg Pathol, 2003,27(1):101-109. |
| [4] | Nagano T, Ishii G, Nagai K, et al. Structural and biological properties of a papillary component generating a micropapillary component in lung adenocarcinoma[J]. Lung Cancer, 2010,67(3):282-289. |
| [5] | Warth A, Muley T, Meister M, et al. The novel histologic International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification system of lung adenocarcinoma is a stage-independent predictor of survival[J]. J Clin Oncol, 2012,30(13):1438-1446. |
| [6] | Yoshizawa A, Motoi N, Riely GJ, et al. Impact of proposed IASLC/ATS/ERS classification of lung adenocarcinoma: prognostic subgroups and implications for further revision of staging based on analysis of 514 stage I cases[J]. Mod Pathol, 2011,24(5):653-664. |
| [7] | Yoshizawa A, Sumiyoshi S, Sonobe M, et al. Validation of the IASLC/ATS/ERS lung adenocarcinoma classification for prognosis and association with EGFR and KRAS gene mutations: analysis of 440 Japanese patients[J]. J Thorac Oncol, 2013,8(1):52-61. |
| [8] | Tsuta K, Kawago M, Inoue E, et al. The utility of the proposed IASLC/ATS/ERS lung adenocarcinoma subtypes for disease prognosis and correlation of driver gene alterations[J]. Lung Cancer, 2013,81(3):371-376. |
| [9] | Cha MJ, Lee HY, Lee KS, et al. Micropapillary and solid subtypes of invasive lung adenocarcinoma: clinical predictors of histopathology and outcome[J]. J Thorac Cardiovasc Surg,2014,147(3):921-928.e2. |
| [10] | Song Z, Zhu H, Guo Z, et al. Prognostic value of the IASLC/ATS/ERS classification in stage I lung adenocarcinoma patients-based on a hospital study in China[J]. Eur J Surg Oncol, 2013,39(11):1262-1268. |
| [11] | Zhang J, Wu J, Tan Q, et al. Why do pathological stage IA lung adenocarcinomas vary from prognosis?: a clinicopathologic study of 176 patients with pathological stage IA lung adenocarcinoma based on the IASLC/ATS/ERS classification[J]. J Thorac Oncol, 2013,8(9):1196-1202. |
| [12] | Gu J, Lu C, Guo J, et al. Prognostic significance of the IASLC/ATS/ERS classification in Chinese patients-A single institution retrospective study of 292 lung adenocarcinoma[J]. J Surg Oncol, 2013,107(5):474-480. |
| [13] | PORT Meta-analysis Trialists Group. Postoperative radiotherapy in non-small-cell lung cancer: systematic review and meta-analysis of individual patient data from nine randomised controlled trials[J]. Lancet,1998,352(9124):257-263. |
| [14] | Lally BE, Zelterman D, Colasanto JM, et al. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the surveillance, epidemiology, and end results database[J]. J Clin Oncol, 2006,24(19):2998-3006. |
| [15] | Douillard JY, Rosell R, De Lena M, et al. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer treated with adjuvant chemotherapy: the adjuvant Navelbine International Trialist Association (ANITA) Randomized Trial[J]. Int J Radiat Oncol Biol Phys, 2008,72(3):695-701. |
| [16] | Nitadori J, Bograd AJ, Kadota K, et al. Impact of micropapillary histologic subtype in selecting limited resection vs lobectomy for lung adenocarcinoma of 2 cm or smaller[J]. J Natl Cancer Inst, 2013,105(16):1212-1220. |
| [17] | Hung JJ, Jeng WJ, Chou TY, et al. Prognostic value of the new International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society lung adenocarcinoma classification on death and recurrence in completely resected stage I lung adenocarcinoma[J]. Ann Surg, 2013,258(6):1079-1086. |
| [18] | Shim HS, Lee da H, Park EJ, et al. Histopathologic characteristics of lung adenocarcinomas with epidermal growth factor receptor mutations in the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society lung adenocarcinoma classification[J]. Arch Pathol Lab Med, 2011,135(10):1329-1334. |
| [19] | Li H, Pan Y, Li Y, et al. Frequency of well-identified oncogenic driver mutations in lung adenocarcinoma of smokers varies with histological subtypes and graduated smoking dose[J]. Lung Cancer, 2013,79(1):8-13. |
| [20] | Song Z, Zhu H, Guo Z, et al. Correlation of EGFR mutation and predominant histologic subtype according to the new lung adenocarcinoma classification in Chinese patients[J]. Med Oncol, 2013,30(3):645. |
| [21] | Zhang Y, Sun Y, Pan Y, et al. Frequency of driver mutations in lung adenocarcinoma from female never-smokers varies with histologic subtypes and age at diagnosis[J]. Clin Cancer Res, 2012,18(7):1947-1953. |
| [22] | Sun PL, Seol H, Lee HJ, et al. High incidence of EGFR mutations in Korean men smokers with no intratumoral heterogeneity of lung adenocarcinomas: correlation with histologic subtypes, EGFR/TTF-1 expressions, and clinical features[J]. J Thorac Oncol, 2012,7(2):323-330. |
| [23] | Rekhtman N, Ang DC, Riely GJ, et al. KRAS mutations are associated with solid growth pattern and tumor-infiltrating leukocytes in lung adenocarcinoma[J]. Mod Pathol, 2013,26(10):1307-1319. |
| [24] | Sumiyoshi S, Yoshizawa A, Sonobe M, et al. Pulmonary adenocarcinomas with micropapillary component significantly correlate with recurrence, but can be well controlled with EGFR tyrosine kinase inhibitors in the early stages[J]. Lung Cancer, 2013,81(1):53-59. |
 2015, Vol. 35
2015, Vol. 35