2. 宁夏医科大学生理教研室;
3. 北京大学医学部干细胞研究中心;
4. 深圳惠恒集团医学部
全称为伽玛射线立体定向治疗系统。伽玛刀治疗即为立体定向放射外科治疗的一种,其主要优点是损伤小,治疗安全,局部控制率高,对患者全身状况要求低,尤其对于脑深部及重要结构的病灶,治疗后随着病灶的缩小和水肿的消失,患者的临床状况很快得到改善[1]。目前,伽玛刀治疗的适应证主要在头颈部疾患,包括肿瘤和功能性疾病。
电离辐射能诱导细胞发生自噬、凋亡及DNA损伤[2, 3, 4],最终导致细胞死亡[5]。本实验旨在探讨伽玛刀不同剂量照射大鼠三叉神经(感觉根)后对照射范围内三叉神经组织的损伤情况,以及对周围临近脑干组织和脑桥的影响,为临床优化伽玛刀照射剂量提供理论依据。
1. 实验动物及分组:10周龄健康SD大鼠65只,体重350~400 g,购于宁夏医科大学动物中心。生产许可证号:scxk(宁)2011-0001。用完全随机分组法,将实验动物分为20、40、80、160 Gy组照射三叉神经,每个剂量点照射后均饲养1、2、4周,同时设立假照组,每组5只。假照组取材后一部分作为不加一抗的阴性对照组(NC组)。在照射后1、2、4周分别处死待检[6],假照组按照射组相同方法进行麻醉并放入伽玛刀治疗系统中模拟照射(不照射)。照射后的大鼠按照动物伦理管理制度,在清洁级条件下饲养,正常给水及食物,定期观察记录其行为表现。
2. 主要仪器及试剂:伽玛刀治疗床(深圳惠恒集团);RWD-68002双臂脑立体定位仪(标准型,大鼠适用,深圳瑞沃德生命科技有限公司)。Nissl染色剂、抗53BP1抗体、抗XRCC1抗体、Anti-LC3B抗体均购自美国Abcam公司;SP试剂盒、DAB试剂盒购于福州迈新生物技术开发有限公司。
3. 照射方法:根据大鼠脑立体定位图谱确定三叉神经根位置(精度0.1 mm),在定位仪下定位大鼠的前囟。每次照射前先用X光片曝光校准照射中心,即照射原点(将X光胶片固定在大鼠对耳线中点所在位置,校准,直至胶片上焦点与大鼠对耳线中点所在位置完全重合)。根据大鼠解剖图谱确定解剖原点与照射原点之间的位置关系,通过设置伽玛刀治疗参数(即根据图谱向后移动7.3 mm),使伽玛刀照射原点、大鼠脑立体定位仪原点、大鼠脑解剖原点3点重合,再根据图谱向左侧旁开3 mm,确定三叉神经的位置。采用5%的水合氯醛按0.7 ml/100 g的给药量腹腔注射麻醉大鼠,然后将麻醉后的大鼠固定于伽玛刀立体定位架上,并用定向固定装置(RWD-68002)固定。选择直径4 mm的准直器,调整仪器参数至靶中心最大剂量分别为20、40、80、160 Gy进行照射。每组剂量率均为24.42 mGy/s(机器剂量率为定值)。
4.标本采集与观测:每天观察大鼠的行为,并称重。在第1、2、4周末分别将各组大鼠处死,取大鼠全脑组织,进行固定、脱水、包埋、切片,取三叉神经核团所在脑干部位留置切片(约为bregma -6.48~-9.00 mm图谱段),再进行MAPLC3II染色、53BP1染色、XRCC1染色、HE染色和Nissl染色。在100和400倍镜下观察三叉神经核团细胞损伤情况。照射组照射侧部位与假照组相同部位对比。其中,HE和Nissl染色观察细胞结构是否发生异常及损伤,免疫组织化学MAPLC3II染色观察照射范围内细胞发生自噬的情况,53BP1和XRCC1染色分别为检测细胞照射后的DNA损伤及DNA损伤的修复情况。
5.免疫组织化学染色:石蜡切片置于67℃烘箱中,烘片、脱蜡,用pH7.4的PBS冲洗3次。取pH 6.0柠檬酸盐缓冲液,微波加热至沸腾,将脱蜡水化后的组织切片放入沸腾的缓冲液中,微波处理10 min,自然冷却,清洗。每张切片加1滴3%H2O2,室温下孵育10 min,以阻断内源性过氧化物酶的活性。清洗后每张切片加1滴第一抗体(相应稀释倍数),室温下孵育2 h。PBS冲洗后加1滴聚合物增强剂,室温下孵育20 min。加1滴酶标抗鼠/兔聚合物,室温下孵育30 min,PBS冲洗。加1滴新鲜配制的二氨基联苯胺(DAB)液,显微镜下观察。苏木素复染,0.1%HCl分化,自来水冲洗,蓝化,切片经梯度乙醇脱水干燥,二甲苯透明,中性树胶封固,晾干后观察。
6. 自噬的剂量-效应关系测定:每张MAPLC3B染色切片取3个视野,人工计数切片中每个视野内发生自噬的细胞数以及总细胞数,计算自噬细胞数和总细胞数的平均值,二者之比即为细胞自噬率,观察细胞发生自噬的剂量-效应关系。每张53BP1和XRCC1染色切片取3个视野,通过Image Pro Plus图像处理软件测得每个视野中阳性细胞显色的整体光密度(IOD)值[7],并计算其平均值。
7.统计学处理:数据结果用 ±s表示。采用SPSS 13.0软件进行统计分析,组间比较采用方差分析。P<0.05为差异有统计学意义。
±s表示。采用SPSS 13.0软件进行统计分析,组间比较采用方差分析。P<0.05为差异有统计学意义。
1. 行为学表现:假照组、20和40 Gy照射组均未出现行为异常。80和160 Gy组在第3周出现照射部位毛发脱落,160 Gy组脱落较明显。各组大鼠摄食、排泄、行为、运动均无异常。体重除健康对照组外,均于照射后1周内略有减轻,后正常增长。照射过程中无动物死亡。
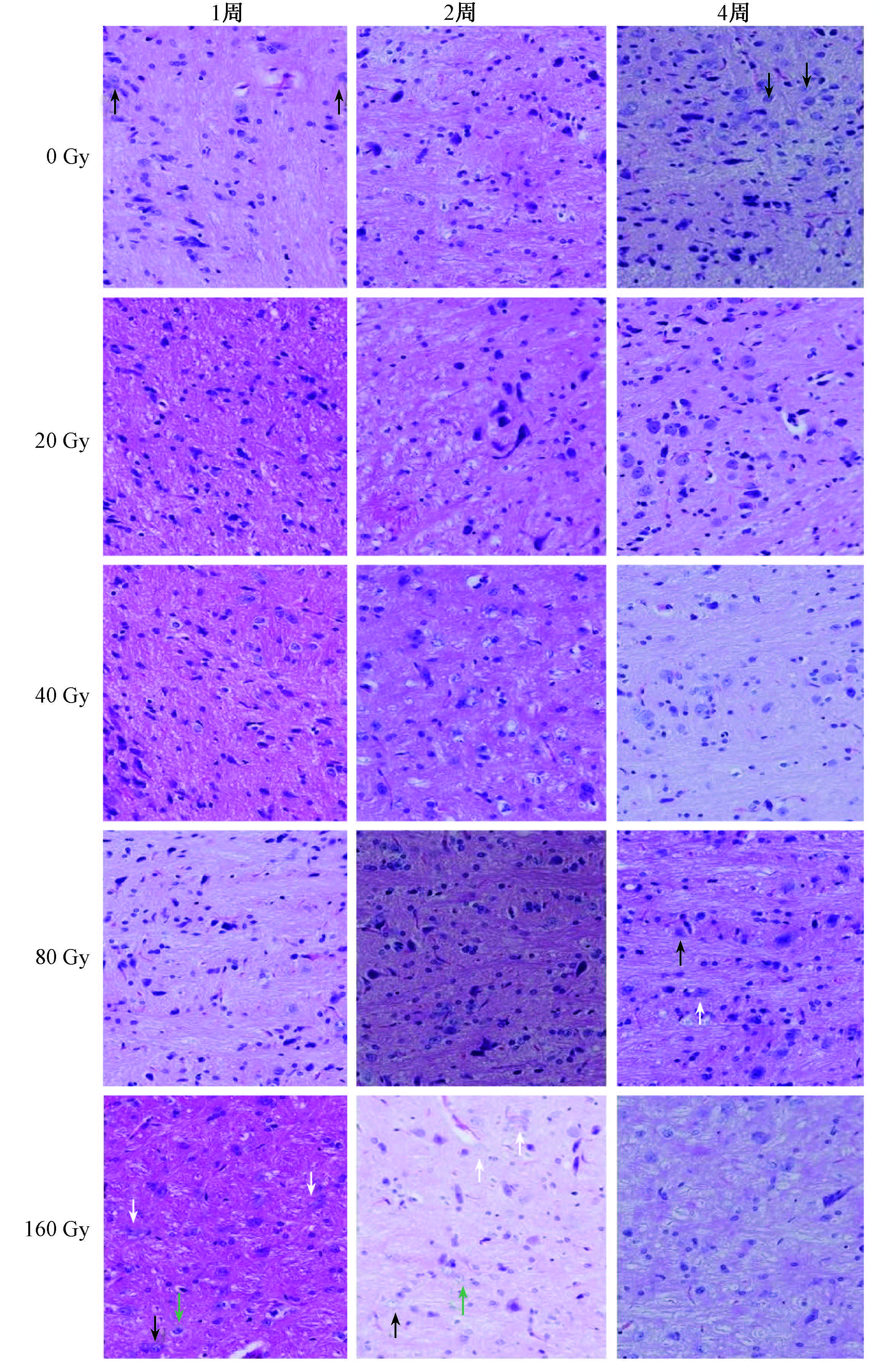
2.HE染色:假照组以及20 Gy(0 h,1、2、4周)和40 Gy(1、2、4周)照射组的三叉神经根及脑干区域细胞结构紧密,形态完整、排列整齐,层次清晰,细胞核饱满、核仁清晰,无胶质细胞的浸润。80 Gy(1、2周)照射组镜下观察发现,三叉神经根及脑干组织基本正常;80 Gy(4周)照射部位神经元细胞发生肿大,胞质变浅,突触消失,轮廓不清,未见明显神经细胞凋亡及组织坏死,脑干神经元形态与结构正常。160 Gy(1、2周)照射组的三叉神经根的细胞出现肿大、核碎片状断裂、空泡化等病理改变,4周时有所减轻,提示有细胞自修复发生(图1)。
|
注:0 Gy组箭头指示正常神经元细胞; 80 Gy组黑色箭头指示肿大细胞,白色箭头指示突触消失细胞; 160 Gy组白色箭头指示肿大细胞,黑色箭头指示出现空泡的细胞,绿色箭头指示出现细胞核碎片状断裂的细胞 图1 各组大鼠照射侧照后不同时间三叉神经核团镜下观察 HE染色 ×400 |
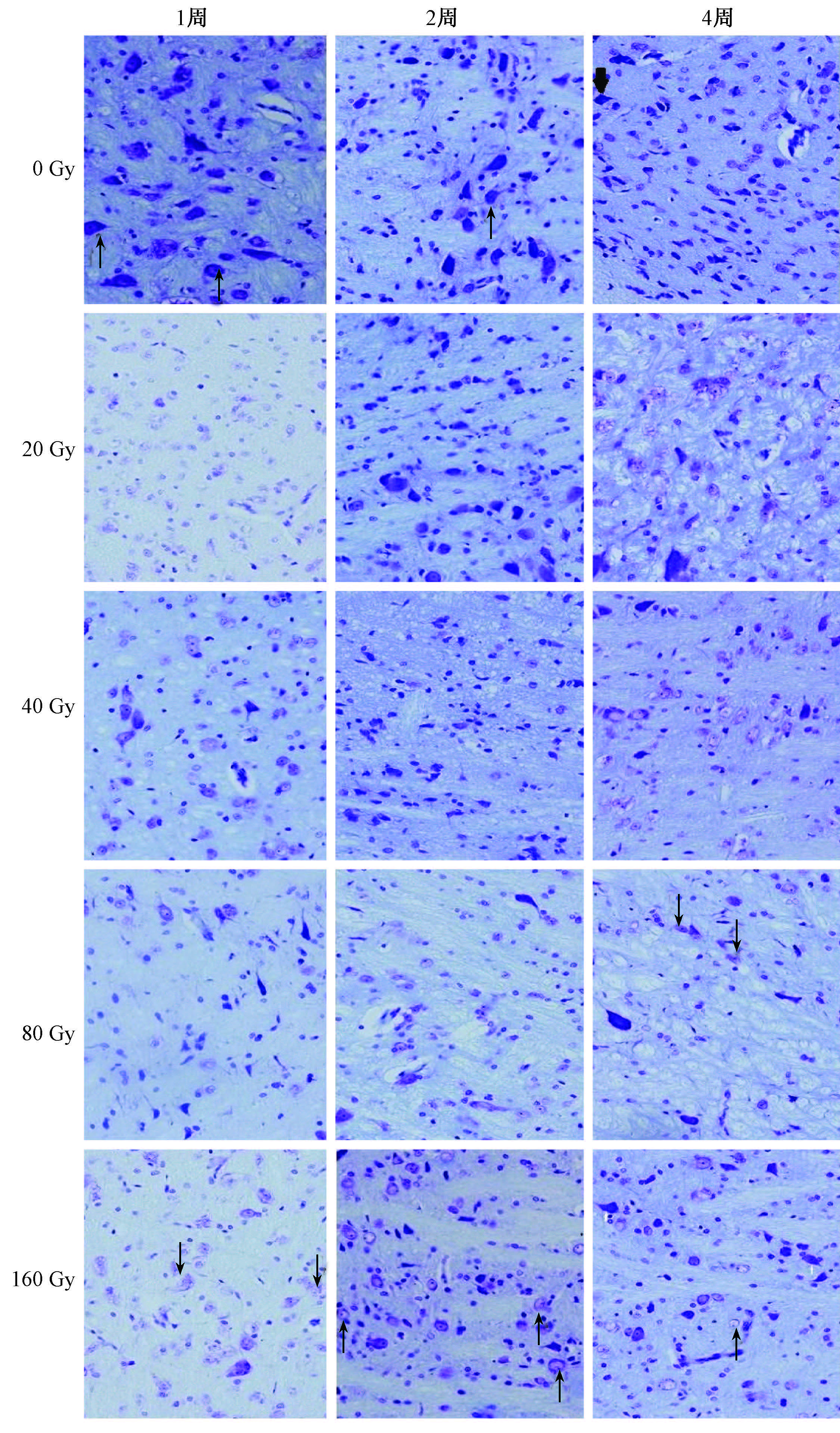
3. Nissl染色:假照组、20 Gy(0 h,1、2、4周)40 Gy(1、2、4周)照射组三叉神经根神经元细胞均无明显异常,无胶质细胞浸润。80 Gy(4周)及160 Gy(1、2、4周)组照射部位均可见到有神经元Nissl染色细胞膜增厚、核膜边界模糊、细胞质浅染、细胞内Nissl体丢失溶解,且160 Gy(1周)组最为明显,4周时上述现象有所减轻 (图2)。
|
注:0 Gy组中箭头指示正常带有尼氏体的细胞; 80和160 Gy组中箭头指示尼氏体丢失的细胞 图2 各组大鼠照射侧三叉神经核团镜下观察 Nissl染色 ×400 |
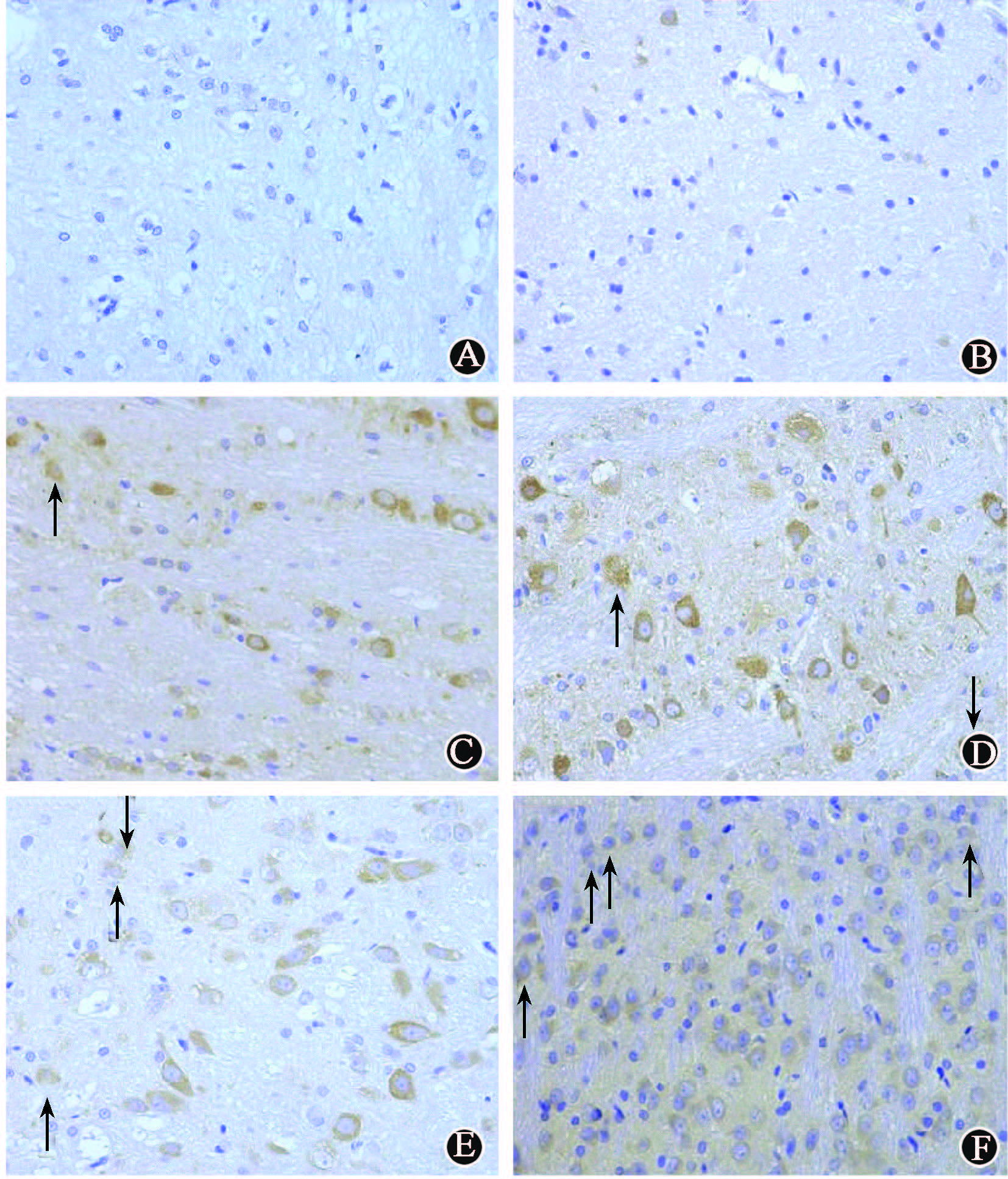
4.MAPLC3B染色:MAPLC3B为细胞质显色,是检测细胞自噬情况的指标。假照组的三叉神经根及脑干区域细胞结构形态正常且完整,细胞核饱满、核仁清晰,无明显染色剂着色。细胞计数测得假照组平均细胞自噬率为3.63%。20 Gy(1、2、4周)、40 Gy(1、2、4周)照射组的三叉神经根的少部分神经元细胞形态可见变化,出现细胞质着色等,大部分神经纤维致密,结构正常,无明显染色剂着色。80 Gy(1、2、4周)照射组镜下观察发现,照射组三叉神经根的神经元细胞中,形态发生变化及细胞质着色的细胞数量进一步增多,其余部分神经纤维结构正常。160 Gy(1、2、4周)照射组中大部分神经元细胞结构不清,发生形态变化,细胞质明显着色,提示神经元细胞发生自噬的情况较为明显(图3)。细胞计数测得各组细胞平均自噬率见表1。
表1 伽玛刀照射后不同时间各组三叉神经细胞的平均自噬率(%,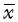 ±s) ±s)
|
|
注:箭头指示发生细胞质阳性显色反应的细胞 图3 各组大鼠照射侧三叉神经核团镜下观察 MAPLC3B染色 ×400 A.NC组;B.假照组;C.20 Gy;D.40 Gy;E.80 Gy;F.160 Gy |
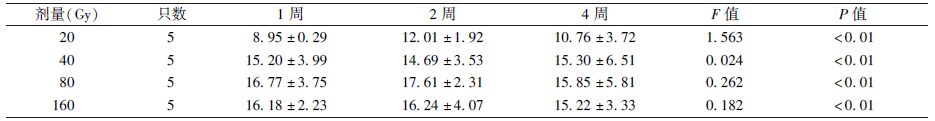
5. 53BP1染色:53BP1为细胞核显色,是检测细胞DNA损伤情况的指标。假照组的三叉神经根及脑干区域细胞结构形态正常且完整,偶见细胞核着色。测得假照组细胞核阳性显色反应的平均IOD值为2.824。
20(1、2、4周)、40(1、2、4周)和80 Gy(1周)照射组的三叉神经根的少部分神经元细胞形态发生变化,可见部分细胞核边界不清,细胞核着色,形态不完整,提示有DNA损伤发生。160 Gy(1、2、4周)、80 Gy(2、4周)照射组镜下观察发现,三叉神经根的神经元细胞形态发生变化的细胞较多,照射组三叉神经根大部分细胞核边界不清,大量细胞核着色,视野内非正常形态细胞占大多数,细胞核形态改变,提示大部分神经元细胞发生DNA损伤,测得各组细胞核阳性显色反应的平均IOD值见表2,图4。
表2 照射后不同时间各组细胞核53BP1阳性显色反应的平均整体光密度值(平均IOD值,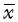 ±s) ±s)
|
|
注:箭头指示发生细胞核阳性显色反应的细胞 图4 各组大鼠照射侧三叉神经核团镜下观察 53BP1染色结果 ×400 A.NC组;B.假照组;C.20 Gy;D.40 Gy;E.80 Gy;F.160 Gy |
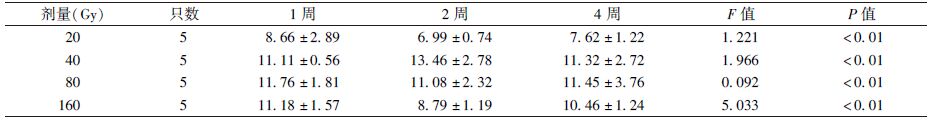
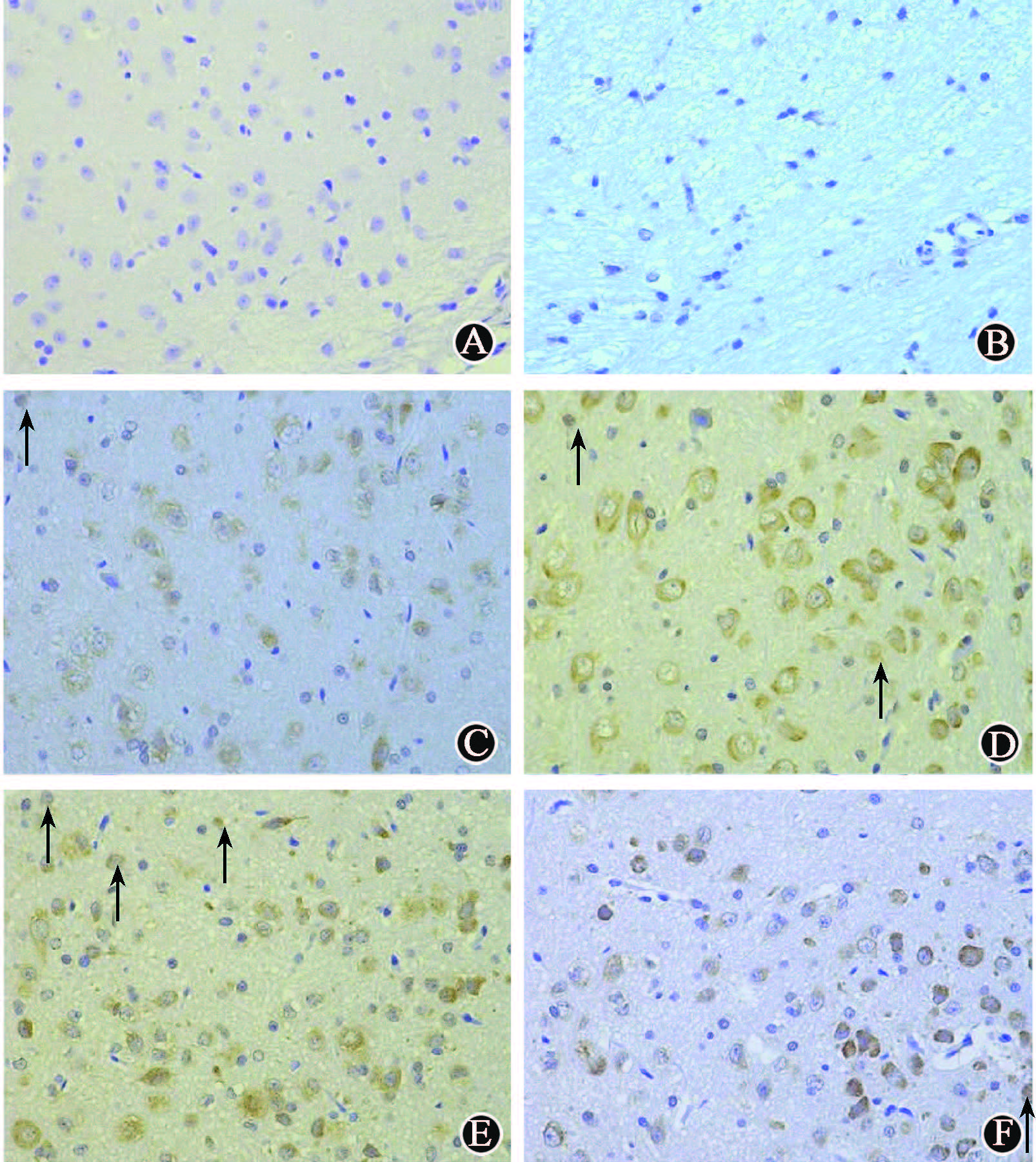
7. XRCC1染色:XRCC1为细胞核显色,是检测细胞DNA损伤修复情况的指标。假照组的三叉神经根及脑干区域细胞结构形态正常且完整,偶见细胞核着色。测得假照组细胞核阳性显色反应的平均IOD值为1.95。
20 Gy(1、2、4周)照射组三叉神经根的少部分神经元细胞形态可见变化,少部分细胞核出现细胞核着色,提示偶有细胞DNA损伤修复发生。40 Gy(1、2、4周)照射组镜下观察发现,照射组三叉神经根的神经元细胞中,细胞出现细胞核着色情况增加,提示在此条件下神经元细胞发生DNA损伤修复的现象明显增多。80 Gy(1、2、4周)照射组三叉神经根的神经元细胞发生细胞核着色的情况较40 Gy组有一定程度减轻,但多于20 Gy组。160 Gy(1、2、4周)照射组三叉神经根的神经元细胞发生细胞核着色的数量较80 Gy(1、2、4周)照射组进一步减少,低于20 Gy组。结果表明,在20~80 Gy之间,神经元细胞发生DNA损伤修复情况有可能达到峰值,而在高于80~160 Gy或更高的剂量条件下,细胞自身DNA损伤修复能力逐渐降低。测得假照组细胞核阳性显色反应的平均IOD值见表3,图5。
表3 照射后不同时间各组细胞核XRCC1阳性显色反应的平均整体光密度值(平均IOD值,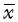 ±s) ±s)
|
|
注:箭头指示发生细胞核阳性显色反应的细胞 图5 各组大鼠照射侧三叉神经核团镜下观察 XRCC1染色 ×400 A.NC组; B.假照组; C.20 Gy组; D.40 Gy组; E.80 Gy组; F.160 Gy组 |
伽玛刀是20世纪末现代高科技的产物,作为一种崭新的无创伤治疗手段,它是医学治疗史上的一个革命性突破。它较传统手术有治疗简便、安全、精确、无明显手术禁忌证、不需要麻醉等优点。在神经外科领域,伽玛刀有着良好的治疗效果以及在最小程度上损伤周边正常组织的特点。尽管如此,该治疗方案仍有待进一步优化,以确保在合理治疗过程中,不会引起周边组织包括脑干组织尤其是脑桥的损伤,有关治疗可能带来的放射损伤领域的研究,尚缺乏科学的基础数据。
本研究拟通过探讨伽玛刀不同剂量照射大鼠三叉神经(感觉根)后对照射范围内三叉神经根、周围脑干和脑桥的影响,为临床优化伽玛刀照射剂量提供理论依据。本实验设计了4个剂量组,结果显示,20 Gy组、40 Gy组照射后1、2和4周,照射组与假照组相比,三叉神经根在照射后无损伤发生,4种剂量对脑干部位均未产生明显影响。由此可以得出,在完善的治疗前准备以及精确的定位和精准的立体定向治疗操作条件下,使用伽玛刀治疗三叉神经时是安全有效的。20和40 Gy的照射不会对大脑造成损害,80和160 Gy照射后三叉神经神经元细胞的自噬和DNA损伤情况较为明显,在20~80 Gy之间时神经元细胞DNA损伤修复水平明显高于其他剂量水平,提示治疗时20~80 Gy之间的照射剂量是安全的,下一步的工作需要在20~80 Gy的范围做细化分组,找到安全剂量的上限,为临床优化伽玛刀照射剂量提供相应的理论依据。本实验结果为急性生物效应,由于放射损伤是一个复杂的生理、病理改变,因此,还需要分子生物学的确切证据,有关放射损伤的亚急性和慢性生物效应、放射治疗的物理剂量及疗效评价有待进一步研究。
| [1] | 李彦和, 郑立高, 徐德生,等. 脑转移瘤伽玛刀治疗[J]. 神经疾病与精神卫生, 2003, 3(1):43-45. |
| [2] | 刘晓冬. 电离辐射诱导的细胞自噬及其与凋亡的转换关系[J]. 中华放射医学与防护杂志, 2014, 34(6):401-404. |
| [3] | 徐慧英. 乏氧诱导因子1α在电离辐射诱导人乳腺癌细胞自噬中的作用研究[D]. 长春:吉林大学, 2013. |
| [4] | 易贺庆. miR-199a-5p在电离辐射诱导乳腺癌细胞自噬中作用的研究[D]. 长春:吉林大学, 2013. |
| [5] | 施丹. Beclin 1及其相关基因在电离辐射诱导的自噬性细胞死亡中的作用[D]. 长春:吉林大学, 2009. |
| [6] | 陈晔, 俞向梅, 林凌,等. 渥曼青霉素对脑外伤大鼠自噬及脑保护作用的机制研究[J]. 山西医科大学学报,2011,42(10):797-801. |
| [7] | 姜洋, 金晓明, 屠康. 平均阳性染色面积百分比法分析免疫组化结果初探[J].生物医学工程学杂志,2007,24(3):650-653. |
 2015, Vol. 35
2015, Vol. 35